花色苷在代谢性疾病中的研究进展
田杨杨,周 明,钱 旭,*
1南京医科大学公共卫生学院流行病学系,2营养与食品卫生学系,江苏 南京 211166
代谢性疾病是一类与遗传、环境、生活方式、运动等因素有关的病因复杂、发展缓慢且难以治愈的疾病,涵盖范围广泛,包括2型糖尿病、胰岛素抵抗、肥胖、高脂血症、非酒精性脂肪肝病、动脉粥样硬化性心脑血管疾病以及代谢相关癌症等[1]。近年来,随着人们生活水平的提高,代谢性疾病的患病率不断增加。据世界卫生组织统计,2016年全球有近20亿成年人超重或肥胖,中国拥有最多的肥胖人口。据统计,2017年中国18岁及以上成年人的糖尿病患病率为11.2%[2]。
花色苷是花青素与糖通过糖苷键形成的黄酮类化合物(结构如图1 所示),是植物中的水溶性色素,在花、果实、种子、植物叶子中含量丰富。它们让这些植物器官呈现了红色、蓝色、紫色等色彩鲜艳的颜色。自然界的花色苷有6 种(表1),广泛分布于植物中,分别是矢车菊素(cyanidin,Cn)、飞燕草素(delphinidin,Dp)、锦葵素(malvidin,Ma)、天竺葵素(pelargonidin,Pg)、芍药素(peonidin,Pn)、牵牛花素(petunidin,Pt)[3]。在日常生活中,花色苷的主要来源是有色的水果和蔬菜,如浆果、葡萄、石榴、茄子,以及衍生的产品,如果汁和红酒等。

图1 花色苷基本结构Figure 1 Basic structure of anthocyanins

表1 花色苷概览Table 1 Overview of anthocyanins

(续表1)
目前,花色苷在代谢性疾病中的预防、保护等作用已经取得了一定的研究进展。大量研究显示,花色苷在糖尿病、肥胖、高脂血症等疾病中起到了良好的健康促进作用。本文将围绕花色苷在代谢性疾病中的作用机制进行总结,为花色苷在代谢性疾病的应用提供理论依据。
1 糖尿病
Muraki等[4]根据美国人的3项前瞻性纵向队列研究分析个人的水果摄入量与2型糖尿病之间的关联,对3 464 641人的随访中,12 198例患有2型糖尿病。结果得出,含花色苷较高的蓝莓、葡萄、苹果、香蕉和葡萄柚的摄入量增加与2型糖尿病风险降低呈显著的相关性,每周吃3份蓝莓的人群患2型糖尿病的风险比(hazard ratio,HR)为0.74(95%CI:0.66~0.83),葡萄和葡萄干为0.88(95%CI:0.83~0.93)。中国广东的一项随机对照双盲试验中,共有58例2型糖尿病成年患者分别每天服用2次160 mg花色苷或服用安慰剂,持续24 周。两组基线血清脂质浓度没有差异,24周干预后,服用花色苷组的低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和血清甘油三酯(triglyceride,TG)的血清浓度分别降低了7.9%和23.0%,载脂蛋白(apolipoprotein,apo)B-48和apoC-Ⅲ浓度分别降低了16.5%和11.0%,均具有统计学差异,但安慰剂组中没有显著变化[5]。花色苷抑制糖尿病的作用机制如图2所示。
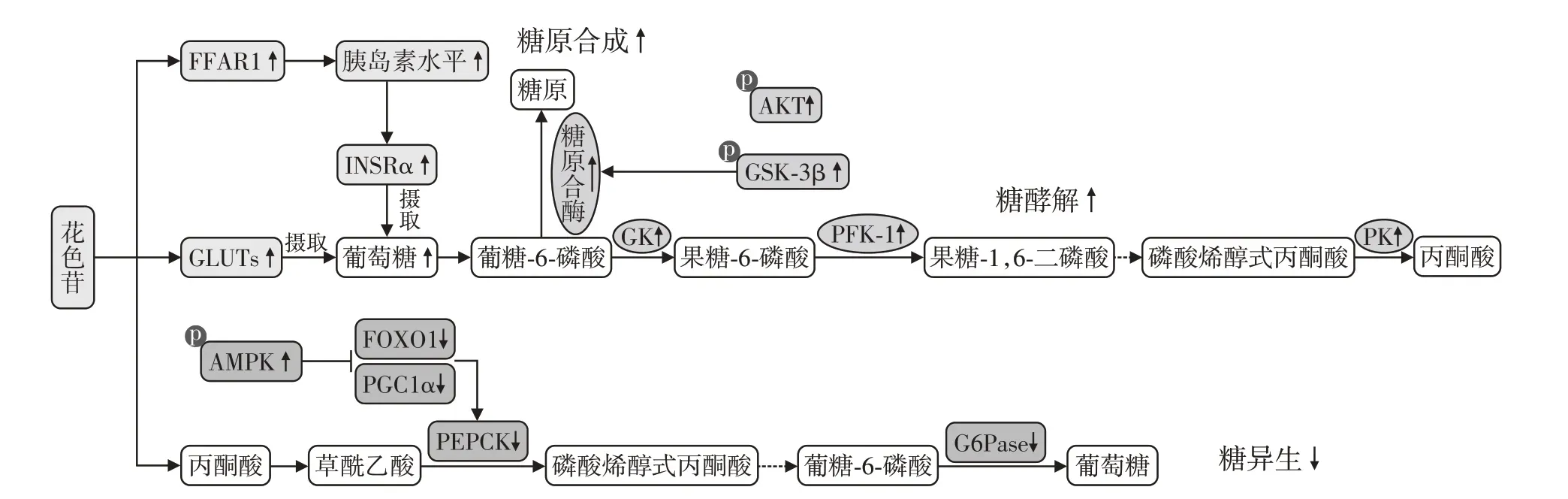
图2 花色苷抑制糖尿病的作用机制Figure 2 Mechanism of anthocyanins in inhibiting diabetes
1.1 花色苷增加胰岛素的敏感性和分泌水平
研究表明花色苷可能通过增加胰岛素的敏感性和分泌水平来改善葡萄糖代谢。在Esposito 等[6]的研究中,高脂肪饮食诱发小鼠产生胰岛素抵抗,高脂饮食补充黑加仑的小鼠在注射胰岛素30、60、120 min 后,它们的胰岛素敏感性有所改善,体重增加减少,葡萄糖代谢得到改善。Luna-Vital 等[7]发现,紫玉米中的花色苷激活游离脂肪酸受体1(free fatty acid receptor 1,FFAR1)依赖蛋白和葡萄糖激酶,增加了胰腺β细胞的胰岛素分泌,导致肝脏葡萄糖摄取增多。
1.2 花色苷增加葡萄糖转运蛋白的表达
花色苷可以上调葡萄糖转运蛋白(glucose transporters,GLUTs)的表达来促进各种细胞类型中的葡萄糖吸收。Sasaki等[8]使用0.2%矢车菊素-3-葡萄糖苷(cyanidin 3-glucoside,C3G)对糖尿病模型小鼠喂养5 周后,小鼠白色脂肪组织中GLUT4 表达明显上调,视黄醇结合蛋白4(retinol binding protein 4,RBP4)表达下调,并伴有白色脂肪组织中炎性脂肪细胞因子(单核细胞趋化蛋白-1、肿瘤坏死因子-α)表达下调,表明花色苷可以下调糖尿病小鼠RBP4 的表达和相关炎症脂肪细胞因子来改善高血糖和胰岛素敏感性。除了GLUT4,GLUT2 也是一种胰岛素敏感的葡萄糖转运蛋白,在肝脏的代谢和葡萄糖摄取中起着重要作用。Jiang 等[9]对糖尿病小鼠分别给予游离的或与蛋白结合的紫薯花色苷化合物处理,发现小鼠肝脏组织中GLUT2、葡萄糖激酶(glucokinase,GK)和胰岛素受体α(insulin receptor α,INSRα)的蛋白表达水平上升。同时,磷酸果糖激酶(phosphofructokinase,PFK)和丙酮酸激酶(pyruvate kinase,PK)在两个处理组中上调。
1.3 花色苷抑制糖异生
在糖异生过程中,葡萄糖-6-磷酸酶(glucose 6-phosphatase,G6Pase)和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)是两种重要的限速酶,促进肝细胞内糖原、蛋白质和脂肪向葡萄糖转化,抑制G6Pase 和PEPCK 的表达可有效抑制血糖的升高。体外数据表明,花色苷和其他多酚可能通过抑制肝细胞的葡萄糖生成来改善葡萄糖代谢[10]。Yan 等[11]用桑葚花色苷提取物处理HepG2 细胞,下调过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor gamma coactivator 1-alpha,PGC-1α)和叉头框蛋白O1(forkhead box protein O1,FOXO1),从而使PEPCK和G6Pase的酶活性降低。而且,桑葚花色苷提取物增加了AKT和糖原合酶3β(glycogen synthase kinase,GSK-3β)的磷酸化,导致糖原合酶2 的表达水平上升,促进了糖原合成,抑制了葡萄糖产生。
另外,许多研究表明在花色苷改善糖尿病的机制中涉及腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路。AMPK 通路也被认为是糖尿病和相关疾病的主要药物靶点,它是一种细胞内能量传感器,参与细胞代谢的维持,其激活被认为可以抑制肝脏中的糖异生作用。Belwal等[12]研究发现,紫玉米提取物增加了AMPK 的磷酸化,降低了肝脏中PEPCK、G6Pase的表达,下调乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACC)和雷帕霉素靶点(mechanistic target of rapamycin,mTOR),增加骨骼肌中GLUT4 的表达,来调节胰岛素抵抗,改善糖尿病。
2 肥胖
Bertoia 等[13]根据对133 468 名美国男性和女性随访长达24 年的3 个大型前瞻性队列研究,分析124 086名男性和女性在4年内的体重变化,得出含有花色苷较高的水果和非淀粉类蔬菜的摄入量增加与4年的体重变化呈负相关,每日增加摄入1份浆果,体重减少503 g(95%CI:354~657 g);每日增加摄入1 份花椰菜,体重减少621 g(95%CI:213~1 030 g)。韩国的一项病例对照研究中,将超重或肥胖的63名参与者分为两组,分别服用富含花色苷的黑豆种皮提取物或安慰剂2.5 g/d,持续8 周。线性回归分析得出,实验组体脂肪量的变化与黑豆种皮提取物摄入量的变化之间存在很强的负相关(R2=0.18,P=0.016),并观察到腹部脂肪减少,总胆固醇(total cholesterol,TC)下降21.5%(P<0.001),TG 下降28.4%(P=0.012),LDL-C 下降19.6%(P<0.001),而安慰剂组没有变化[14]。花色苷抑制肥胖的作用机制如图3所示。

图3 花色苷抑制肥胖的作用机制Figure 3 Mechanism of anthocyanins in inhibiting obesity
2.1 花色苷减少脂质生成,加快脂质分解
Lim 等[15]研究表明,富含矢车菊素-3-O-葡萄糖苷的肋花楸可以降低高脂饮食的C57BL/6 小鼠的血清TG、TC、LDL-C、白色脂肪组织重量和瘦素水平。还可以降低PGC-1α、甾醇调节元件结合蛋白1c(sterol regulatory element-binding transcription factor 1c,SREBP-1c)、ACC1、ATP-柠檬酸裂解酶和脂肪酸合成酶(fatty acid synthase,FAS)等相关蛋白表达来抑制脂肪生成。
此外,花色苷可以通过激活AMPK 来加快脂质分解,从而改善肥胖。短链脂肪酸调节体内脂肪酸合成、脂肪酸氧化和脂肪酸分解之间的平衡。与低脂饮食相比,高脂饮食导致短链脂肪酸减少,而人们摄入花色苷显著提高了体内乙酸、丙酸和戊酸的浓度,尤其显著提高了丁酸的浓度,表明摄入花色苷加速了脂肪酸分解[16]。黑莓花色苷能显著降低超重或肥胖男性24 h 的呼吸熵,表明脂肪氧化增加,导致脂肪积累减少[17]。
2.2 花色苷诱导脂肪组织棕色化
哺乳动物的脂肪组织分为白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT),WAT 含有单房的、大的脂滴和较少的线粒体,而BAT 含有多房脂滴,大量线粒体,并表达通过降低质子梯度来产生热量的解偶联蛋白1(uncoupling protein 1,UCP-1)。C3G 诱导3T3-L1 脂肪细胞向棕色脂肪细胞改变,增加多房脂滴和线粒体含量,增加3T3-L1 脂肪细胞线粒体基因(TFAM、SOD2、UCP-1、UCP-2)、UCP-1 蛋白、棕色脂肪细胞标志物(CITED1、TBX1)的表达,显著增加了线粒体数和耗氧量[18]。C3G除了可以上调小鼠与脂肪酸氧化相关的基因,包括PGC1-α、PGC1-β、CPT1α、MCAD 和PPARα,也可以上调BAT中产热能量消耗相关基因,如UCP1、Cideα和PRDM16。总之,C3G增加了db/db 小鼠的BAT 活性,通过增加能量消耗来改善肥胖[19]。
3 高脂血症
对1 265 名19~74 岁的伊朗德黑兰成年人进行的一项前瞻性研究中,使用食物频率问卷评估花色苷在内的类黄酮的摄入量,中位数为1 422 mg/d,类黄酮摄入量最高的参与者发生高脂血症的风险降低36%(OR=0.64,95%CI:0.48~0.99)[20]。此外,在一项对20~60 岁高脂血症患者的随机双盲对照临床试验中,使用富含花色苷的白越橘果实提取物持续2 个月,与基线相比,TC、TG和LDL-C分别降低了27.6%、19.2%和26.3%,HDL-C 提高了37.5%,并且没有报告不良反应。这说明用白越橘果实进行短期治疗是安全的,并且可以改善高脂血症患者的血脂状况[21]。
花色苷主要通过以下机制改善高脂血症:①降血脂。高剂量紫薯花色苷提取物可以明显降低小鼠的TC、TG 和LDL-C 水平,减少动脉的斑块面积,减轻肝脏的脂肪变性程度,同时还可以降低白细胞介素(interleukin,IL)-1β、IL-6和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)等炎症细胞因子的表达,提高PPARα的表达,从而抑制动脉粥样硬化的发展和高脂血症引起的肝组织脂肪变性[22]。蓝靛果花色苷可通过增加高脂血症大鼠肝脏内LXRα和CYP7a1 mRNA 表达来调节高脂血症大鼠的血脂水平,预防动脉硬化的发生[23]。②改善高密度脂蛋白功能。富含花色苷的黑接骨木提取物可以改善高脂血症小鼠的高密度脂蛋白功能,降低天门冬氨酸氨基转移酶和空腹血糖,和降低主动脉TC含量[24]。
4 非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)
在中国广州的一项前瞻性研究中,研究者使用食物频率问卷调查随访2 694名成年人的花色苷摄入量,同时进行腹部超声检查以评估NAFLD的存在和程度。结果分析得出,在超重/肥胖的中国老年人群中,花色苷在内的黄酮类摄入量较高与NAFLD恶化的风险较低相关,相对风险为0.74(95%CI:0.57~0.96)[25]。
花色苷主要通过以下机制抑制非酒精性脂肪肝:①减少脂质生成。花色苷处理Caco-2 细胞后,可通过提高低密度脂蛋白受体活性,增加对低密度脂蛋白的摄取,并刺激胆固醇运输来减少脂质积累,从而减轻肝脂肪变性以及NAFLD 的发生[26]。②增加脂肪酸氧化。花色苷可通过激活参与PPARα、PPARδ、UCP-2、UCP-3 和线粒体转录因子A 等相关代谢途径的基因增加线粒体脂肪酸β-氧化[27]。花色苷能明显降低高脂小鼠血清中转氨酶活力,提高HDL-C 浓度,升高PPARα水平,从而提高肝细胞氧化水平,调节肝脏脂质代谢,改善高脂饮食诱导的小鼠非酒精性脂肪肝损伤[28]。③维持线粒体功能。花色苷可以通过改善抗氧化状态和抑制线粒体凋亡途径保护肝细胞免受高糖诱导的氧化损伤,以及通过防止高血糖诱导的线粒体去极化来帮助线粒体维持其功能[29]。
5 动脉粥样硬化性心血管疾病
法国的一项由84 158 名参与者组成的队列研究中,在平均4.9 年的随访中,诊断出602 起心血管事件,多变量Cox 比例风险模型分析得出花色苷的摄入量与心血管疾病发病率呈负相关,每天摄入10 mg花色苷的参与者发生心血管疾病的风险比是0.98(95%CI:0.96~0.99,P=0.03),并且摄入花色苷最高三分位数与最低三分位数的参与者相比,发生主要心血管事件的风险比是0.66(0.52~0.83,P<0.001),风险比降低了34%[30]。中国天津一项针对冠心病老年人的干预实验显示,在监测室内PM2.5日均浓度的情况下,服用蓝莓冻干粉冲剂(10 g/d,60 d)的干预组与饮用水的对照组相比,对照组的心率变异性(heart rate variability,HRV)与室内PM2.5平均浓度密切相关(P<0.05),而在干预组中两者却无关,并且与对照组相比,干预组的血清肌酸激酶同工酶(creatine kinase-MB,CK-MB)活性,超敏C-反应蛋白(ultrasensitive C-reactive protein,us-CRP)含量,丙二醛(malondialdehyde,MDA)含量显著下降,IL-10含量和超氧化物歧化酶(superoxide dismutase,SOD)活性增高,这说明蓝莓冻干粉干预可拮抗PM2.5 暴露诱导的冠心病老年人HRV 及心肌酶活性的升高[31]。
花色苷可通过以下机制来抑制动脉硬化性心血管疾病:①降低脂质含量。黑米的花色苷提取物通过降低血清TG、TC 和LDL-C 水平来改善脂质分布,抑制ApoE-/-小鼠动脉粥样硬化的恶性发展和炎症反应,增加斑块稳定性,这主要与抑制促炎因子和改善血脂有关[32]。②促进胆固醇流出。凌文华等[33]研究发现原儿茶酸是C3G 的肠道微生物群代谢物,可以降低巨噬细胞中miRNA-10b 的表达,使其不能发挥直接抑制三磷酸腺苷结合盒转运体(ATP-binding cassette transporter,ABC)A1和ABCG1的功能,从而加速巨噬细胞胆固醇流出,发挥抗动脉粥样硬化作用。③抑制血管内皮细胞凋亡。花色苷能够增加内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、硫氧还原蛋白,降低Caspase-3 和p53 来抑制血管内皮细胞凋亡,减少动脉粥样硬化的发生[34]。④具有血管扩张活性和抑制氧化应激。来自葡萄酒和葡萄提取物的花色苷等多酚类物质具有血管扩张活性,因为它们可以增加eNOS 的表达和磷酸化,以及随之产生的血管扩张剂一氧化氮(nitric oxide,NO),NO 的产生有助于维持内皮稳态,这对于预防内皮功能障碍至关重要。此外,花色苷能够抑制可引起氧化应激的活性氧,并抑制内皮内炎症标志物的上调[35]。
6 代谢相关的癌症
美国一项由469 008 名参与者组成的前瞻性队列研究显示,在平均12年的随访中,2 453例参与者的头颈部发生癌症,使用Cox 比例风险回归模型研究类黄酮摄入量与癌症结果之间关联的HR,发现花色苷与头颈癌风险降低28%相关(HR:0.72,95%CI:0.62~0.82),表明膳食中的花色苷对头颈部有保护作用,减少了癌症的发生风险[36]。同样地,中国的一项病例对照研究显示,饮食中摄取更多的花色苷与结直肠癌风险呈负相关,OR值为0.79(95%CI:0.63~0.98)[37]。花色苷抑制代谢相关癌症的作用机制如图4所示。
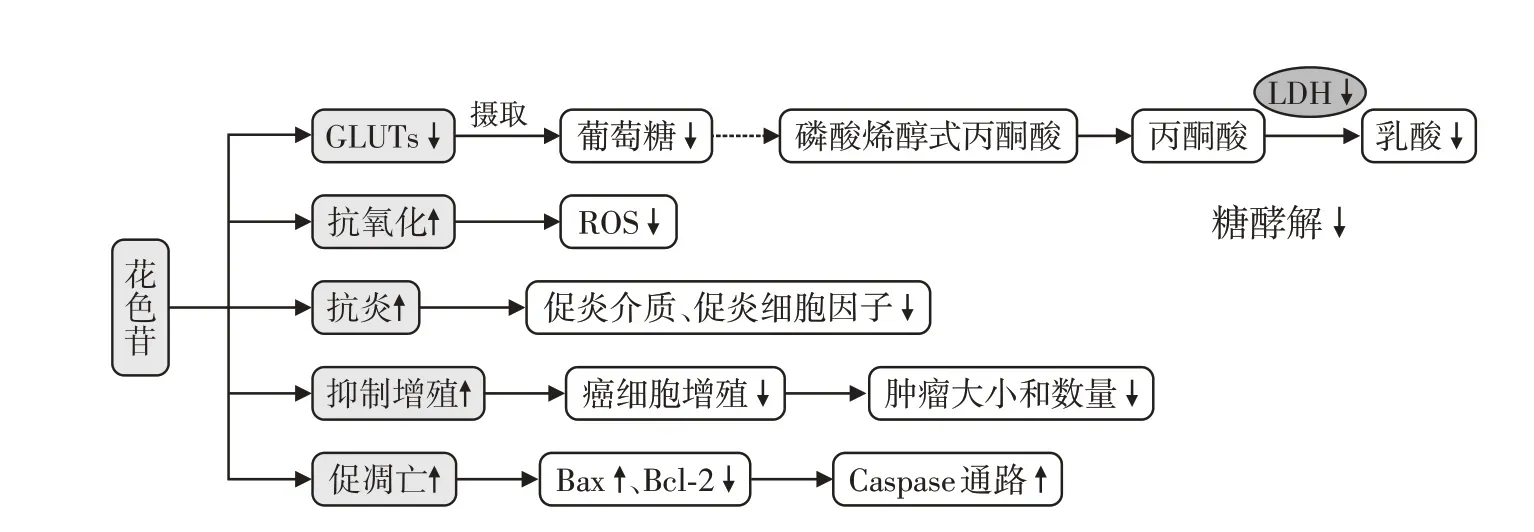
图4 花色苷抑制代谢相关的癌症的作用机制Figure 4 Mechanism of anthocyanins in inhibiting metabolism⁃related cancers
6.1 花色苷抑制糖酵解
肿瘤细胞利用糖酵解来实现快速增殖、生长和转移。花色苷可通过减少糖酵解使得快速增殖的癌细胞不能获取相应的能量,抑制肿瘤生长。细胞癌变以后,细胞处于缺氧状态下,会诱导缺氧诱导因子(hypoxia-inducible factors,HIF)。作为一种转录因子,HIF 促进很多与糖酵解有关的酶基因表达。因此,在细胞癌变以后,糖酵解的总活性会上升。Silva 等[38]研究显示,樱桃花色苷提取物可以抑制LNCaP 和PC3前列腺肿瘤细胞的糖酵解代谢,使得葡萄糖消耗和乳酸产生减少,GLUT3 和单羧酸转运蛋白4(monocarboxylate transporter 4,MCT4)的表达水平降低,乳酸脱氢酶(lactate dehydrogenase,LDH)活性降低。牵牛花色素-3-O-葡萄糖苷可以抑制胶质母细胞瘤的细胞增殖,抑制参与糖酵解代谢的c-Myc、PDK、PKM2 基因的表达和胶质母细胞瘤细胞存活相关的蛋白表达水平来发挥抗癌作用[39]。
6.2 花色苷抗氧化和抗炎
花色苷可发挥抗氧化和抗炎作用。花色苷可通过降低人神经母细胞瘤SH-SY5Y 细胞内活性氧自由基(reactive oxygen species,ROS)水平和增加还原型谷胱甘肽水平,有效防止H2O2诱导的氧化应激,减少神经变性[40]。花色苷还可以通过抗炎作用来抑制肿瘤的发生发展。有报道花色苷可以抑制NO 和前列腺素E2 等促炎介质,以及降低肿瘤坏死因子-α和IL-1β等促炎细胞因子,减少NO 合酶、环氧合酶-2(cyclooxygenase-2,COX-2)的过度表达,抑制核因子κB(nuclear factor kappa-B,NF-κB)的核转位来发挥抗炎作用,从而减少癌症的发生[41]。
6.3 花色苷抗增殖和促进凋亡
花色苷还可以通过抑制多种癌细胞的增殖以及激活凋亡过程发挥抗癌作用。在结肠癌小鼠模型中,使用富含越橘花色苷提取物10 周后,可显著抑制结肠癌细胞的生长,并且结肠癌细胞的增殖减少了近50%,COX-2 mRNA的表达减少,同时结肠异常隐窝灶的数量减少[42]。另外,花色苷可以激活Caspase 通路,引起核膜降解、染色质凝聚、DNA 片段化,以及凋亡小体的形成,并可以通过上调促凋亡蛋白Bax,下调抗凋亡蛋白Bcl-2等途径诱导胃肠道癌细胞的凋亡[43]。
7 小结与展望
花色苷作为植物中的水溶性色素,人们可以通过饮食将其摄入体内,促进自身健康。大量研究表明花色苷抵抗代谢性疾病的作用及机制多种多样,具有很高的研究价值,有希望成为临床上代谢性疾病治疗的新靶点。然而,值得关注的是,目前一些流行病学研究所选取的研究对象,由于饮食、生活习惯、环境等方面存在差异,研究结论不一定能推广到更多人群,仍需要更多的流行病研究来验证花色苷摄入量升高与代谢性疾病发生率降低的关联是否具有普遍性。而且关于花色苷在高脂血症、非酒精性脂肪肝和动脉硬化性心血管疾病中的机制探讨并不深入,需要更多的基础研究来深入探讨。并且,有关花色苷的干预研究较少,对代谢性疾病的有效性还需要更多的临床证据。

