广东近岸海域贝类寄生派琴虫流行病学调查研究
杨小彤,叶灵通,卢 洁,姚 托,王江勇,付耀武,张其中
1.天津农学院 水产学院,天津 300462
2.中国水产科学研究院南海水产研究所/农业农村部水产品加工重点实验室/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300
3.惠州学院,广东 惠州 516007
4.暨南大学/水生生物研究中心/热带亚热带水生态工程教育部工程研究中心,广东 广州 510632
广东沿海地区海岸线广阔、岛屿众多,海岸线长达3 465.40 km,是渔业养殖大省。广东省贝类养殖业发达,2019年海水养殖面积达1.65×105hm2,约占全国的8%,居全国第四[1];2019年贝类养殖产量为199.24万吨,约占全省海水养殖产量的58%[1]。但是,近年以来随着养殖历史的延长、养殖环境的恶化,贝类病害频发,严重影响贝类养殖业的健康发展[2-4]。2019年,贝类病害经济损失为95.10亿元,约占全国水产养殖病害损失的23.31%[5]。
派琴虫 (Perkinsusspp.) 隶属于顶复门、派琴虫纲、派琴虫目、派琴虫科、派琴虫属,是贝类中一类强致病性原生动物病原,可引发贝壳闭合障碍、生长缓慢、性腺发育减缓以及配子减少等病症,高强度感染时甚至会引起贝类大规模死亡,是严重威胁贝类养殖的寄生虫之一[6]。鉴于派琴虫的严重危害性,其中一部分派琴虫被世界动物卫生组织 (Office International des Epizooties, OIE) 列入软体动物疫病名录,一旦发现感染需要向OIE通报。在中国,派琴虫病也被列入《中华人民共和国进境动物检疫疫病名录》中二类传染病下的寄生虫病中的水生动物疫病之一。世界各地有诸多派琴虫病害导致贝类大量死亡的报道。如奥尔森派琴虫 (P.olseni)在日本及韩国人工养殖和野生的菲律宾蛤仔体内广泛传播,导致了大规模死亡[7]。海水派琴虫 (P.marinus) 曾造成墨西哥海岸的牡蛎大量死亡,死亡率高达50%[8]。美国切萨皮克海湾的牡蛎由于感染了派琴虫,导致产量大幅下降[9]。自1997年以来,中国相继报道了派琴虫感染栉孔扇贝 (Azumapecten farreri)、虾夷扇贝 (Mizuhopecten yessoensis)、皱纹盘鲍 (Haliotis discus hannai) 和菲律宾蛤仔 (Ruditapes philippinarum) 等贝类的病例[10]。尤其在2000年,中国沿海黄河北岸滩涂养殖的菲律宾蛤仔发生了奥尔森派琴虫感染导致大规模死亡事件,造成严重的经济损失[11]。
贝类一般在开放式的浅海或滩涂上养殖,一旦发生病害,传统的封闭式养殖常用的药物浸泡治疗方式难以奏效[12]。因此,贝类病害防治主要采用以防为主、治疗为辅的方针[13]。摸清贝类派琴虫感染“家底”,调查派琴虫的流行感染规律对贝类派琴虫病的发生、发展和防治显得尤为重要。但是,相对于贝类养殖产量和规模较大的广东沿海,派琴虫的流行病学调查相关研究相对单薄,而其重要致病性近年来对广东贝类养殖的影响却不容忽视[14]。Cui等[15]曾对广东湛江的尖紫蛤 (Soletellina acuta) 进行了派琴虫流行病学调查,发现2种派琴虫在同一月份同时感染现象,2种派琴虫呈现出不同的感染趋势。而对于广东沿海大多数主养贝类品种,如香港牡蛎、海湾扇贝 (Argopecten irradias)、杂色鲍等,其派琴虫的流行规律并不清楚,不同的贝类种类具有不同的养殖方式和养殖环境,这也将不可避免地影响派琴虫的传播机制[16]。因此,弄清不同贝类的派琴虫流行感染规律,对为不同贝类制定独特的防治措施至关重要,势在必行。本研究主要通过调查广东沿海的主要经济贝类,弄清不同贝类派琴虫感染的时空变化规律,掌握派琴虫病的发生和流行规律,以期为该区域的贝类养殖业提供重要参考。
1 材料与方法
1.1 样品收集
2020年4月—2021年2月进行周年样品采集,在贝类疾病潜在高发期 (4—8月) 每月采集1次,疾病低发期 (10—2月) 每2个月采集1次,共8次。采集时间划分为夏秋季 (6—8月、10月)和冬春季 (12月、2月、4—5月)。采集地点分别为广东粤西沿海3个主要养殖区 (湛江市、阳江市、江门市) 和粤东沿海3个主要养殖区 (汕尾市、揭阳市、汕头市,图1)。采集的贝类种类包括香港牡蛎 (Crassostrea hongkongensis)、华贵栉孔扇贝 (Chlamys nobilis)、马氏珠母贝 (Pinctada martensii)、杂色鲍 (H.diversicolor)、福建牡蛎(C.angulate)。在每个采集地点每一种贝类随机挑选30只 (表1),将每个贝类样品的鳃取出,固定于无水乙醇中,用于后续分子鉴定;流行病学调查期间采集海域水体的盐度和温度变化情况见图2。
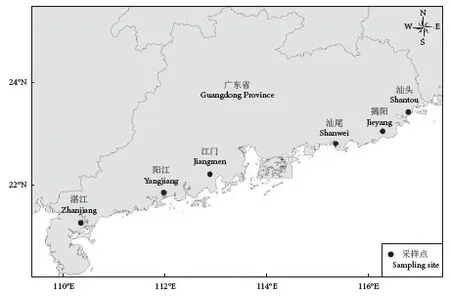
图1 广东省采样点分布图Fig.1 Sampling sites along coastal area of Guangdong Province

图2 广东近岸海域贝类寄生派琴虫流行病学调查期间采集海域水体的盐度和温度变化Fig.2 Variation of water salinity and temperature in sampling locations during epidemiology investigation of Perkinsus spp.in shellfish along coastal area of Guangdong Province
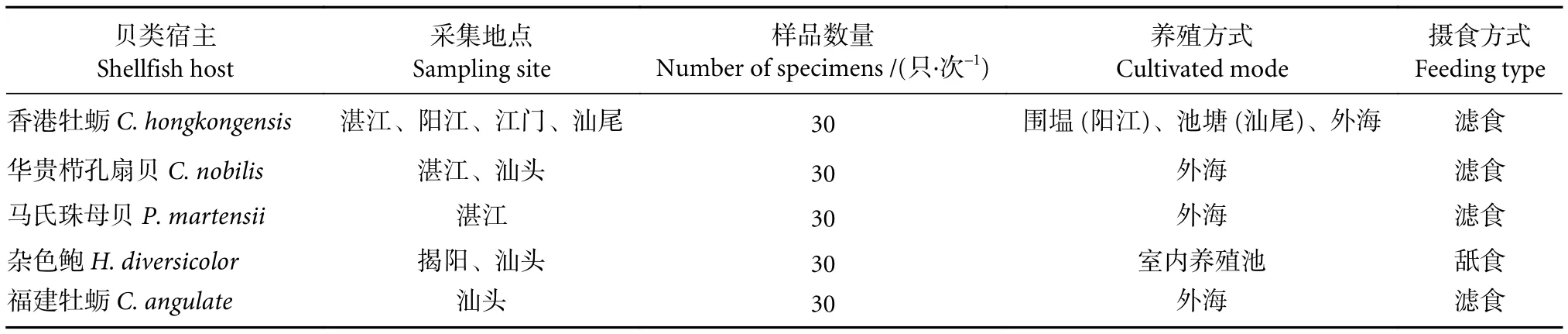
表1 广东近岸海域贝类寄生派琴虫流行病学调查采样信息Table 1 Sampling information for epidemiology investigation of Perkinsus spp.in shellfish along coastal area of Guangdong Province
1.2 样品鉴定
1.2.1 总 DNA 的提取、扩增与测序
切取30~50 mg鳃部样品放置于2 mL离心管内,放入通风橱加速乙醇风干。参照软体动物组织DNA抽提试剂盒 (美基生物,广州) 的使用说明进行样品DNA提取,使用派琴虫属通用引物对PerkITS-85 (5'-CCGCTTTGTTTGGMTCCC-3') 和PerkITS-750 (5'-ACATCAGGCCTTCTAATGATG-3')扩增派琴虫的核糖体RNA基因转录间隔区1 (ITS-1) 序列[15],目的序列长度为703 bp。PCR扩增体系为 25 μL,包括 2 μL 模板 DNA、12.5 μL PCR Mix (东盛,广州)、上下游引物各 1 μL (10 μmol·L–1)、灭菌双蒸水8.5 μL。扩增反应程序为94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。每次检测实验均同时设置阳性对照 (模板为北海派琴虫质粒)和阴性对照 (模板为无菌蒸馏水)。扩增产物在1%的琼脂糖凝胶中电泳检测,将单一条带的PCR样品进行测序。
1.2.2 派琴虫物种鉴定
检查测序得到的序列图,根据测序峰图手动校准序列,确保其准确性。在GenBank数据库中搜索待鉴定物种的序列以进行相似性比较。当目标序列与数据库中已确定物种序列的相似度为99.5%~100%时,认为待鉴定物种与数据库中的匹配物种相同[15]。
1.3 感染率统计与分析
贝类派琴虫感染率的定义参考Bush等[17]和李文祥[18],指感染派琴虫的贝类数量占该检测贝类样品总量的比例。贝类派琴虫总感染率是指该检测贝类样品中所有感染派琴虫种类的贝类数量占该检测贝类样品总量的比例。实验数据采用R软件包进行统计分析,不同时间、地点、贝类宿主间派琴虫感染率的显著性差异用卡方检验,显著性水平设置为0.05。利用R语言ggplot2 软件包进行图片绘制。
2 结果
2.1 派琴虫及其贝类宿主多样性
在广东沿海中共检测到2种派琴虫,分别为北海派琴虫和奥尔森派琴虫,其中北海派琴虫为优势感染种类,总感染率为9.0% (N=2 400),显著高于奥尔森派琴虫 (2.1%,N=2 400) (χ2=106.67,df=1,P<0.05)。在5种检测的贝类宿主中除福建牡蛎外,均检测到派琴虫感染,其中香港牡蛎的总感染率为23.64% (N=960),显著高于其他种类;在感染的贝类宿主中,香港牡蛎、杂色鲍感染2种派琴虫,而马氏珍珠贝、华贵栉孔扇贝仅感染一种派琴虫,即奥尔森派琴虫;在香港牡蛎感染中,北海派琴虫感染率为22.29% (N=960),为优势感染种,显著高于奥尔森派琴虫 (1.35%,N=960) (χ2=199.84,df=1,P<0.05)。杂色鲍中的2种派琴虫的感染率均较低,北海派琴虫和奥尔森派琴虫感染率分别为0.42% (N=480) 和 3.13% (N=480) (图3、图4-a)。

图3 广东沿海不同时间、贝类宿主、地点感染派琴虫的分布情况Fig.3 Distribution of Perkinsus spp.at different time, in different shellfish host and different location along coastal area of Guangdong Province
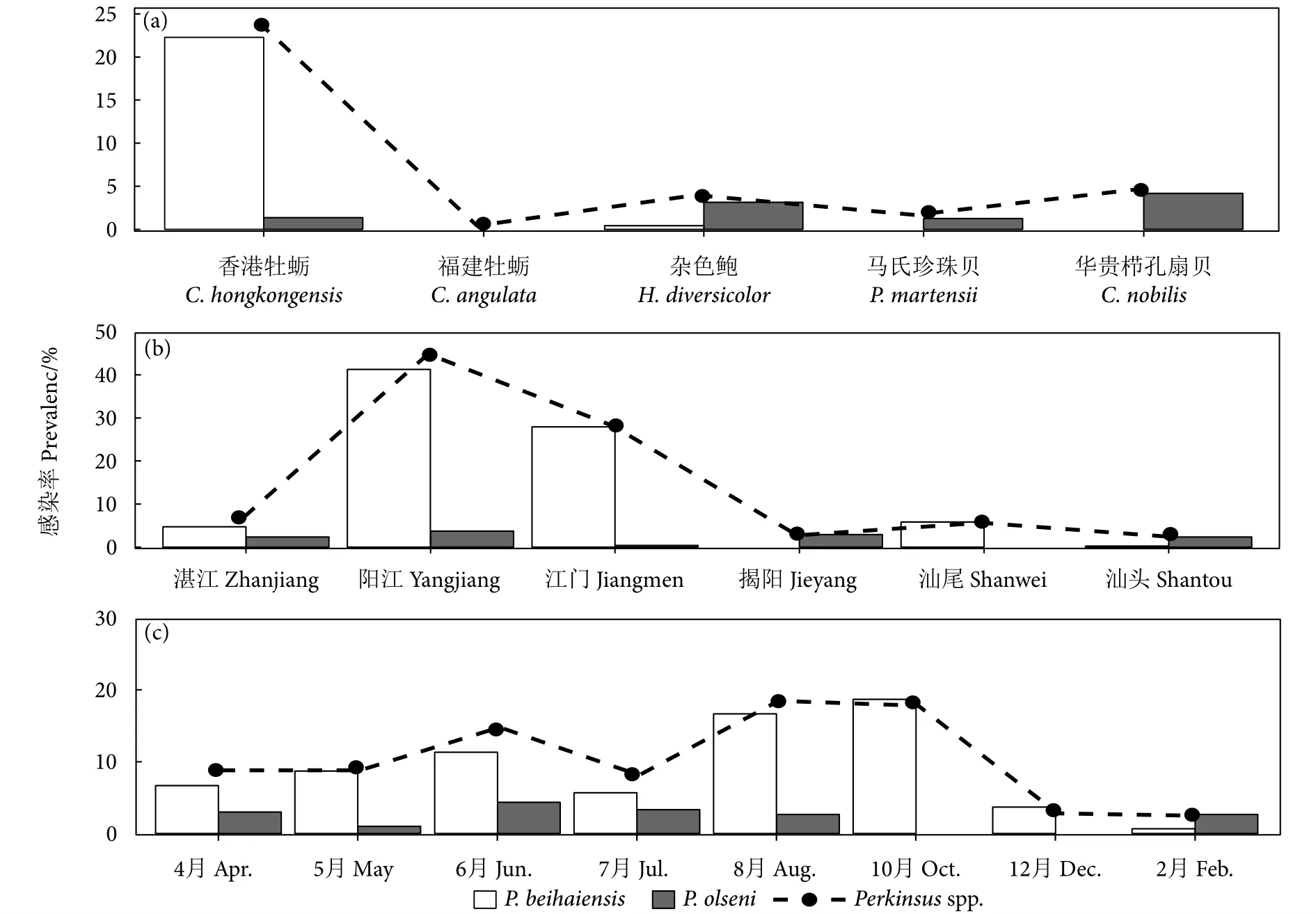
图4 广东沿海不同贝类宿主 (a)、不同地点 (b)、不同时间 (c) 派琴虫的总感染率变化情况Fig.4 Prevalence of Perkinsus spp.in different shellfish host (a), different location (b) and different month (c) along coastal area of Guangdong Province
2.2 派琴虫感染空间多样性
所有监测地点均发现派琴虫感染,总感染率由高至低分别为阳江 (45%,N=240)、江门 (28.34%,N=240)、湛江 (7.08%,N=720)、汕尾 (5.83%,N=240)、揭阳 (2.92%,N=240)、汕头 (2.64%,N=720) (图3、图4-b);其中阳江和江门为主要感染地区,显著高于其他4个区域;湛江和阳江感染了2种派琴虫,其中阳江地区北海派琴虫的感染率为41.25% (N=240),显著高于奥尔森派琴虫 (χ2=94.64,df=1,P<0.05, 图4-b);汕尾仅感染了北海派琴虫,而揭阳仅发现奥尔森派琴虫感染。粤西地区的派琴虫总感染率为17.17% (N=1 200),显著高于粤东地区 (3.33%,N=1 200) (χ2=123.31,df=1,P<0.05)。
2.3 派琴虫感染时间多样性
在所有调查月份中均发现派琴虫感染,其中8和10月的感染率最高,显著高于其他月份,12和2月感染率最低,显著低于其他月份 (图4-c);除10、12月仅感染1种派琴虫外 (P.beihaiensis),其他月份均感染2种派琴虫 (P.beihaiensis和P.olseni);从季节上看,夏秋季的感染率较高,为15.67% (N=1 200),显著高于冬春季 (4.83%,N=1 200) (χ2=75.37,df=1,P<0.05)。
3 讨论
大多数派琴虫具有广泛寄生特性,寄生特异性低,能够在不同贝类寄主中广泛传播,因此具有全球广泛分布的特点[19-21]。如被OIE 列入软体动物疫病名录的奥尔森派琴虫,广泛分布于亚洲、美洲、欧洲、澳洲等世界各主要贝类养殖海区的17个国家,寄生于隶属5个目、6个科的多达26种贝类寄主中[22]。本研究中除福建牡蛎未发现感染外,其他4种贝类均感染了至少1种派琴虫,说明派琴虫与广西沿海贝类感染派琴虫的广泛性相似[23],在广东沿海主要养殖区的贝类品种已经普遍携带派琴虫病原。
中国华南沿海贝类在较长时间里仅检测到北海派琴虫感染[24],但近年来该海域派琴虫的感染种类呈现多样化,研究表明已有3种派琴虫在华南沿海被检测到[16],其中奥尔森派琴虫和切萨皮克派琴虫 (P.chesapeaki) 均为强致病性贝类病原,曾造成世界各地贝类大规模死亡[25-26]。本研究亦监测到北海派琴虫和奥尔森派琴虫这2种派琴虫的感染,尤其在一些重要养殖种类如香港牡蛎中,其感染率偏高,说明这2种派琴虫已经在广东沿海环境中较稳定地共存。2018—2019年冬春季期间,广东江门、惠州、揭阳一带发生香港牡蛎大规模死亡,检测发现派琴虫感染率高,虽无直接证据证明死亡是派琴虫直接导致,但是从派琴虫的巨大危害性看,香港牡蛎的生存状态必然受到一定影响。
派琴虫感染与贝类的摄食方式、养殖区域、养殖方式具有很强的相关性[27]。本研究中杂色鲍的派琴虫感染率非常低,与其工厂化养殖、接触外海环境少、舐食性饲料避免派琴虫污染等因素密切相关。而香港牡蛎主要在河口区养殖,受人类活动影响强烈,且南方降雨量大,淡水大量的注入经常引起盐度和温度的大幅波动,这些变化是导致派琴虫活力、感染力增强的核心要素,是派琴虫感染率高的主要原因[27-28]。香港牡蛎的养殖方式也对派琴虫感染具有一定程度的影响,如阳江采样点采用的是围塭养殖,水体交换主要通过潮水涨落、控制水闸来完成,其派琴虫感染率与围塭外水域的派琴虫含量密切相关。本研究中阳江地区的感染率最高,可能由围塭外水域的派琴虫浓度较高引起。而揭阳地区香港牡蛎主要以池塘养殖为主,属于更小水体养殖,各池塘间通过共同的水沟进行水体交换,其可控性比围塭养殖更强,从检测结果也发现派琴虫的感染率低得多。
派琴虫感染种类多样性呈现较强的区域性和贝类寄主特异性。本研究发现广东沿海贝类感染优势种为北海派琴虫,而奥尔森派琴虫感染率较低。但广东湛江吴川水域的尖紫蛤却与本研究结果相反,即奥尔森派琴虫的感染率显著高于北海派琴虫[15]。广西沿海贝类感染派琴虫的情况更复杂,不同的贝类种类呈现出不同的派琴虫多样性感染规律,如香港牡蛎中北海派琴虫的感染率显著高于奥尔森派琴虫,而菲律宾蛤仔中奥尔森派琴虫的感染率显著高于北海派琴虫[23]。造成派琴虫感染规律迥异的首要原因可能是派琴虫对不同海区条件的适应性,导致海水中派琴虫丰度的差异,从而引起感染率差异。其次是派琴虫对贝类寄主的偏好性,贝类寄主的滤食方式[29]和养殖方式[26]的差异也可影响派琴虫感染成功率。贝类不同生长阶段频繁的变换海区也是导致派琴虫传染、生物多样性复杂化的重要原因之一。如幼贝期香港牡蛎一般在环境条件优越、污染少的海区养殖,如广西钦州、广东珠海三灶、广东揭阳等地;但是,随着贝类摄食量的增加,待到中蚝期,贝民们普遍做法是将其运往藻类食物丰度高的海区进行育肥,如广东阳江、江门、惠州、广西北海等地。这种养殖海区更换的副作用就是促进了派琴虫在各个海区之间传播,从而大大增加了派琴虫感染的广度和复杂性。
不同海域中,贝类派琴虫的季节动态呈现不同趋势。广西沿海香港牡蛎派琴虫维持较高感染率,各个季节香港牡蛎感染率均在23.75%以上,夏秋季感染率 (44.8%) 略高于冬春季 (37.7%),但无显著差异[23]。对广东湛江地区尖紫蛤季节动态研究发现,冬春季的派琴虫感染率显著高于夏秋季[15]。而本研究发现,贝类在夏秋季的派琴虫感染率显著高于冬春季。导致这种差异的最可能原因是调查海域和贝类寄主的差异。广西沿海地处北部湾海域,属于半封闭海湾,其水文地理环境可能较适合派琴虫生长和发育。广西沿海和广东湛江地区调查的寄主分别为香港牡蛎和尖紫蛤,都具体到单个品种的季节动态监测,其派琴虫的季节动态势必会受到寄主的养殖环境、养殖方式、摄食方式、栖居方式、养殖密度等因素的综合影响,因此其季节动态会具有较强的独特性。如尖紫蛤是一种独特的生活于河口区的掘洞栖息型贝类,主要分布于湛江吴川河口地区,能适应低至零度的海水[30],与香港牡蛎的生活环境差异巨大,因此也导致派琴虫感染趋势的差异。本研究将季节动态调查的种类扩大到5种主要养殖贝类,并且增加了采样时间频次 (每年采样8次),因此派琴虫的季节动态结果更贴近现实、更具代表性。鉴于两广地区贝类养殖的高互通性以及广西地区派琴虫感染的普遍性,广东地区的派琴虫病原极有可能通过接纳来自广西的香港牡蛎中蚝育肥而扩大了感染率和感染丰度,因此很有必要在贝类异地运输前进行派琴虫病的检验检疫工作,从而切断派琴虫在贝类的传染途径。

