大菱鲆弧菌耐药谱、耐药基因检测和ERIC-PCR分型分析
沈 飞,翟玉菲,王 浩,2,吕利群,2
1.上海海洋大学/国家水生动物病原库,上海 201306
2.农业农村部淡水种质资源重点实验室,上海 201306
大菱鲆 (Scophthalmus maximus) 俗称为“多宝鱼”,1992年引入中国,7年后实现国内繁育,迅速掀起工厂化养殖的热潮[1]。相关数据显示,鲆鱼产量仅次于鲈鱼 (Lateolabrax japonicus),居全国海水养殖鱼类产量第二位,较2019年提高了7.54%。大菱鲆养殖产区自北向南主要分布在辽宁、天津、河北、山东和江苏,其中辽宁地区产量最大,2019年产量占总产量的67.13%[2]。以工厂化流水养殖为主的养殖模式导致大菱鲆病害频发,随着水产养殖绿色发展的推进,流水养殖将逐渐被取代。细菌性疾病是大菱鲆养殖过程中最常见的病害,致病原主要有迟缓爱德华氏菌 (Edwardsiella tarda)[3]、大菱鲆弧菌 (Vibrio scophthalmi)[4]、溶藻弧菌 (V.alginolyticus)[5]、鳗弧菌 (V.anguillarum)[6]和假交替单胞菌 (Pseudoalteromonas)[7]等。这些致病菌容易引起大菱鲆腹水病,其症状为腹部膨胀,严重时胃部和鳍部出血,腹部凹陷,死亡率高达80%[8]。其中,大菱鲆弧菌是一种条件致病菌[9];当宿主受到环境胁迫或者其他致病菌攻击时,体内的大菱鲆弧菌更容易引起继发性感染并加剧宿主死亡。感染大菱鲆弧菌宿主症状同腹水病一样,腹部积水,肝脾出血和肠道出血[5]。2016年4—10月,葫芦岛地区患病大菱鲆分离株中大菱鲆弧菌检出率最高,占总弧菌的47.27%[10]。2018年7—10月,王鹤等[11]从山东大菱鲆养殖地区分离到了28株病原菌,其中有9株大菱鲆弧菌,说明大菱鲆弧菌在患病大菱鲆中检出率很高。
高灵敏度和特异性的分子分型技术是对病原体进行流行病学调查的有效手段,可用于表征分离株的遗传相似性。ERIC-PCR (Enterobacterial repetitive intergenic consensus-PCR) 分型法基于肠杆菌基因间重复共有序列,是一种快速、高效、高通量、低成本的分子分型技术[12]。该方法通过扩增重复共有序列,可以得到多条带电泳图,根据电泳图的差异将同种细菌分为不同基因型。ERIC-PCR被应用于多种水产病原菌的流行病学调查与溯源,如嗜水气单胞菌 (Aeromonas hydrophila)[13],迟缓爱德华氏菌[3],副溶血弧菌 (V.parahaemolyticus)[14]和维氏气单胞菌 (A.veronii)[15]等,而关于大菱鲆弧菌分子分型的相关研究较少。细菌对抗菌药物的敏感程度直接影响药物的治疗效果,但细菌耐药性复杂且受季节、养殖环境和宿主等条件影响。耐药细菌的出现导致水产养殖细菌性疾病越来越难以防控,甚至陷入多重耐药的恶性循环。对细菌病原的精准分型是诊断细菌感染并及时采取控制措施的关键。ERIC-PCR作为一种简便、辨识度强且重复性高的分子生物学分型手段,其与细菌耐药性的相关性值得探讨。
辽宁省水产技术推广总站于2020年6—10月从患病濒死大菱鲆体内采集到394株菌株,送至上海海洋大学国家水生动物病原库鉴定,其中大菱鲆弧菌检出率最高。本研究采用微量稀释法测定大菱鲆弧菌对农业农村部许可使用的8种抗菌药物的耐药性,检测其耐药基因携带情况,基于ERICPCR对其分型研究,分析耐药谱、耐药基因谱和ERIC-PCR谱三者之间的相关性,旨在掌握大菱鲆弧菌的遗传学特征和流行特征,并指导科学用药。
1 材料与方法
1.1 菌株来源
394株分离株由辽宁省水产技术推广总站每月定点从患病大菱鲆中分离并保存,送至上海海洋大学国家水生动物病原库鉴定。用于分析的18株大菱鲆弧菌分别命名为Vs1—Vs18。药敏质控菌株为大肠杆菌ATCC25922。
1.2 主要试剂
TCBS (硫代硫酸盐柠檬酸盐胆盐蔗糖)、MH(水解酪蛋白) 培养基购于索莱宝公司;Lysis Buffer for Microorganism to Direct PCR裂解液、PremixTaq™酶购于宝日医生物技术有限公司;细菌基因组DNA提取试剂盒 (DP302) 购自天根生化科技(北京) 有限公司;核酸染料购于上海天能科技有限公司;引物合成由生工生物工程 (上海) 股份有限公司完成;恩诺沙星 (Enrofloxacin, ENR)、硫酸新霉素 (Neomycin, NEO)、甲砜霉素 (Thiamphenicol,TAP)、氟苯尼考 (Florfenicol, FFC)、盐酸多西环素(Doxycycline, DO)、氟甲喹 (Flumequine, FLU)、磺胺间甲氧嘧啶钠 (Sulfamonomethoxine, SMM) 和磺胺甲恶唑甲氧苄啶复合物 (Sulfamethoxazole+Trimethoprim, SMZ+TMP) 均购于源叶生物公司。
1.3 分离株16S rRNA鉴定
挑取单菌落或用移液器移取细菌悬液加至细菌裂解液中,80 ℃金属浴15 min,取2 μL作为DNA扩增模板。扩增体系为:PremixTaq™酶25 μL,上下游引物各 1 μL,模板 2 μL,灭菌双蒸水 21 μL。以16S rRNA通用引物27F和1492R (表1) 进行PCR扩增,扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min[8]。产物测序由生工生物工程 (上海) 股份有限公司完成,在NCBI进行Blast比对分析。
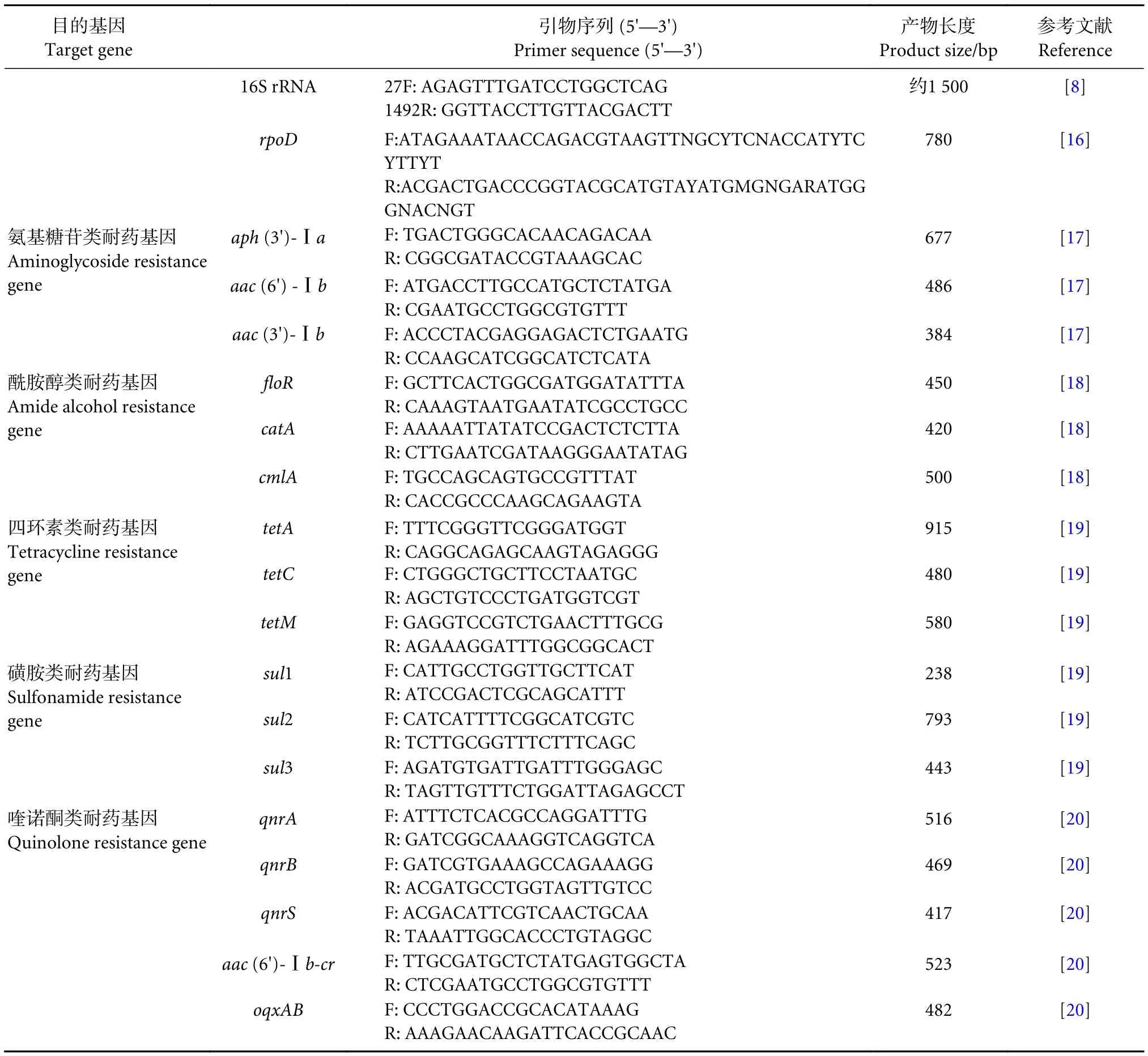
表1 PCR引物Table 1 Primers used for PCR
1.4 RNA聚合酶σ70因子rpoD扩增、测序及进化树构建
根据天根细菌DNA提取试剂盒使用说明提取大菱鲆弧菌的DNA,用于后续PCR扩增与检测。PCR扩增18株大菱鲆弧菌的rpoD基因进行种水平的鉴定。rpoD基因引物参考Tarazona等[16]设计,序列见表1。PCR条件及序列比对与16S rRNA一致。
利用MEGA 7.0软件构建产物序列与其他弧菌rpoD基因的系统进化树,建树方法为Neighborjoining法,1 000次Bootstrap检验置信度。
1.5 最小抑菌浓度测定和药物敏感性分析
基于CLSI微量肉汤稀释法[21]检测大菱鲆弧菌药物敏感性。主要有8种抗菌药物,分别为恩诺沙星、硫酸新霉素、甲砜霉素、氟苯尼考、盐酸多西环素、氟甲喹、磺胺间甲氧嘧啶钠和磺胺甲恶唑甲氧苄啶复合物。判别标准:与阳性对照孔比较,孔底浑浊,为阳性;孔底澄明,为阴性。以在微孔内完全抑制细菌生长的最低药物浓度为最低抑菌浓度(Minimum inhibitory concentration, MIC)。
不同抗生素敏感性不同,判别标准参考CLSI[21]标准文件和魏文娟等[20]:恩诺沙星 [(敏感 (S):MIC≤0.5 μg·mL−1,中敏 (I):MIC=1~2 μg·mL−1,耐药 (R):MIC≥4 μg·mL−1)];硫酸新霉素、甲砜霉素和氟苯尼考 (S: MIC≤2 μg·mL−1, I: MIC=4 μg·mL−1, R: MIC≥8 μg·mL−1);盐酸多西环素 (S:MIC≤4 μg·mL−1, I: MIC=8 μg·mL−1, R: MIC≥16 μg·mL−1);氟甲喹 (S: MIC≤8 μg·mL−1, I: MIC=16 μg·mL−1, R: MIC≥32 μg·mL−1);磺胺间甲氧嘧啶钠(S: MIC≤256 μg·mL−1, R: MIC≥512 μg·mL−1);磺胺甲恶唑/甲氧苄啶 (S: MIC≤38/2 μg·mL−1, R: MIC≥76/4 μg·mL−1)。
1.6 耐药基因检测
采用PCR法鉴定17种耐药基因,耐药基因名称及引物见表1。PCR产物通过1.5%琼脂糖胶电泳检测。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30~60 s (根据靶基因序列长度确定延伸时间),30个循环;72 ℃ 延伸 10 min。
1.7 ERIC-PCR条带聚类分析
参照张海强等[14]方法对大菱鲆弧菌进行ERICPCR扩增,扩增引物为F: ATGTAAGCTCCTGGGG ATTCAC,R: AAGTAAGTGACTGGGGTGAGCG。PCR反应程序为94 ℃预变性5 min;94 ℃变性45 s,52 ℃ 退火 1 min;72 ℃ 延伸 5 min,35 个循环;72 ℃延伸10 min,4 ℃保存。1.5%凝胶电泳检测PCR产物,条件为120 V,5 min,使用天能全自动凝胶图形分析系统结合电泳图分析条带,有条带记作“1”,无条带记作“0”。使用NTsys_2.10e软件分析Jaccard系数和遗传距离矩阵确定菌株间的相似性,使用非加权组平均法 (Unweighted pair-group method with arithmetic means, UPGMA)对ERIC产物进行聚类分析。
2 结果
2.1 分离株16S rRNA测序鉴定结果
394株分离细菌的16S rRNA测序鉴定结果见表2。将16S rRNA序列与NCBI数据库进行Blast比对,初步确定弧菌属232株,假单胞菌属46株,假交替单胞菌属35株,分别占总分离株的58.88%、11.68%和8.88%。弧菌中,大菱鲆弧菌分离率最高,占总弧菌的50.43%,占总分离株的29.70%;其次为溶藻弧菌,占总分离株8.89%。结果表明大菱鲆弧菌是患病大菱鲆分离株中的优势株,应当引起重视。

表2 基于16S rRNA测序的394株分离株鉴定结果Table 2 Identification result of 394 strains based on 16S rRNA sequencing
2.2 大菱鲆弧菌rpoD序列分析
从117株大菱鲆弧菌中随机挑选18株进行rpoD基因测序和比对。PCR扩增rpoD基因得到780 bp的片段 (图1),选取大菱鲆弧菌和其他常见弧菌的rpoD序列构建系统发育进化树,结果显示该18株均与大菱鲆弧菌聚为一支,且能区分于其他弧菌 (图2)。
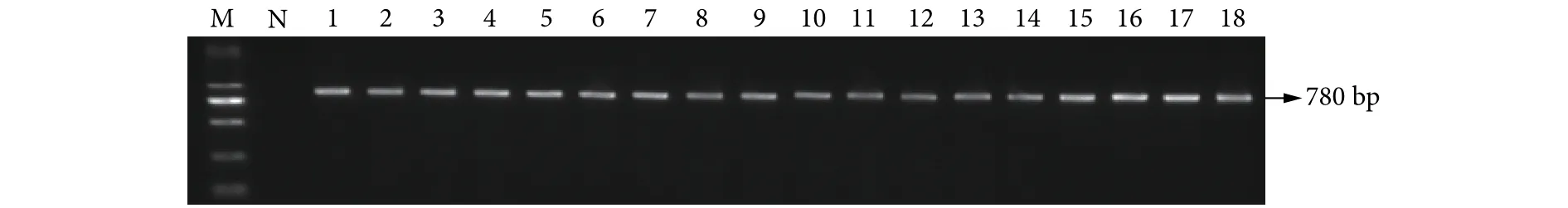
图1 18株大菱鲆弧菌rpoD基因PCR扩增结果Fig.1 PCR amplification product of rpoD in 18 strains of V.scophthalmi
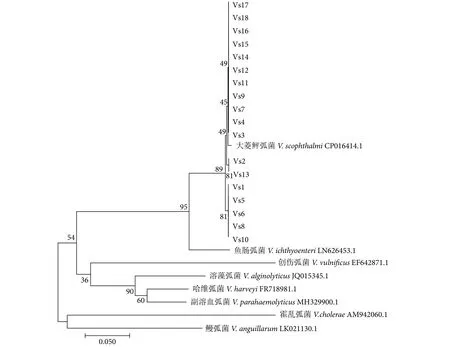
图2 基于弧菌rpoD序列相似性构建的系统发育进化树Fig.2 Phylogenetic tree constructed from rpoD sequence of Vibrio
2.3 大菱鲆弧菌药物敏感性分析
18株分离株耐药性结果 (表3) 表明,分离株对硫酸新霉素、盐酸多西环素和氟甲喹尚未产生耐药性,对恩诺沙星 (6/18)、甲砜霉素 (9/18)、氟苯尼考 (9/18)、磺胺间甲氧嘧啶钠 (6/18) 和磺胺甲恶唑+甲氧苄啶 (4/18) 有不同比例的耐药性。其中多重耐药率为66.67% (12/18)。
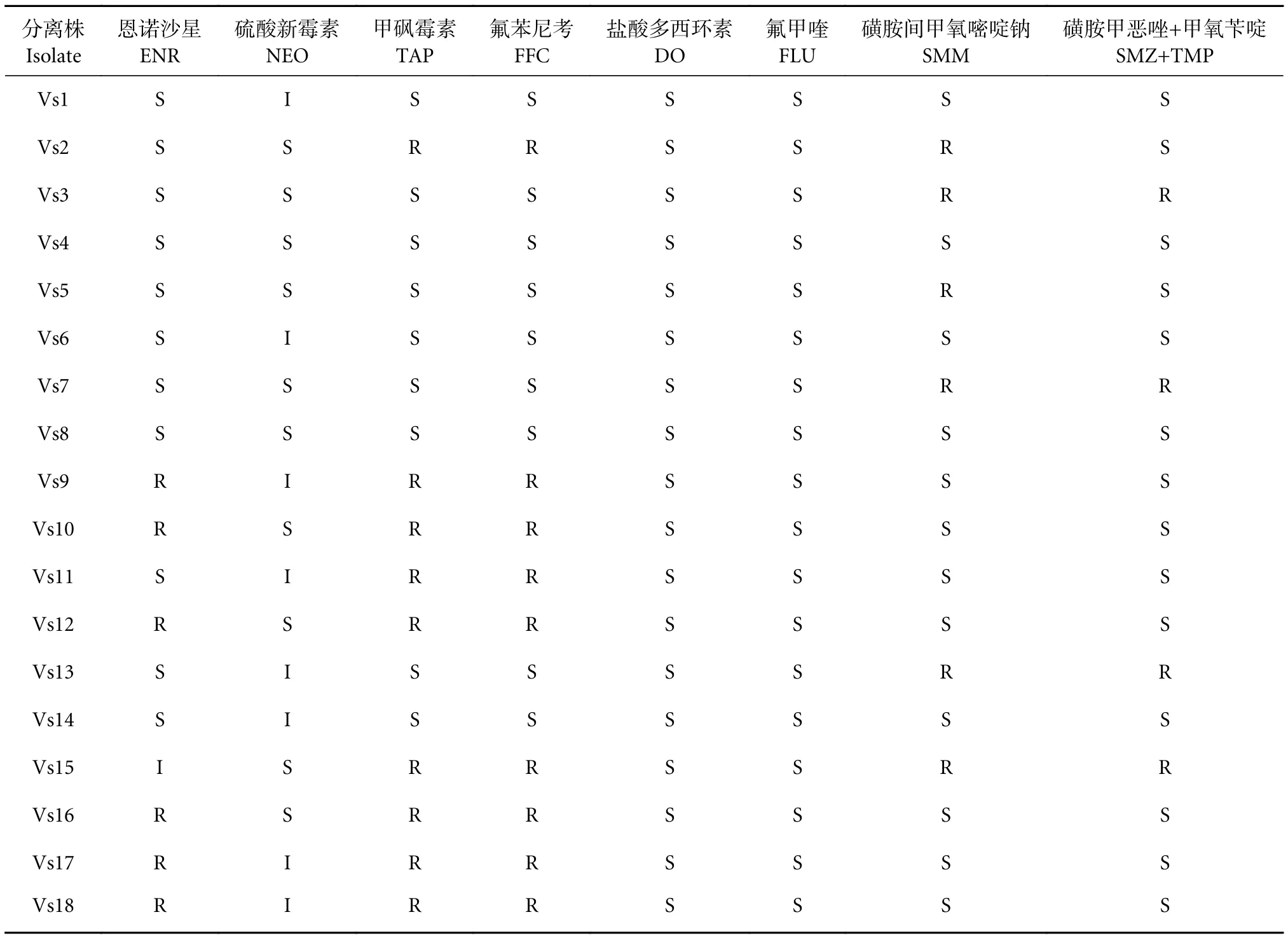
表3 18株大菱鲆弧菌的药物敏感性Table 3 Drug sensitivity of 18 V.scophthalmi strains
2.4 大菱鲆弧菌耐药基因检测
PCR扩增分离株5类17个耐药基因,耐药基因携带率见表4。18株均不携带被测氨基糖苷类和四环素类耐药基因;携带酰胺醇类耐药基因floR(61.11%) 和cmlA(66.67%),不携带catA;携带磺胺类耐药基因sul2 (55.56%),不携带sul1和sul3;携带喹诺酮类耐药基因qnrA(50%) 和qnrS(5.56%),不携带qnrB、oqxAB和aac(6')-lb-cr。

表4 大菱鲆弧菌耐药基因携带情况Table 4 Drug resistance genes status of V.scophthalmi
2.5 大菱鲆弧菌ERIC-PCR图谱分析
ERIC-PCR扩增产物2~10条,介于100~10 000 bp。用NTsys_2.10e软件进行聚类分析,相似度介于0.66~1.0,在相似度0.75处可以分为4个基因型。I型和III型较多,分别占44.4%和44.4%,II型和IV型各只有1株 (图3)。
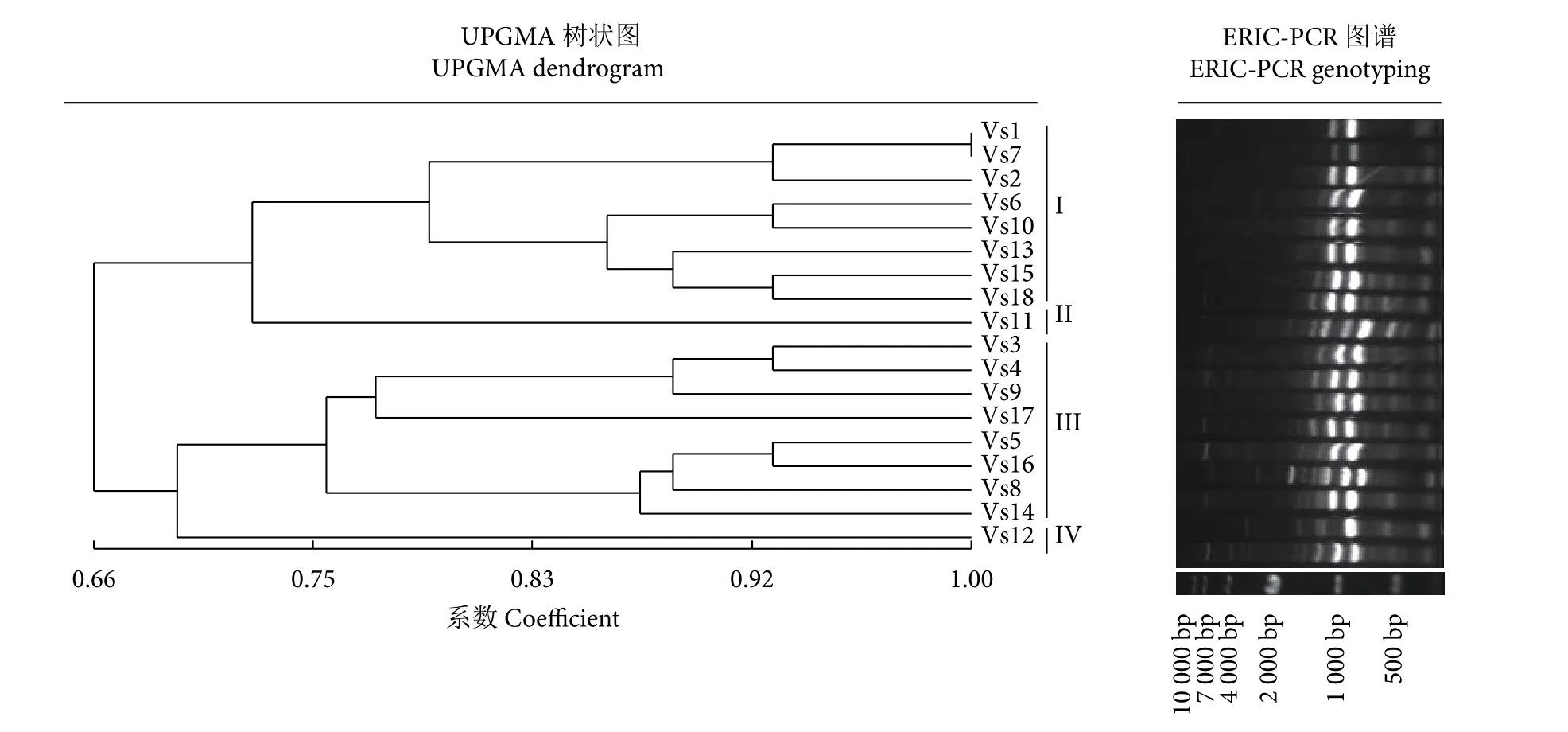
图3 大菱鲆弧菌分离株ERIC-PCR指纹图谱与UPGMA树状图Fig.3 Genetic diversity diagram based on ERIC-PCR and UPGMA dendrogram of V.scophthalmi strains
2.6 大菱鲆弧菌耐药基因、耐药表型和ERIC基因型相关性分析
18株大菱鲆弧菌耐药基因与耐药表型符合率见表5。氨基糖苷类和四环素类抗生素耐药基因检出率与耐药表型菌株符合率为100%,均未检测到。酰胺醇类耐药基因与耐药表型符合率较高,为88.89%,磺胺类符合率次之 (50%),喹诺酮类符合率最低 (33.33%),表明酰胺醇类耐药基因与耐药表型有一定的相关性。表6结合大菱鲆弧菌分离株的耐药谱、耐药基因谱和ERIC基因型,未发现明显的相关性。
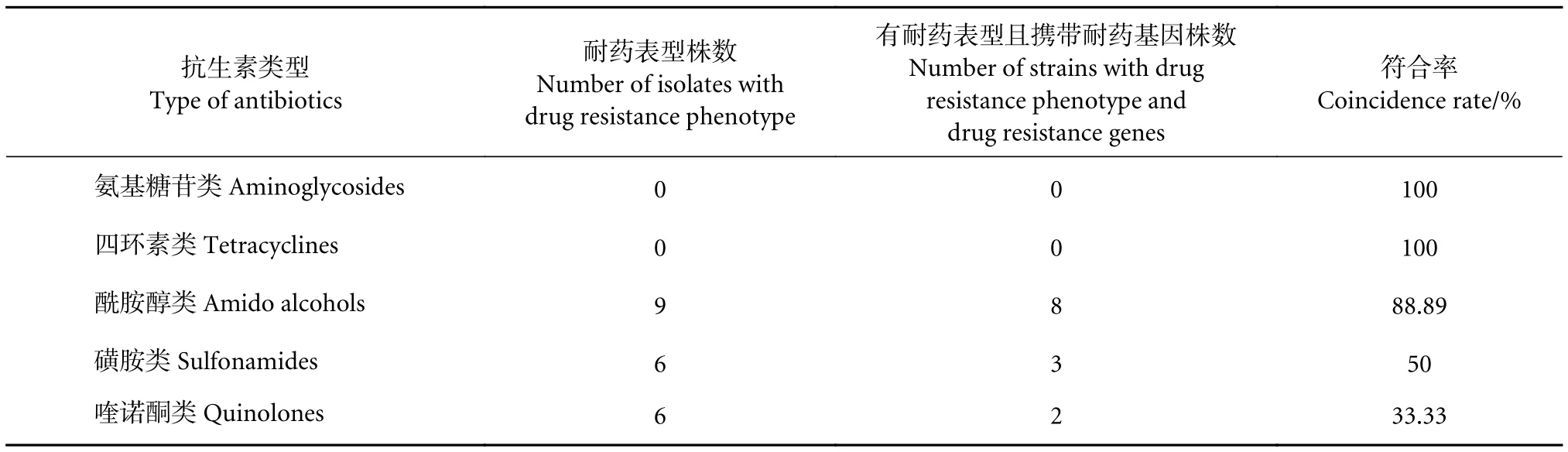
表5 大菱鲆弧菌分离株耐药基因与耐药表型符合率Table 5 Coincidence rate of drug resistance genes and phenotype of V.scophthalmi strains

表6 大菱鲆弧菌分离株耐药谱、耐药基因谱和ERIC基因型Table 6 Drug resistance spectrum, resistance gene spectrum and ERIC genotype of V.scophthalmi strains
3 讨论
3.1 大菱鲆分离株与大菱鲆弧菌分子生物学鉴定分析
16S rRNA存在于所有细菌染色体基因中,既具有保守区又有高变区,是研究细菌系统发育和菌种鉴定最常用的分子标志物[22],也是鉴定水产病原菌的主要分子手段。本研究表明,大菱鲆弧菌是优势菌,占总弧菌的50.43%和总分离株的29.70%,主要集中在8—10月。这与郑怀东等[10]2016年检测葫芦岛地区大菱鲆致病弧菌的结果相似。王鹤等[11]2018年从山东烟台市7—10月患病大菱鲆体内也分离到大菱鲆弧菌,其中优势菌是迟缓爱德华氏菌。值得注意的是,迟缓爱德华菌是大菱鲆养殖业的“头号杀手”,是引起大菱鲆腹水病的主要病原之一。2016年,华东理工大学研发的迟钝爱德华氏菌的“大菱鲆迟钝爱德华氏菌活疫苗” (EIBAV1株) 获得兽药产品批准文号并正式投产,目前已在辽宁、山东、河北等大菱鲆养殖主产区开展了规模化应用[23]。而此次辽宁地区分离的394株菌株中迟缓爱德华氏菌检出率为0,说明大菱鲆迟缓爱德华氏菌病已得到很好的防控。2019年,大菱鲆鳗弧菌基因工程活疫苗 (MVAV6203株) 获批国家Ⅰ类新兽药证书[2]。随着大菱鲆细菌病疫苗的不断研发,大菱鲆弧菌可能成为日后大菱鲆细菌性疾病的重点防控对象。
Pascual等[24]研究发现,弧菌种间16S rRNA基因序列同源性较高,rpoD可以用来区分哈维弧菌、坎氏弧菌 (V.campbellii)、轮虫弧菌 (V.rotiferianus)、副溶血弧菌、溶藻弧菌和V.natriegens6株弧菌。Tarazona等[16]以16S rRNA、gyrB、ftsZ、mreB、rpoD和recA等6种基因作为分子标记区分大菱鲆弧菌与鱼肠弧菌,结果发现rpoD是区分这两株弧菌的最佳选择。因此,本研究扩增大菱鲆弧菌的rpoD基因并与其他水产常见致病弧菌构建系统发育进化树,均与大菱鲆弧菌VS-05聚为一簇,并可以很好地区分大菱鲆弧菌与其他弧菌。这可能是研发大菱鲆弧菌快速检测技术的一个基因靶点。
3.2 大菱鲆弧菌耐药性分析
海水养殖总量逐年增长但病害多发,使用抗菌药仍是控制水产养殖细菌性疾病最快速有效的方案。然而,养殖生产过程中抗生素滥用现象严重,直接后果是在水产环境和养殖动物体内诱导出抗性菌株甚至多重抗性菌株[25]。因此我国对水产养殖用兽药及其他投入品的监管越来越重视。2020年10月,农业农村部发布《水产养殖用药明白纸2020年1、2号》,其中批准生产和使用的抗菌药仅有12种,分别是甲砜霉素粉、氟苯尼考粉、氟苯尼考注射液、氟甲喹粉、恩诺沙星粉、盐酸多西环素粉、维生素C磷酸酯镁盐酸环丙沙星预混剂、硫酸新霉素粉、磺胺间甲氧嘧啶钠粉、复方磺胺嘧啶粉、复方磺胺二甲嘧啶粉和复方磺胺甲噁唑粉。本研究选取其中8种抗菌药物用作药敏试验。
本研究选取的18株大菱鲆弧菌对硫酸新霉素、盐酸多西环素和氟甲喹尚未产生耐药性,对氟苯尼考和甲砜霉素的耐药率为50%,对其他3种药物的耐药率均高于20%,多重耐药率高达66.7%(12/18)。细菌的耐药性受地区和季节影响而呈现复杂性。王岚等[8]报道了2002—2010年山东地区分离的10株大菱鲆弧菌均对氟苯尼考敏感,对四环素类和喹诺酮类有较低比例的耐药性,对复方新诺明有90%的耐药性。崔惠敬等[4]关于大菱鲆弧菌药敏的研究结果显示,该菌对新霉素、复方新诺明和多西环素敏感,对环丙沙星和四环素耐药。郑怀东等[10]2016年4—10月从辽宁葫芦岛地区分离到的130株大菱鲆弧菌中挑选28株作药敏试验分析,结果显示大菱鲆弧菌对氟苯尼考 (7.1%)、诺氟沙星 (3.6%) 和盐酸多西环素 (17.9%) 有较低的耐药率,其中诺氟沙星已属于禁用渔药。王鹤等[11]分析9株山东地区2018年第三季度大菱鲆弧菌的耐药性,对磺胺类药物有接近100%的耐药率,对氟苯尼考、甲砜霉素和硫酸新霉素100%耐药,对恩诺沙星和盐酸多西环素均不耐药。盐酸多西环素是第二代四环素类抗生素,因其血浆半衰期、脂溶性和抗菌活性等性质优于其他四环素类抗生素,被广泛用于全球水产养殖[26]。结合本实验结果发现,大菱鲆弧菌对盐酸多西环素的耐药性普遍维持在很低的水平。这表明盐酸多西环素对大菱鲆弧菌有较好的抑制效果,可以作为辽宁地区防控由大菱鲆弧菌引起疾病的首选。此外,为科学用药避免长期使用同种抗菌药物,硫酸新霉素和氟甲喹可作为备选药物,其中硫酸新霉素对弧菌引起的肠炎有较好的治疗效果[27]。
3.3 大菱鲆弧菌耐药基因与耐药表型分析
从遗传学的角度上看,细菌耐药性分为自身基因突变的固有耐药性和捕获耐药基因的获得性耐药两种[28],前者是菌体自身结构导致对抗生素产生抗性的天然耐药,后者则是通过耐药基因获得耐药菌株的耐药性[25]。本研究检测了水产5类抗生素共17种耐药基因,未检测到氨基糖苷类和四环素类耐药基因,与耐药表型一致。氨基糖苷类和四环素类耐药基因检出率为0,也说明了这两类药物对大菱鲆弧菌有较好的治疗潜力。耐药基因检测率最高的是酰胺醇类耐药基因cmlA和floR,而且酰胺醇类耐药基因与耐药表型符合率为88.89%。cmlA和floR等基因与细菌主动外排泵系统有关,细菌通过主动外排泵系统将细胞内药物泵出,从而使得菌体内部药物浓度降低而对酰胺醇类药物产生耐药性[29]。值得注意的是,无论是酰胺醇类耐药表型还是耐药基因都非单独检测到,多数都伴随着其他耐药表型与其他耐药基因。这可能与细菌的外排作用有关,细菌的外排泵系统是细菌多重耐药的重要机制之一[30]。高晓华等[31]发现上海凡纳滨对虾 (Litopenaeus vannamei) 源副溶血弧菌磺胺类耐药表型与耐药基因符合率为20%~40%,这与本研究的检测结果类似,其原因可能是不同源细菌耐药基因拷贝数较低无法被检测到。本研究喹诺酮类符合率最低,可能是因为喹诺酮类耐药机制复杂以及检测的喹诺酮耐药基因较少。细菌通过靶基因突变、主动外排系统、改变细菌细胞膜通透性以及获得耐药质粒对喹诺酮类药物产生耐药性[32]。耐药表型的研究固然重要,但是潜在的耐药基因预示耐药性产生的趋势。从长远看,水产品携带的耐药基因可能随着食物链传播到人体,威胁人类健康[33]。检测耐药基因不仅从分子水平阐明细菌耐药性产生机制,也能作为协同抑菌或减少细菌耐药性绿色渔药筛选的靶标。
3.4 ERIC-PCR谱型分析
ERIC-PCR与脉冲场凝胶电泳PFGE分型类似,但成本更低且快速[34],被运用于区分水产养殖不同来源的菌株。Zhang等[13]和张永政等[15]分别对鲫 (Carassius auratus) 嗜水气单胞菌和罗非鱼(Oreochromis niloticus) 维氏气单胞菌进行了毒力基因检测和ERIC-PCR分型研究,结果表明ERICPCR有较好的分型效果,且毒力基因与ERICPCR分型有一定的相关性。本研究首次将ERICPCR分型用于大菱鲆弧菌,18株菌被分作4个亚型,以ERIC-I型和ERIC-III型为主,有较好的分型效果,但是分型结果与耐药表型或者耐药基因谱无明显的相关性。细菌多样的遗传背景和表型比其分类学归属更能反映其生态特性[35],ERIC-PCR分型可能更适用于不同地区分离株的区分,将来可以与其他地区甚至其他国家的大菱鲆弧菌ERICPCR谱作进一步比较,为大菱鲆弧菌的流行病学溯源和预防提供参考。ERIC-PCR分型结果与细菌致病力的相关性也是一个值得关注的研究方向。

