动态心电图在FOLFOX6 方案治疗结直肠癌患者化疗相关心脏毒性监测中的应用
罗湘华,商志远,李凯旋,杨友新,蒙静敏,庞富梅,黄燕,莫恰,沈永奇(通信作者)
1 广西医科大学附属柳铁中心医院肿瘤科 (广西柳州 545007);2 广西科技大学第一附属医院普通外科 (广西柳州 545100);3 融水苗族自治县人民医院普通外科 (广西柳州 545300);4 融水苗族自治县人民医院检验科 (广西柳州 545300);5 广西医科大学附属柳铁中心医院心电功能科 (广西柳州 545007);6 平南县第二人民医院肿瘤科 (广西贵港 537300);7 广西科技大学第二附属医院肿瘤科 (广西柳州 545100)
化疗相关心脏毒性指恶性肿瘤患者使用的化疗药物对心脏产生的毒性作用。常见化疗药物中,5-氟尿嘧啶(5-flurouracil,5-FU)类药物引起的心脏毒性发生率排名第二,仅次于蒽环类[1-2]。结直肠癌(colorectal cancer,CRC)发病率居我国恶性肿瘤发病率第4位,病死率居第5位,严重威胁人民群众的生命健康[3-6]。含有5-FU 的FOLFOX6方案是目前治疗CRC 患者的一线化疗方案,但该方案引起的化疗相关心脏毒性不容忽视。基于此,本研究探讨动态心电图在FOLFOX6方案治疗CRC 患者化疗相关心脏毒性监测中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料
选取5个肿瘤中心(广西医科大学附属柳铁中心医院肿瘤科、广西科技大学第一附属医院肿瘤科、融水苗族自治县人民医院肿瘤科、平南县第二人民医院肿瘤科和广西科技大学第二附属医院肿瘤科)2015年7月至2018年6月接诊的、同意使用FOLFOX6方案化疗的中晚期CRC 患者154例作为研究对象,其中男99例,女55例;临床分期,Ⅱ期31例,Ⅲ期61例,Ⅳ期62例;左半结肠癌42例,右半结肠癌20例,直肠癌92例;有心脏病史10例(均为轻度)。本研究经医院医学伦理委员会批准,患者及其家属均自愿签署知情同意书。
纳入标准:病理学诊断为CRC,既往未接受化疗;年龄18~75岁;体能状况、血常规、肝肾功能、心脏功能等基本达到化疗要求。排除标准:伴有严重血液病、心脏病、肝肾功能不全或活动性感染的患者;依从性差、对化疗抗拒的患者。
1.2 方法
所有患者均行FOLFOX6方案化疗:第1天,注射用奥沙利铂(南京制药厂,国药准字H20000686,生产批号201309112、201410122、201603111,规格 50 mg/瓶)100 mg/m2,静脉滴注;第1天,注射用亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H32022391,生产批号14052511、15023524、16063312,规格100 mg/支)400 mg/m2,静脉滴注;第1天,5-FU注射液(上海旭东海普药业有限公司,国药准字H31020593,生产批号FA130906、FA141213、FA161017,规格10 ml∶0.25 g)400 mg/m2,静脉滴注;第2~3天,5-FU注射液2 400 mg/(m2·d),静脉滴注;14 d为1个周期,每例患者至少化疗3个周期。
每周期化疗前后,所有患者均分别使用动态心电图及常规心电图监测化疗相关心脏毒性。(1)动态心电图:仪器为动态心电图分析系统(杭州百慧医疗设备有限公司,型号CT-083S),指导患者取平卧位,消毒电极安置部位皮肤后,固定电极,并将记录盒固定于患者背部,采用12导联连续描记患者 24 h 内的心电变化。(2)常规心电图:仪器为多通道心电图采集仪(厦门纳龙科技有限公司,型号aECG-18U),指导患者取平卧位,消毒电极安置部位皮肤后,固定电极,进纸速度为25 mm/s,增益为10 mm/mV,采集图像并打印。
1.3 观察指标
(1)化疗相关心脏毒性:采用美国国立癌症研究所的诊断标准将心脏毒性分为5级[7],0级指正常,无心脏毒性发生;Ⅰ级指轻微的心脏毒性,有轻微心电图异常,无症状、无需特殊治疗;Ⅱ级指轻度的心脏毒性,有时有轻微症状,一般无需治疗,至少无需住院治疗;Ⅲ级指较重的心脏毒性,患者有一定症状,必须接受专业治疗;Ⅳ级指严重的心脏毒性,症状及体征明显,甚至有生命危险,必须住院治疗。(2)异常心电图类型[8]:记录两种方法检出的心律失常、ST-T 改变、QT 间期延长及其他异常心电图类型。
1.4 统计学处理
采用 SPSS 16.0统计软件进行数据分析,计数资料以率表示,使用χ2检验进行分析,等级资料采用非参数Mann WhitneyU检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 化疗相关心脏毒性检出率
154例患者中,动态心电图检出化疗相关心脏毒性87例,检出率为56.5%;常规心电图检出45例,检出率为29.2%;两种方法的检出率比较,差异有统计学意义(χ2=12.511,P=0.000)。
2.2 化疗相关心脏毒性的严重程度
两种方法对化疗相关心脏毒性严重程度的检出情况比较,差异有统计学意义(P<0.05),见表1。
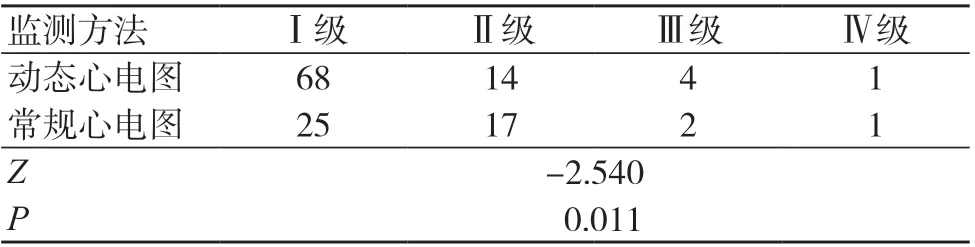
表1 两种方法检出的化疗相关心脏毒性的严重程度比较(例,154例)
2.3 异常心电图类型
动态心电图对心律失常、ST-T 改变的检出率高于常规心电图,差异有统计学意义(P<0.05);两种方法对QT 间期延长和其他异常心电图的检出情况比较,差异无统计学意义(P>0.05),见表2。
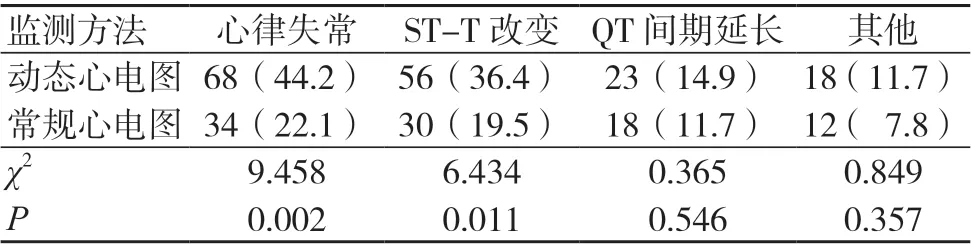
表2 两种方法对异常心电图类型的检出情况比较[例(%),154例]
3 讨论
5-FU 是CRC 化疗的基础药物,含有5-FU 的FOLFOX6方案是治疗CRC 患者的一线化疗方案,而心脏毒性是5-FU 的常见不良反应之一,会严重影响患者的治疗效果和生命质量。目前,临床普遍认为,5-FU 相关心脏毒性的发生机制为冠状动脉痉挛[9],即5-FU 类药物可导致血管内皮损伤,引起血管痉挛及动脉血栓形成,诱发心肌缺血[10]。另有研究表明,5-FU 类药物可被心肌部分吸收,从而直接损害心肌细胞[11]。
有研究报道,5-FU 所致心脏毒性的发生率为16%~50%,多表现为心电图异常,且有心脏病史的患者更易发生。另有研究表明,5-FU 相关心脏毒性主要表现为心律失常及心肌缺血性改变(ST-T 改变),部分患者会发生典型心绞痛,给予钙拮抗剂或硝酸盐治疗多可缓解,但患者的血清心肌酶水平通常正常[12-13]。国内一项大样本研究结果提示,我国5-FU 类药物相关心脏毒性的发生率为30.6%,其中心律失常发生率为20.87%,缺血性改变发生率为19.92%,且注射剂型导致的心脏毒性的发生率低于口服剂型[14]。以上研究均采用常规心电图对化疗相关心脏毒性进行监测,但常规心电图提供的心电记录是短暂的,可能会遗漏非持续性异常心电图。
唐娟[5]的研究提示,动态心电图和常规心电图对无症状心肌缺血的检出率分别为84.78%和47.83%,表明动态心电图的监测效能优于常规心电图。本课题组的前期研究提示,动态心电图和十二导联常规心电图对含5-FU 类药物方案治疗中晚期原发性肝癌患者的异常心电图检出率分别为74.1%和37.5%,提示动态心电图更易检出化疗相关心脏毒性[8]。
本研究结果显示,动态心电图对化疗相关心脏毒性的检出率高于常规心电图,差异有统计学意义(P<0.05);两种方法对化疗相关心脏毒性严重程度的检出情况比较,差异有统计学意义(P<0.05);动态心电图对心律失常、ST-T 改变的检出率高于常规心电图,差异有统计学意义(P<0.05)。这一结果提示,在FOLFOX6方案治疗CRC 患者化疗相关心脏毒性监测中,动态心电图的监测效能优于常规心电图。本研究中,两种方法的监测结果均显示,患者的心脏毒性以Ⅰ级为主,且心律失常、ST-T 改变是最常见的异常心电图类型,提示使用动态心电图监测化疗相关心脏毒性,可提供动态数据,使医师尽早采取相应防治措施,防止进一步心脏损害事件的发生。
综上所述, 含5-FU 的FOLFOX6 方案对CRC化疗所致的心脏毒性发生率较高但以轻度为主,24 h 动态心电图比常规心电图检测更加灵敏,能更易、更早发现心脏毒性,因此可采用24 h 动态心电图代替常规心电图进行监测。

