不同浓度艾芬地尔在社会应激模型中的抗抑郁作用
赵雨桐 于骁 杨新宇 赵欣怡 周恩泽 田铮

[摘要]目的:观察不同浓度艾芬地尔对社会压力应激后小鼠抑郁样行为的影响,研究其作为快速持久抗抑郁药的最适浓度。方法:将C57BL/6小鼠成功建立社会压力应激模型后,分别给予0.3.mg/kg、1.mg/kg和3.mg/kg艾芬地尔腹腔注射,通过运动、悬尾、强迫游泳和1%蔗糖偏好试验研究,观察其最适浓度。结果:在悬尾、强迫游泳及1%蔗糖偏好试验中,浓度为0.3.mg/kg和1.mg/kg的艾芬地尔在单剂量给药后对小鼠不动时间及蔗糖偏好并没有明显作用,而浓度为3.mg/kg的艾芬地尔在一定程度上降低了小鼠的不动时间并且增加了蔗糖偏好程度。结论:剂量浓度为3.mg/kg的艾芬地尔在社会压力应激模型中有快速持久的抗抑郁作用。
[关键词]抗抑郁药;选择性NR2B受体拮抗剂;艾芬地尔;社会压力应激模型
[中图分类号]R749.4+1.
[文献标识码]A.
[文章编号]2096-5249(2022)03-0011-04
抑郁症是以持续的心境低落、思维迟缓、意志活动减慢、认知功能受损等为主要临床症状的精神疾病,复发率高,约2%~7%的患者死于自杀[1-2]。2020年,在所有疾病中抑郁症全球总负担量跃居第2位[3]。部分抑郁症患者经首次足量、足疗程抗抑郁药治疗后的效果并不理想[4]。目前临床应用的抗抑郁药5-羟色胺再摄取抑制剂因起效慢、特异性差、副作用大,复发率高等缺点,用药效果并不理想[5]。因此需要开发起效快、作用持久的抗抑郁药物来降低患者的自杀率,提高生存质量[6]。
N-甲基-D-天门冬胺酸(NMDA)受体拮抗剂,如氯胺酮,具有快速缓解抑郁症状的特点并可维持较长时间而受到广泛关注[7-8],但因其认知功能障碍和工作记忆受损等副作用被限制应用[9]。有研究报道高选择性的NMDA受体2B亚基(NR2B)拮抗剂艾芬地尔及其衍生物Ro25-6981和CP101-606,对NR2B具有高亲和力、非竞争性的抑制作用,且副作用轻微[10]。且有研究发现,当艾芬地尔所给剂量为3mg/kg时具有抗抑郁作用[11],但是这一作用在社会压力应激模型中并不明确。因此本实验通过观察不同浓度的艾芬地尔用药后模型小鼠的行为学变化,进一步确定艾芬地尔的抗抑郁作用和最适浓度,为研发副作用小,靶向性强的抗抑郁药物提出科学依据。
1材料与方法
1.1实验动物及方法
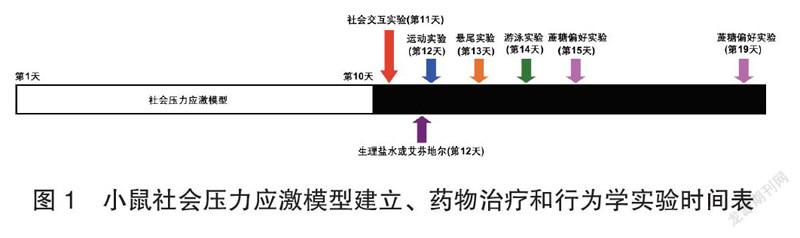
采用8周龄(体重20~25g)雄性成年,C57BL/6小鼠作为实验小鼠和13~15周龄(体重>40克)雄性成年CD1小鼠作为攻击小鼠。动物在可控温度和12h光照/黑暗周期(上午7:00至下午7:00开灯)下饲养,并随意食用水及食物。将40只C57BL/6小鼠分为5组,每组8只。对照组不做任何处理,抑郁组受到CD1小鼠攻击后不做任何处理,其余三组为0.3mg/kg艾芬地尔组、1mg/kg艾芬地尔组、3mg/kg艾芬地尔组。之后建立社会压力模型,从第1天到第10天造社会压力模型,第11天进行社会交互实验。第12天将艾芬地尔溶解于5%DMSO(二甲基亚砜),制备成0.3mg/kg、1mg/kg和3mg/kg三种不同浓度,将生理盐水(10mL/kg)、不同浓度的艾芬地尔(0.3mg/kg、1mg/kg、3mg/kg)分别按实验分组对小鼠进行单次腹腔注射。注射后0.5h、24h、48h分别进行运动量测定实验(LMT)、悬尾实验(TST)和强迫游泳实验(FST);注射后第3天和第7天分别进行1%蔗糖偏好实验(SPT)。
1.2社会压力应激模型
1.2.1造模
将C57BL/6小鼠作为造模对象,使其连续受CD1小鼠“一对一”攻击10d,每天10min。每次攻击结束时,将以上两只小鼠安置在笼子的各一半,中间用穿孔的有机玻璃分隔器隔开,以便在24h的剩余时间内进行视觉、嗅觉和听觉交流(图1)。
1.2.2社会交互试验
在第11天进行社会交互试验以确定造模是否成功。社会交互试验采用黑色不透明的试验箱(42cm×42cm),试验箱的一端镶有网笼(10cm×4.5cm)。首先將一只C57BL/6小鼠放入空的试验箱,对其运动进行2.5min的跟踪,并记录其在互动区(网笼周围8cm内区域)的持续时间,2.5min结束后将小鼠从试验箱中取出;然后,在网笼中放入一只CD1小鼠,随即再次将上述C57BL/6小鼠放入试验箱,用同样方法计算其2.5min在互动区的时间。若后面与前面时间的比值<1,则为造模成功,比值≥1为造模失败。
1.3行为学实验
第12天,对照组和抑郁组给予10mL/kg生理盐水腹腔注射,0.3mg/kg、1mg/kg和3mg/kg艾芬地尔组分别给予相应浓度的艾芬地尔腹腔注射。所有行为学实验顺序依次为:LMT(注射后0.5h)、TST(注射后24h)、FST(注射后48h)、1%SPT(注射后第3、7天)。
1.3.1LMT
旷场实验箱由沃瑞德生物科技有限公司提供。将小鼠放在周围不透明的旷场箱里(100cm×100cm×40cm),记录每只小鼠连续5min的总运动距离,用SMART3.0行为学分析系统进行数据分析。
1.3.2TST
取一段胶带,将其一端粘在离小鼠尾巴末端大约2cm的地方,另一端挂在悬尾实验箱的钩子上。对测试小鼠进行录像,每只10min,然后用计时器记录不动时间。
1.3.3FST
将小鼠单独置于一个圆筒(直径22cm,高度30cm)中,向该圆筒内注入15cm高的水,水温维持在(23±1)°C。将小鼠放入水中,使小鼠们无法接触圆筒底部。小鼠游泳或者不动,用秒表记录每只小鼠6min的不动时间(当小鼠四肢完全静止时,认为它们是不动的)。
1.3.41%SPT
给小鼠提供2个水瓶:分别装有普通饮用水及1%蔗糖溶液。给小鼠饲予水和1%蔗糖溶液48h。随后饥饿4h,之后再次给予水和1%蔗糖溶液1h,在这1h开始和结束时将含有水和蔗糖的瓶子称重,并测定小鼠的蔗糖偏好,蔗糖偏好计算方法为蔗糖溶液消耗量占液体总消耗量的百分比。
1.4统计学分析
全部数据均使用PASWStatistics25进行分析。计量资料以(x±s)表示,多样本均数比较采用方差分析。以P<0.05为有统计学意义。
2结果
在运动量测定实验中,五组间运动差异无统计学意义(F=0.785,P=0.544)(图2a)。在TST及FST中,抑郁组、0.3mg/kg和1mg/kg艾芬地尔组平均不动时间较对照组和3mg/kg艾芬地尔组显著延长(图2b~c)。在SPT(单次腹腔注射第3天和第7天)中,抑郁组、0.3mg/kg和1mg/kg艾芬地尔组蔗糖偏好程度较对照组和3mg/kg艾芬地尔组显著降低(图2d~e)。
3讨论
抑郁症是一种病因和发病机制不明的精神障碍,其发生可能与神经递质分泌减少、神经细胞的凋亡、炎症反应、肠道菌群失调等多种因素有关。目前临床过程中治疗抑郁症常用药物仍以选择性5-羟色胺再摄取抑制剂为主,其药理机制主要是通过对突触间隙单胺类神经递质的浓度进行调解来发挥抗抑郁作用[12]。单胺神经递质如去甲肾上腺素、5-羟色胺和多巴胺,这些常用抗抑郁药均存在起效缓慢,首次用药有效率低,复发率较高、特异性差、不良反应多(如胃肠道反应、头痛、嗜睡或者失眠及性功能障碍等)等局限性,降低了患者用药的依从性,不利于康复,尤其是不利于重症患者自杀风险的防范。基于此,表明传统抗抑郁药物并不适用于所有的抑郁症患者。而快速起效抗抑郁药,能够迅速缓解抑郁症患者发作时的症状,使抑郁症患者的自杀率降低,提高患者的生存水平与质量。
现代医学对抑郁症发病机理的研究正逐步深入,研究发现脑内兴奋性氨基酸——谷氨酸,特别是其受体亚型之一,NMDA受体在抑郁症的发生及发展中的作用引起普遍关注。NMDA受体即为N-甲基-D-天冬氨酸受体,是离子型谷氨酸受体的一个亚型,分子结构复杂,药理学性质独特,不仅在神经系统发育过程中发挥重要的生理作用,如调节神经元的存活,调节神经元的树突、轴突结构发育及参与突触可塑性的形成等,而且对神经元回路的形成亦起着关键的作用。NMDA受体拮抗剂可产生抗痛敏、减轻异常疼痛等作用,广泛用于临床镇痛。并且NMDA受体拮抗剂具有调节谷氨酸活性的作用,主要用于中晚期阿兹海默病患者的治疗。NMDA受体拮抗剂对结肠直肠扩张引起的内脏运动反应具有减弱作用,因此也可应用于过敏性肠综合征的治疗。近年来发现,对于重症及难治性抑郁症患者单次给予低剂量(不致引起精神异常)离子型NMDA受体拮抗剂可以短时间内产生抗抑郁效果,缓解抑郁症状,并可维持较长时间。在缓解症状的同时,还能显著降低患者的自杀倾向和改善认知[13-14],可有效地预防重症抑郁症患者的自杀风险。
目前临床中常用的NMDA受体拮抗剂如氯胺酮具有快速抗抑郁作用,但是由于离子型NMDA受体拮抗剂选择性低,作用于将近全部的NMDA受体,并且在给药后普遍存在急性不良反应,长期频繁使用有引发成瘾、精神症状的风险,同时可能导致认知障碍、工作记忆受损、膀胱炎等症状,其反复注射对延续疗效的效果有限,而低剂量使用便可以导致解离症状。由于这些副作用的存在,限制了氯胺酮在治疗抑郁症方面进行广泛应用[16]。因此用于治疗抑郁症药物的重点应放在起效快,特异性强,减轻副作用等方面。
因此,选择一种靶向性强的NMDA受体拮抗剂作为治疗药显得尤为重要。与其他NMDA受体亚单位相比,NMDA受体的NR2B亚基分布相对集中,在机体许多重要的生理病理过程中起着重要作用,如学习、记忆、疼痛、神经元凋亡等[17]。艾芬地尔是一种选择性NR2B受体拮抗剂。正如已有研究表明,艾芬地尔最初是作为一种肾上腺素能对抗药物开发的,可通过松弛血管平滑肌和抑制α受体,而起到扩张脑血管、改善脑细胞代谢的作用。还能通过受体产生一种神经保护效应。同时也有研究表明,艾芬地尔具有抗疼痛作用,在治疗神经痛方面,部分功效已经被證明。包括带状疱疹后神经痛,脊椎损伤和幻肢引起的中枢神经痛。因此,NR2B选择性拮抗剂艾芬地尔有可能成为更安全有效的神经元保护剂,但是目前仍需要进一步研究来验证这种药物的作用机制。
而本研究发现与氯胺酮类似,单次腹腔注射剂量为3mg/kg的艾芬地尔在社会压力应激模型中能够起到快速和持久的抗抑郁作用。有趣的是,剂量为0.3mg/kg和1mg/kg艾芬地尔并不起作用。以前有研究表明,单次给药后7d,氯胺酮可改善慢性轻度应激模型下啮齿动物的无食欲[18-19]。值得注意的是,3mg/kg的艾芬地尔在慢性不可预见性应激模型中的这些快速且持久的抗抑郁作用与氯胺酮相似[20]。由于氯胺酮在难治性抑郁症患者中也显示出快速和持续的抗抑郁作用,因此适当剂量浓度的艾芬地尔或许也可以起到类似作用。因此,尽管选择性NR2B受体拮抗剂艾芬地尔对于治疗抑郁症的有效性和安全性需要在临床中得到进一步证实,但是其作为快速、持续的抗抑郁药物仍然有着极大的开发潜力。
参考文献
[1]林芳波,侯德仁,唐秋萍.抑郁症的药物治疗进展及艾氯胺酮的应用前景[J].南方医科大学学报,2017,37(4):567-569.
[2] Ferrari A J, Somerville A J, Baxter A J,et al.Global variation in the prevalence and incidence of major depressive disorder:a systematic review of the epidemiological literature[J].Psychological Medicine,2013,43(3):471-481.
[3] Ferrari A J,Norman R E,Greg F,et al.The burden attributable to mental and substance use disorders as risk factors for suicide:findings from the global burden of disease study 2010[J].Plos One,2014,9(4):e91936.
[4]李海霞.難治性抑郁症的临床治疗现状[J].医疗装备,2019,32(12):200-201.
[5]徐凌志,李素霞,孙成玉,等.快速抗抑郁机制研究进展[J].脑与神经疾病杂志,2014,22(4):317-321.
[6]徐赛.NMDA受体拮抗剂作为快速起效抗抑郁药物的研究进展[J].四川生理科学杂志,2020,42(3):366-369.
[7] Price RB,Nock MK,Charney DS,et al. Effects of intravenous ketamine on explicit and implicit measures of suicidality in treatment-resistant depression[J]. Biological Psychiatry,2009,66(5):522-526.
[8] Loo CK,Gálvez V,O'Keefe E,et al. Placebo-controlled pilot trialtestingdosetitrationandintravenous,intramuscular and subcutaneous routes for ketamine in depression[J]. Acta Psychiatrica Scandinavica,2016,134(1):48-56.
[9] Sanacora G,Frye MA,Mcdonald W,et al. A consensus statement on the use of ketamine in the treatment of mood disorders[J]. JamaPsychiatry,2017,74(4):399.
[10] Nagy J. The NR2B subtype of NMDA receptor:a potential target for the treatment of alcohol dependence[J]. Current Drug Targets-CNS & Neurological Disorders,2004,3(3): 169-179.
[11] Dong C,Ji-Chun Z,Yao W,et al. Rapid and sustained antidepressant action of the mGlu2/3 receptor antagonist MGS0039 in the social defeat stress model:comparison with ketamine[J]. Int J Neuropsychopharmacol,2017,20(3): 228-236.
[12]吴晓蕾.抑郁症的药物治疗进展及艾氯胺酮的应用前景[J].航空航天医学杂志,2018,29(8):1010-1012.
[13] Zarate CA,Singh JB,CarlsonPJ,et al. A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression[J]. Archives of General Psychiatry,2006, 63(8):856-864.
[14] Berman RM,Cappiello A,Anand A,et al. Antidepressant effects of ketamine in depressed patients[J]. Biological Psychiatry,2000,47(4):351-354.
[15] Coyle CM,Laws KR.The use of ketamine as an antidepressant:a systematic review and meta- analysis[J]. Hum Psychopharmacol,2015,30(3):152-163.
[16]余娟萍,陈艺芳,胡逸儒,等.氯胺酮抗抑郁作用机制与临床疗效研究进展[J].国际精神病学杂志,2020,47(4):662-665.
[17] KumarG,PatnaikR.Exploringneuroprotectivepotentialof withania somnifera phytochemicals by inhibition of GluN2B- containing NMDA receptors:An in silico study[J]. Medical Hypotheses,2016,92 :35-43.
[18] LiN,LiuRJ,DwyerJM,etal.GlutamateN-methyl-D- aspartate receptor antagonists rapidly reverse behavioral and synaptic deficits caused by chronic stress exposure[J]. Biological Psychiatry,2011,69(8):754-761.
[19] [1] Ma XC, Dang YH, Min J,et al. Long-lasting antidepressant action of ketamine,but not glycogen synthase kinase-3inhibitorSB216763,inthechronicmildstress model of mice[J].Plos One,2013,8(2):e56053.
[20] LiSX,HanY,XuLZ,etal.UncouplingDAPK1from NMDA receptor GluN2B subunit exerts rapid antidepressant- like effects[J]. Molecular Psychiatry,2017,23(3):597-608.
(收稿日期:2021-09-25)

