单核细胞趋化蛋白-1、可溶性细胞黏附分子-1诊断新生儿缺氧缺血性脑病的价值
何 梅, 尚 彪, 杨雪利, 鲜蓉华
(四川省南充市中心医院 新生儿科, 四川 南充, 637000)
新生儿缺氧缺血性脑病(HIE)是围产期窒息所致的脑组织血氧缺乏性损伤,会导致患儿发生智力障碍、颅内出血、运动障碍、继发癫痫等相关后遗症,病情严重时会威胁生命安全[1]。HIE主要表现为惊厥、肌张力异常以及意识状态变化,部分病情严重的患儿甚至会出现呼吸节律不齐以及中枢性呼吸衰竭[2-3]。HIE的发生是多种原因导致血氧缺乏,可进一步造成脑组织功能部分甚至全部损伤,是患儿发生神经系统后遗症以及预后不良的重要原因,而及时、准确的病情评估以及治疗是改善患儿预后的关键[4-5]。单核细胞趋化蛋白-1(MCP-1)可以趋化单核细胞或巨噬细胞,诱导升高趋化黏附因子水平,进一步影响脑组织血供,加重脑组织损伤。可溶性细胞黏附分子-1(sICAM-1)是可以发挥免疫球蛋白作用的单链糖蛋白,不仅可以介导机体炎症反应,还会导致脑组织或神经的进一步损伤[6-7]。目前研究[8]显示缺血性脑卒中患者体内MCP-1、sICAM-1水平异常,其参与介导了机体脑损伤的发生及发展,但HIE患儿MCP-1、sICAM-1水平变化与病情进展的关系尚需进一步研究证实。本研究探讨MCP-1、sICAM-1水平在HIE患儿病情诊断中的价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2016年1月—2021年7月四川省南充市中心医院收治的102例HIE患儿以及同期在医院娩出的54例健康新生儿作为研究对象,分别纳入HIE组与对照组。纳入标准: ① HIE参照相关诊断标准[9]进行诊断,即患儿存在明显的宫内窘迫表现,以及母亲产前存在明显宫内窘迫病史、分娩明显窒息史; 出生期间存在严重窒息史; 出生后不久即出现意识变化、肌力改变、原始反射异常等神经系统症状,且症状持续时间超过24 h。② 新生儿均为足月产儿,且均在该院出生。③ 新生儿完成本研究中血清指标测定。④ 新生儿家属同意参与本研究,本研究获得医院伦理委员会批准。排除标准: ① 伴重要脏器病变或者代谢性疾病者; ② 存在全身性感染、染色体异常、营养不良的新生儿; ③ 伴呼吸系统疾病、中枢系统畸形或者先天性心脏病患儿; ④ 入组前已经接受针对性治疗者; ⑤ 存在因胆红素脑病、低血糖脑病、宫内感染、先天性疾病等其他原因所致脑病者。HIE组中男61例,女41例; 胎龄38~41周,平均(39.15±0.57)周; 出生体质量3.2~4.2 kg, 平均(3.67±0.32) kg。对照组中男30例,女24例; 胎龄37~40周,平均(38.75±0.52)周; 出生体质量3.4~4.5 kg, 平均(3.75±0.38) kg。2组新生儿性别、胎龄、出生体质量等一般资料比较,差异无统计学意义(P>0.05), 具有可比性。
1.2 方法
HIE患儿在出现神经系统症状24 h后采集血样,对照组新生儿采集空腹静脉血2 mL, 离心处理后保留上清液,采用酶联免疫吸附试剂盒测定MCP-1、sICAM-1水平,依据试剂盒说明书中步骤进行血清MCP-1、sICAM-1水平测定,对应试剂盒分别购自上海春晓生物技术有限公司、上海继锦化学科技有限公司。HIE患儿病情严重程度的评估标准[9]见表1。
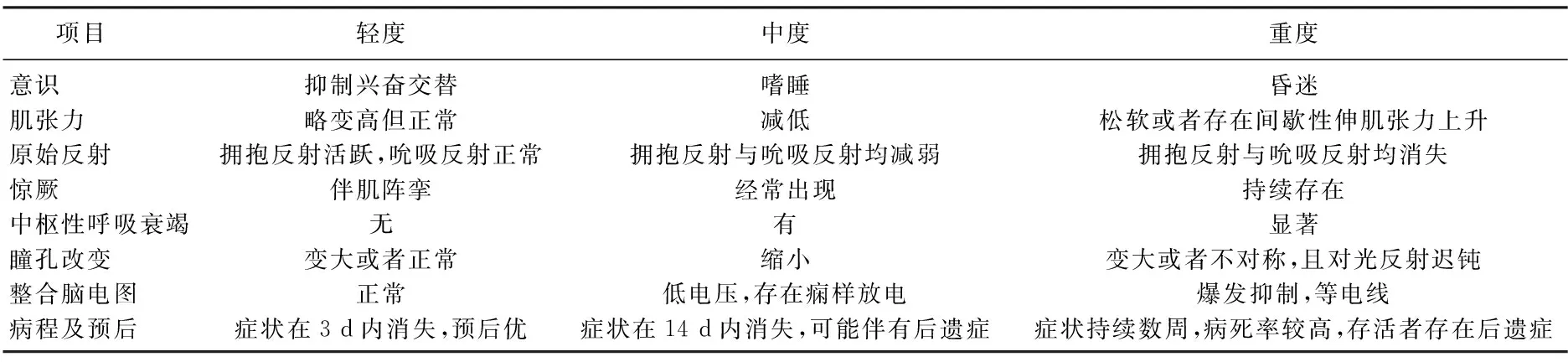
表1 病情严重程度评估标准
1.3 观察指标
比较2组新生儿血清MCP-1、sICAM-1水平,比较不同病情严重程度HIE新生儿血清MCP-1、sICAM-1水平,分析血清MCP-1、sICAM-1水平与病情严重程度的相关性。
1.4 统计学方法
采用SPSS 20.0软件进行数据分析,血清指标均为计量资料,采用均数±标准差表示,组间比较采用t检验,多组间比较采用单因素方差分析,两两比较应用SNK法分析,血清指标对HIE病情诊断的价值应用受试者工作特征(ROC)曲线分析,血清指标与HIE患儿病情严重程度的关系应用Spearman相关性分析,P<0.05为差异有统计学意义。
2 结 果
2.1 2组新生儿血清MCP-1、sICAM-1水平比较
HIE组新生儿血清MCP-1、sICAM-1水平高于对照组,差异有统计学意义(P<0.05), 见表2。
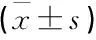
表2 2组新生儿血清MCP-1、sICAM-1水平比较
2.2 血清MCP-1、sICAM-1对HIE的诊断价值分析
ROC曲线显示,血清MCP-1、sICAM-1诊断HIE的曲线下面积(AUC)分别为0.828、0.794, 联合诊断HIE的AUC为0.903, 见表3、图1。
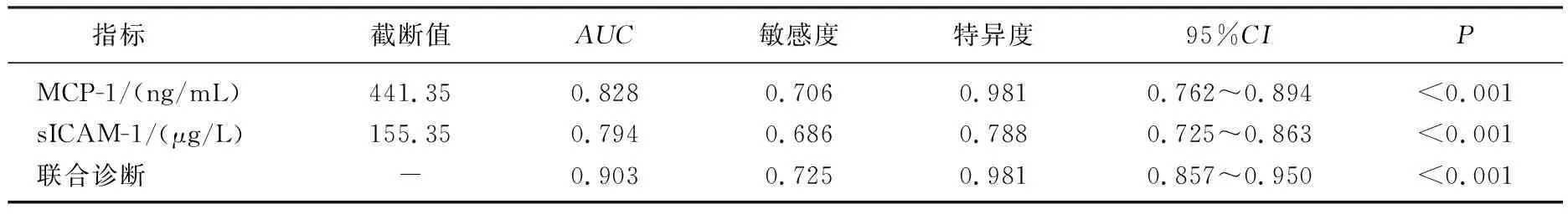
表3 血清MCP-1、sICAM-1诊断HIE的价值

图1 血清MCP-1、sICAM-1诊断HIE的ROC曲线
2.3 不同病情严重程度HIE组新生儿血清MCP-1、sICAM-1水平比较
轻度、中度与重度HIE新生儿分别为43例、39例与20例,随着病情的加重,轻度、中度、重度HIE患儿血清MCP-1、sICAM-1水平呈升高趋势,差异均有统计学意义(P<0.05), 见表4。
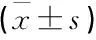
表4 不同病情严重程度HIE组新生儿血清MCP-1、sICAM-1水平比较
2.4 血清MCP-1、sICAM-1水平与病情严重程度的相关性分析
Spearman相关性分析显示,血清MCP-1、sICAM-1水平与病情严重程度呈显著正相关(r=0.618、0.527,P<0.05)。
3 讨 论
HIE是新生儿科重要疾病之一,多发生于严重窒息后,患儿病情危急,多存在永久性神经功能损伤,预后相对较差[10-11]。目前研究[12-13]认为HIE发生与机体免疫炎症损伤关系密切,神经系统与免疫系统在保证机体内环境稳定中发挥重要作用,缺氧导致机体应激反应激活,两者相互影响会导致免疫功能紊乱,加重缺氧所致脑损伤。
本研究结果显示, HIE组新生儿血清MCP-1、sICAM-1水平显著高于对照组,提示MCP-1、sICAM-1参与机体免疫病理损伤炎症机制,参与介导HIE炎症反应。分析原因为MCP-1可使T淋巴细胞趋化,并诱导脑组织中性白细胞聚集而加重脑组织损伤,同时还可以促进黏附因子释放,进一步加重病灶炎症损伤。高水平sICAM-1可以诱导单核-淋巴细胞以及中性粒细胞在损伤位置聚集,进一步促进细胞毒性物质如神经毒细胞因子以及氧自由基等释放,加重脑组织细胞损伤[14-16]。石小翠等[17]研究显示,缺血性脑梗死患者血清MCP-1水平高于健康者,认为MCP-1可以经由影响炎症因子水平分泌而介导缺血缺氧性脑组织损伤。研究[18]显示HIE患儿血清sICAM-1水平明显高于对照组, sICAM-1可以促进下游炎症因子白介素-8与白介素-10的释放,诱导肿瘤坏死因子-α水平上调,导致机体炎症反应扩散,进一步加重血氧缺乏所致脑损伤。
本研究ROC曲线显示,血清MCP-1、sICAM-1诊断HIE的AUC分别为0.828、0.794, 联合诊断HIE的AUC为0.903, 表明血清MCP-1、sICAM-1诊断HIE具有一定的价值。许云鹤等[19]研究显示,缺血性脑卒中患者血清MCP-1水平与患者脑组织损伤呈正相关,认为在正常情况下机体MCP-1水平相对较低,脑缺血性损伤情况下自由基大量释放,促进机体多种细胞如内皮细胞、神经元等释放MCP-1,同时促进黏附分子释放,参与介导机体脑组织血氧供应,进而加重脑组织损伤。动物实验显示应用川穹嗪处理脑缺血再灌注损伤大鼠后可以发挥显著的脑保护作用,其作用机制可能与血管内皮生长因子参与磷脂酰肌醇3-激酶/蛋白质丝氨酸苏氨酸激酶信号通路激活、下调MCP-1等相关炎症因子水平有关,也可能涉及机体脑损伤与机体MCP-1水平的变化。本研究显示,血清MCP-1、sICAM-1水平与病情严重程度呈显著正相关。
综上所述,血清MCP-1、sICAM-1可能参与介导HIE患儿脑损伤免疫炎症病理生理过程,并与患儿病情严重程度关系密切,在诊断HIE患儿病情中具有一定的价值。

