保存液类型及56℃灭活前处理对呼吸道病毒荧光PCR检测结果的影响
林艳艳,邢子伟,伦雪恩,刘梓航,谢英俊,谭翰清★
(1.肇庆市医学高等专科学校,广东 肇庆 526020;2.肇庆市疾病预防控制中心,广东 肇庆 526060;3.广州医科大学附属第三临床学院,广东 广州 510150;4.广东省产科重大疾病重点实验室,广州医科大学附属第三医院妇产科,广东 广州 510150;5.广东省普通高校生殖与遗传重点实验室,广州医科大学附属第三医院,广东 广州 510150)
呼吸道病毒是一类致病性病原微生物,主要通过飞沫、直接接触等途径传播。进行核酸检测是我国防控呼吸道病毒传播的重要手段,而检测过程中的生物安全问题需要重点关注[1-2]。采用灭活型病毒保存管保存呼吸道病毒并对其实施灭活前处理,可进一步降低检测过程中检测人员感染的发生风险,提高检测的安全性。本研究探讨保存液类型及56℃灭活前处理30 ~60 min 对经磁珠法提取的呼吸道病毒荧光PCR 检测结果的影响。
1 材料与方法
1.1 仪器与试剂
7500fast 实时荧光PCR 仪(由美国ABI 公司生产)、AUTO-PURE 32A 核酸提取仪(由杭州奥盛仪器有限公司生产)。磁珠法核酸提取试剂(由重庆中元生物技术有限公司生产)、呼吸道病毒核酸检测试剂盒(由上海伯杰医疗科技有限公司生产)。含胍盐的灭活型病毒保存管(由山东威高集团医用高分子制品股份有限公司生产)、非灭活型病毒保存管(由意大利COPAN 公司生产)。阳性质控品为广东省疾病预防控制中心提供的灭活型考核样本。
1.2 方法
1.2.1 模拟临床样本的制备、前处理和核酸提取将呼吸道病毒质控品(原始Ct 值约为21)10 倍稀释为5 个梯度,稀释基质分别为两种类型样本管的保存液(非灭活型病毒保存液和含有胍盐的灭活型病毒保存液)。分别取10-2、10-3、10-4稀释梯度的灭活型和非灭活型保存管模拟样本各5 管,在常温和56℃下于不同时间段进行存放和灭活前处理,其中1 管在室温下放置,另外4 管分别在56℃下处理30 min、40 min、50 min、60 min后取出。各取200 μL 样本应用预分装磁珠法核酸提取试剂盒进行RNA 提取。
1.2.2 实时荧光RT-PCR 检测 呼吸道病毒核酸检测体系总体积为25 μL,核酸模板加载量为5 μL。实时荧光PCR 反应程序设置:50 ℃逆转 录10 min ;95 ℃灭 活5 min ;95 ℃变 性10 s,55℃变性40 s(末端收集荧光),共45 个循环。ORF1ab 选择“FAM”通道,N 基因选择“VIC”通道,人源内参基因选择“ROX”通道。在阴性、阳性对照结果均成立的条件下进行结果判定,样本双靶标有“S”型扩增曲线则判定为阳性,调整阈值和基线并记录Ct 值。
1.3 统计学分析
应用SPSS18.0 软件分别对ORF1ab、N 基因Ct 值进行配对t检验,比较两种病毒保存液在常温和56℃下经不同时间的灭活前处理后对呼吸道病毒荧光PCR 检测结果Ct 值的影响。
2 结果
2.1 两种病毒保存液及经56℃灭活前处理对呼吸道病毒实时荧光RT-PCR 检测结果的影响
两种病毒保存液(非灭活型病毒保存液和含有胍盐的灭活型病毒保存液)模拟样本在56℃下进行不同时间的灭活前处理,以常温组为对照,结果显示10-2、10-3、10-4 稀释梯度灭活型保存液模拟样本的ORF1ab/N 双靶基因均扩增阳性,呈“S”型曲线,各稀释度ORF1ab 靶基因的平均Ct 值依次为26.95、30.56、33.70 ;N 靶基因的平均Ct 值依次为28.80、32.26、35.50。非灭活型保存液的模拟样本10-2、10-3、10-4 稀释梯度ORF1ab 靶基因均扩增阳性,呈“S”型曲线,平均Ct 值依次为28.64、32.21、36.39 ;非灭活型保存液的模拟样本10-2、10-3 稀释梯度N 基因均全部扩增,10-4 稀释梯度在常温和56℃、50 min处理的平行样中有一个无扩增,N 靶基因的平均Ct 值依次为30.13、33.31、36.48。从扩增图效果来看,灭活型保存液样本比非灭活型保存液的Ct 靠前,相对荧光强度也较高。详见图1、图2。
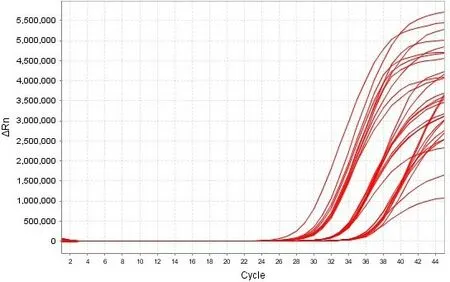
图1A 10-2、10-3、10-4 稀释度灭活型保存液模拟样本核酸检测N 基因扩增结果

图1B 10-2、10-3、10-4 稀释度非灭活型保存液模拟样本核酸检测N 基因扩增结果
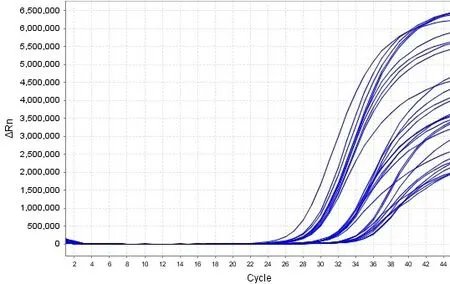
图2C 10-2、10-3、10-4 稀释度灭活型保存液模拟样本核酸检测ORF1ab 基因扩增结果
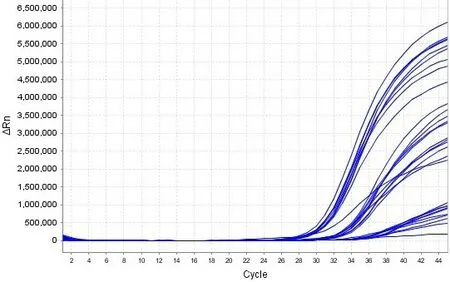
图2D 10-2、10-3、10-4 稀释度非灭活型保存液模拟样本核酸检测ORF1ab 基因扩增结果
2.2 统计学分析结果
采用配对样本t检验判断两种类型的病毒保存液对Ct 值的影响,结果显示两种病毒保存液经磁珠法提取核酸后,呼吸道病毒核酸检测Ct 值的配对t检验结果相比有统计学差异(P<0.05)。详见表1。采用随机区组设计方差分析判断两种类型的病毒保存液对常温、56℃灭活30 ~60 min前处理呼吸道病毒核酸检测组内Ct 值的影响,结果显示灭活时间对组内的Ct 值无影响(P>0.05)。详见表2。

表1 两种类型病毒保存液呼吸道病毒核酸检测组内Ct 值结果的配对t 检验
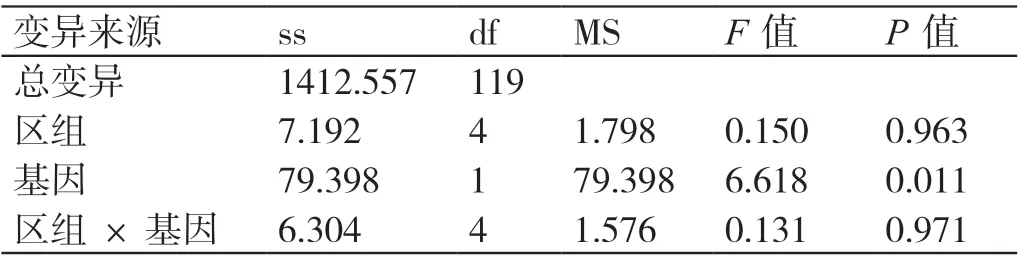
表2 两种类型病毒保存液对常温、56℃灭活30 ~60 min 前处理呼吸道病毒核酸检测组内Ct 值随机区组设计的方差分析
3 讨论
呼吸道病毒在全球范围内的流行形势严峻,国内外防控呼吸道病毒传播的效果有着较大的差别[3]。国内防控呼吸道病毒传播的经验是积极落实“五早”策略(包括防控疫情早报告、防控监督早到位、防护用品早准备、防控措施早落实、防控舆情早处置),通过核酸检测网络,在早期检测发现呼吸道病毒传染源后,立即进行隔离、流调、救治,严格控制传染源,切断病毒的传播途径[4-6]。核酸检测在呼吸道病毒防控工作中的作用重大,且对检测结果质量的要求较高。影响核酸检测结果质量的因素主要有采样因素、样本保存因素、提取效果因素、扩增试剂质量准确度和稳定性因素及病毒株变异因素等。在技术环节,由于rRTPCR 技术较为成熟、适配的荧光PCR 仪较为普及且性能稳定可靠,因此该技术成为目前呼吸道病毒检测中应用最为广泛的技术[7]。呼吸道病毒可通过飞沫传播、直接接触传播及密闭空间内气溶胶传播等,其传染性和传播力较强[8]。研究指出,在对呼吸道病毒进行检测时,为了降低检测人员感染的发生风险,应选择使用含胍盐灭活剂保存液的采样管保存样本[9]。对于实验室来说,样本保存及前处理因素是可控的,但需要评估使用灭活型保存管是否会对荧光PCR 检测结果造成影响。本研究中对三个稀释度的非灭活型和灭活型模拟样本进行检测的结果显示,灭活型保存管内的样本比非灭活型保存管内的样本扩增效果更好,Ct 值更靠前,扩增曲线更高,体现出更好的线性。特别是对于低浓度的样本,采用灭活型保存管保存后检测的效果更好。究其原因可能是,灭活型保存管中含有的胍盐(如异硫氰酸胍)可灭活RNA 酶,使核酸分解减少,增强裂解液对病毒的裂解效果[9-10]。对呼吸道病毒感染患者进行采样的过程中,患者受到刺激后出现的喷溅反应可增加外在污染的发生风险,若消毒不规范,可给保存管外表面、保存袋表面等带来潜在的安全隐患。实验室收到样本后进行灭活前处理,可消灭包装袋及保存管外表面的病毒,降低检测人员感染的发生风险。本研究中三个稀释度模拟灭活型样本在56℃下经30 min、40 min、50 min、60 min 的处理与常温下处理的结果相比,差异无统计学意义(P>0.05)。这说明在56℃下进行灭活前处理对于RNA 的降解不会产生影响。究其原因可能是胍盐能将RNA 酶灭活,增强了核酸保存的稳定性。由此可见,在56℃下进行灭活前处理可有效降低呼吸道病毒的传染性,且对检测结果无影响[11]。
综上所述,含胍盐的灭活型病毒保存液可提高经磁珠法提取的呼吸道病毒荧光PCR 检测结果的灵敏度,56℃灭活前处理30 ~60 min 未对经磁珠法提取的呼吸道病毒荧光PCR 检测结果产生影响。

