蛋氨酸羟基异丙酯对母犊牛瘤胃发酵和微生物区系的影响
孔凡林,李媛,付彤,刁其玉,屠焰
蛋氨酸羟基异丙酯对母犊牛瘤胃发酵和微生物区系的影响

1中国农业科学院饲料研究所/奶牛营养学北京市重点实验室,北京 100081;2河南农业大学牧医工程学院,郑州 450000
【】蛋氨酸羟基异丙酯(HMBi)作为饲料添加剂广泛用于补充反刍动物日粮中缺乏的蛋氨酸(Met),尽管HMBi拥有过瘤胃特性,但仍有部分在瘤胃中降解。研究拟探究HMBi对犊牛瘤胃发酵和微生物区系的影响。选取36头体重在(101±10)kg的84日龄断奶后荷斯坦母犊牛并随机分为两个处理组,分别为对照组(PC,0.40%Met)和蛋氨酸扣除组(PCMet,0.28%Met),通过减少PCMet组日粮中HMBi的添加使Met含量较PC组少30%。试验期97 d,其中预饲期7 d,正式试验期90 d。于试验0、90 d测定犊牛体重,正试期每天记录采食量,在试验90 d收集血清样品和瘤胃液样品用于发酵参数和微生物区系的测定。(1)与PC组相比,PCMet组犊牛生长性能无显著差异(>0.05),血清Met含量有降低的趋势(0.05<<0.10);(2)PCMet组瘤胃乙酸摩尔百分比和微生物蛋白浓度与PC组相比显著降低(<0.05),但两组间氨态氮和总挥发性脂肪酸浓度无显著差异(>0.05);(3)与PC组相比,PCMet组微生物菌群的Shannon指数显著降低(<0.05),PCoA和PREANOVA分析显示两组间显著分离(<0.05)。PCMet组的后壁菌门(Firmicutes)相对丰度显著降低(<0.05),而拟杆菌门(Bacteroidetes)相对丰度显著升高(<0.05)。属水平上,PCMet组莱克氏菌属()、瘤胃球菌属(group)、聚乙酸菌属()、真杆菌属(group)和粪球菌属()的相对丰度显著降低。相关性分析揭示聚乙酸菌属和真杆菌属与乙酸摩尔百分比之间呈正相关关系,瘤胃球菌属与微生物蛋白浓度间呈正相关关系(<0.05,>0.7)。研究说明扣除日粮中HMBi后犊牛瘤胃微生物多样性降低,微生物蛋白合成减少,其中,产乙酸菌属对HMBi扣除敏感,降低了乙酸的产生。总之,HMBi尽管作为过瘤胃产品,瘤胃中被降解部分仍对瘤胃发酵有调控作用。
蛋氨酸羟基异丙酯;母犊牛;微生物区系;瘤胃发酵参数
0 引言
【研究意义】蛋氨酸(Met)是后备牛营养研究的重点之一,其重要性在于Met作为一种限制性氨基酸,一旦供给不足将严重限制后备牛的生长和发育[1-2],进而使得泌乳阶段无法发挥应有的遗传潜力[3]。为解决日粮中Met供应不足这一问题,在后备牛日粮中添加Met添加剂已成为解决该问题的手段之一[2]。但由于后备牛在断奶前后采食固体饲料[4],导致瘤胃快速发育,瘤胃微生物区系定植,发酵功能趋于完善[5],所以在断奶后应使用过瘤胃蛋氨酸来增加达到小肠的Met数量,防止瘤胃中微生物对Met的降解。蛋氨酸羟基异丙酯(HMBi)作为Met的化学衍生物已被证明有着良好的过瘤胃特性和实践效果[6-7],Met有效性达48%[8],但研究表明仍有25%—50%的HMBi在瘤胃中被微生物降解[9-10],所以HMBi即是过瘤胃添加剂,也有潜力成为瘤胃调控剂。【前人研究进展】前人研究表明干奶牛日粮中添加HMBi可增加瘤胃中产琥珀酸丝状杆菌和黄色瘤胃球菌的数量以及总挥发性脂肪酸(TVFA)浓度,证明HMBi可促进瘤胃发酵[11];周帅等[12]通过体外发酵试验同样发现HMBi添加可改善瘤胃发酵,增加乙酸、丁酸和TVFA浓度。体外发酵试验同样发现HMBi添加可增加细菌中氮沉积,但乙酸的含量减少,说明HMBi可促进MCP的合成[13]。【本研究切入点】因此,目前HMBi仅在干奶牛和体外试验中对瘤胃发酵产生效果,且效果不一。而荷斯坦犊牛在断奶后处于瘤胃发育和调控的窗口期,日粮成为调控瘤胃发育和发酵的重要手段,但目前仍缺乏HMBi对该阶段犊牛的瘤胃发酵和微生物区系影响的结果。【拟解决的关键问题】基于此,本研究以断奶后荷斯坦母犊牛为对象,系统研究了HMBi对瘤胃发酵和微生物区系的影响,以期明确HMBi的饲喂效果和功能,为HMBi在生产中的应用提供支撑。
1 材料与方法
1.1 试验动物与设计
试验于2018年3月在山东省银香伟业第三牧场进行,选取36头平均日龄为84日龄、体重为(101.2±10.8)kg的中国荷斯坦母犊牛,根据日龄和体重相近的原则随机分到两个处理组,每组18头牛,分别为对照组(PC)和蛋氨酸扣除组(PCMet)。其中,PC组日粮中蛋氨酸的水平根据ZINN等[14]提出Met预测公式(METR=1.956+0.0292ADG[268-(29.4 ×0.0557BW0.75ADG1.097)/ADG]+0.112BW0.75)计算得出,赖氨酸(Lys)水平则是根据本团队云强[15]得到的断奶后犊牛适宜赖蛋比为3﹕1添加,基础日粮不足部分通过添加HMBi和过瘤胃赖氨酸补充。PCMet组的Met含量则是在PC组基础上扣除30%。随着母犊牛的生长,每30d根据体重(BW)和日增重(ADG)重新计算HMBi添加量。
1.2 试验日粮
根据NRC(2001)[16]中150 kg生长母牛ADG为1 kg·d-1的营养需要配制基础日粮。因此,两组基础日粮的组成和营养成分均一致,差别仅存在于HMBi的添加量不同,最终结果使得PCMet组日粮中Met含量为PC组的70%。基础日粮组成见表1,两组日粮中过瘤胃氨基酸的添加量和最终日粮中氨基酸的含量见表2。
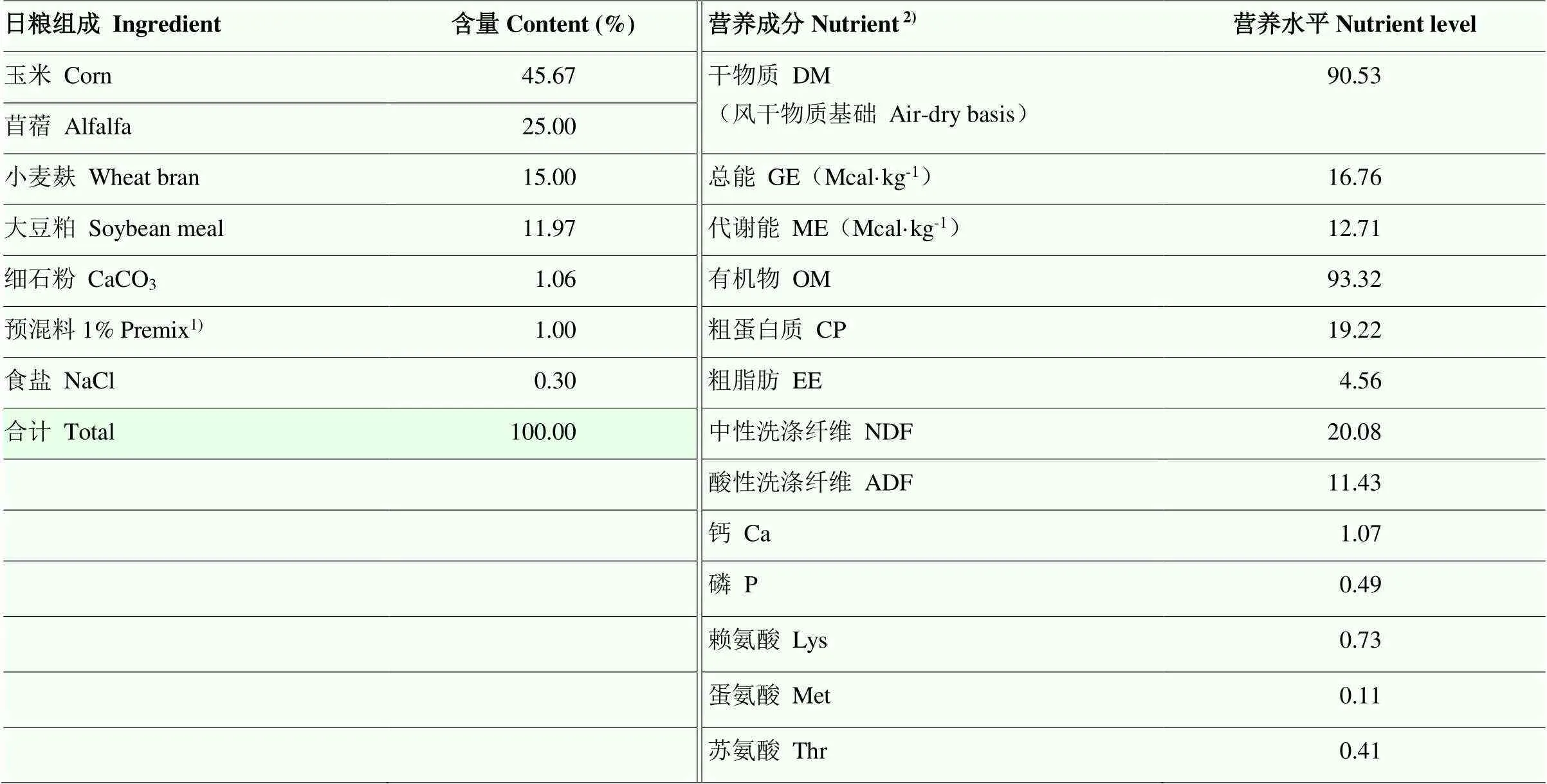
表1 基础饲粮组成及营养水平(干物质基础)
1)预混料为每千克基础日粮提供 The premix provided per kg of the basal diet: VA, 15000 IU; VD, 5000IU; VE, 50 mg; Fe, 90 mg; Cu, 12.5 mg; Mn, 30 mg; Zn, 90 mg; Se, 0.3 mg; I, 1.0 mg; Co, 0.3 mg
2)营养水平除代谢能外均为实测值,代谢能按照甲烷能占总能的6.5%计算[10]ME was a calculated value and others were measured values. Metabolic energy is calculated on the basis that methane energy accounts for 6.5% of total energy

表2 饲粮中过瘤胃氨基酸的添加量及氨基酸水平(干物质基础)
1)过瘤胃赖氨酸产品由北京亚禾营养高新技术有限责任公司提供,Lys含量为36%,过瘤胃率为80% Ruminal bypass Lys purchased by Yahe Nutrition Co., (36% content and 80% bypass rate)
2)过瘤胃蛋氨酸产品由安迪苏生命科学制品有限公司提供,Met含量为44%,过瘤胃率为50% Ruminal bypass Met purchased by Adisseo Co., (44.4% content, 50% bypass rate)
1.3 饲养管理
母犊牛单笼单饲,每天日粮干物质的饲喂量为犊牛体重的3%,每天饲喂3次,分别在早晨8点、下午2点及晚上8点饲喂,饲喂量随着犊牛体重的增长及时调整,试验全期自由饮水。预饲期7 d,正式试验期90 d。
1.4 样品采集与测定指标
试验过程中采集有代表性的日粮,用于检测常规营养成分。其中,Lys和Met含量采用日立L-8900氨基酸自动分析仪测定。
试验全期每天记录每头牛的投料量和剩料量用于计算干物质采食量(DMI);在试验始末测定BW用于计算ADG,进一步计算饲料转化比。
在正式试验期第90天,每组选取5头体况健康、体重接近每组平均体重的母犊牛用于血液和瘤胃液的采集。其中,在晨饲前静脉采集血液,随后倾斜放置至析出血清后,3 000 r/min离心10 min,收集血清于2 mL离心管中用于Met含量的测定,Met测定采用日立L-8900氨基酸自动分析仪。
于晨饲后2 h使用灭菌的口腔采样器收集瘤胃液,瘤胃液在装入15 mL离心管后立即使用便携式pH计(Testo-206-pH2)测定pH,随后液氮保存带回实验室用于后续瘤胃发酵参数的测定;剩余瘤胃液分装于2 mL冻存管中液氮保存并用于后续微生物区系的测定。对于挥发性脂肪酸的测定,将瘤胃液4 ℃解冻,加入0.2 mL配置好的浓度为2 g·L-1的含有内标物2-乙基丁酸的偏磷酸去蛋白溶液,混匀后冰浴30 min,随后10 000 r/min离心10 min并使用迈瑞MR-96A型酶标仪测定;瘤胃液中氨态氮浓度(NH3-N)使用苯酚比色法测定[17];微生物蛋白(MCP)含量的测定参照文献[18]方法进行。
1.5 DNA提取
将存放于冻存管中的瘤胃液在4 ℃解冻,使用E.Z.N.A.® Soil DNA试剂盒提取DNA,试剂盒购于Omega生物技术有限公司,具体步骤参照试剂盒说明书进行。用1%琼脂糖凝胶电泳和NanoDrop 2000原子分光光度计检测DNA。提取的DNA用于后续PCR扩增和高通量测序。
1.6 PCR扩增和DNA测序
用细菌引物对338F(5′-ACTCCTACGGGAGGCA GCAG-3′)和806R(5′-GGACTACHVGGGTWTCTA AT-3′),针对细菌16SrRNA基因的V3-V4区进行PCR扩增。PCR扩增体系为20 μL,包括5×Buffer 5.0 μL,dNTPs(2.5 mmol·L-1)2 μL,引物(5μmol·L-1)各0.8 μL,10 ng模板DNA,补充ddH2O至20 μL。PCR的反应条件:95 ℃进行3 min,95 ℃进行30 s,共27个循环,55℃进行30 s,72 ℃进行45 s,72 ℃进行10 min。
PCR产物用含溴化乙锭的2%的琼脂糖凝胶电泳鉴定,并用PCR纯化试剂盒纯化和回收。回收的PCR产物用AxyPrep DNA Gel试剂盒定量。送上海美吉生物医学科技有限公司,利用Illumina MiSeq测序平台构建文库及MiSeq测序。
1.7 数据分析
对生长性能、血清指标和瘤胃发酵参数使用SAS8.0软件的one-way ANOVA模型进行分析。差异显著(<0.05)时采用最小显著差数法进行比较,0.05<<0.1表示具有显著降低或升高的趋势。使用Graphpad Prism 7对数据进行可视化作图。
将获得的Fastq文件原始数据使用QIIME1.7.0软件对数据进行质控,去除掉平均碱基质量值小于Q20的序列,将含有模糊碱基的reads移除。最后根据相似性大于97%的标准,进一步使用QIIME软件对相似性大于97%的序列聚类为OUT(operational taxonomic units),将序列与基因数据库中的参考序列进行比对,用QIIME软件剔除嵌合体和Singletons,并使用RDP分类器对序列从门到属进行物种注释,置信阈值为0.7。α多样性指数使用MOTHUR软件计算得出[19];β多样性基于OTU水平使用加权的UniFrac距离算法计算,R语言中的GUniFrac和ape包将β多样性可视化为柱坐标分析图(Principal coordinate analysis,PCoA)[20],为检测两组间是否存在显著差异,使用非参数多变量方差分析(PREANOVA)对数据进行分析。使用R语言工具制作门水平组成柱形图,使用R的stats包和Python的scipy包寻找两组间差异菌属。16s rRNA基因预测功能(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States,PICRUSt)用于对微生物组成功能进行预测[21]。最后,对两组间显著差异菌属和表型变量使用SPSS 20.0进行斯皮尔曼相关性分析(Spearman’s test),以<0.05和相关性系数>0.7作为存在相关性的标准。
2 结果
2.1 部分扣除蛋氨酸对生长性能和血清蛋氨酸的影响
表3为日粮中扣除部分Met对母犊牛生长性能和血清Met浓度的影响。两组初始体重之间无显著差异(>0.05),结束体重、ADG、DMI和饲料转化比同样均无显著差异(>0.05)。与PC组相比,PCMet组的血清Met浓度具有降低的趋势(0.05<<0.1),相比下降18%。
2.2 部分扣除蛋氨酸对瘤胃发酵参数的影响
图1为日粮中部分扣除Met对母犊牛瘤胃发酵参数的影响。由图1可知,部分扣除Met对瘤胃中TVFA无显著影响(>0.05),但挥发酸成分中乙酸的摩尔百分比因Met扣除而显著降低(<0.05),丙酸、丁酸的摩尔百分比和乙丙比无显著差异(>0.05)。扣除Met同样对pH和NH3-N浓度无显著影响(>0.05),但MCP浓度显著降低(<0.05)。
2.3 微生物区系
2.3.1 α多样性 图2为部分扣除Met对母犊牛瘤胃微生物区系α多样性的影响,Chao-1和ACE指数用来形容物种丰富度,由图可知Met扣除对Chao-1指数、ACE指数无显著影响(>0.05)。Simpson指数和Shannon指数用来形容物种多样性,由图可知两组间Simpson指数无显著差异,与PC组相比,PCMet组的Shannon指数显著下降(<0.05)。
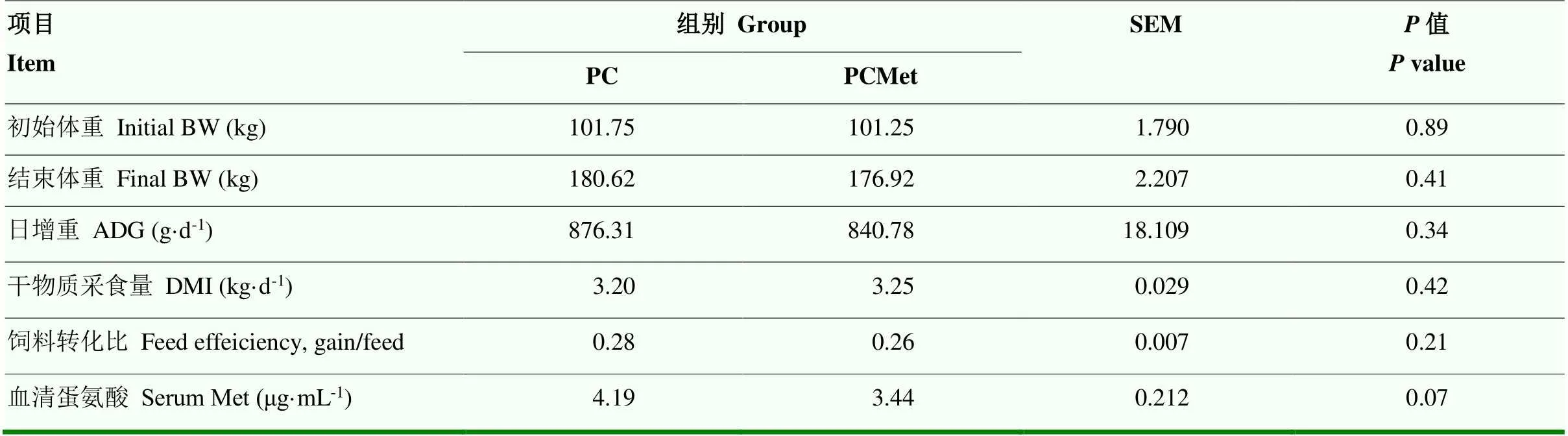
表3 部分扣除蛋氨酸对母犊牛生长性能和血清蛋氨酸水平的影响
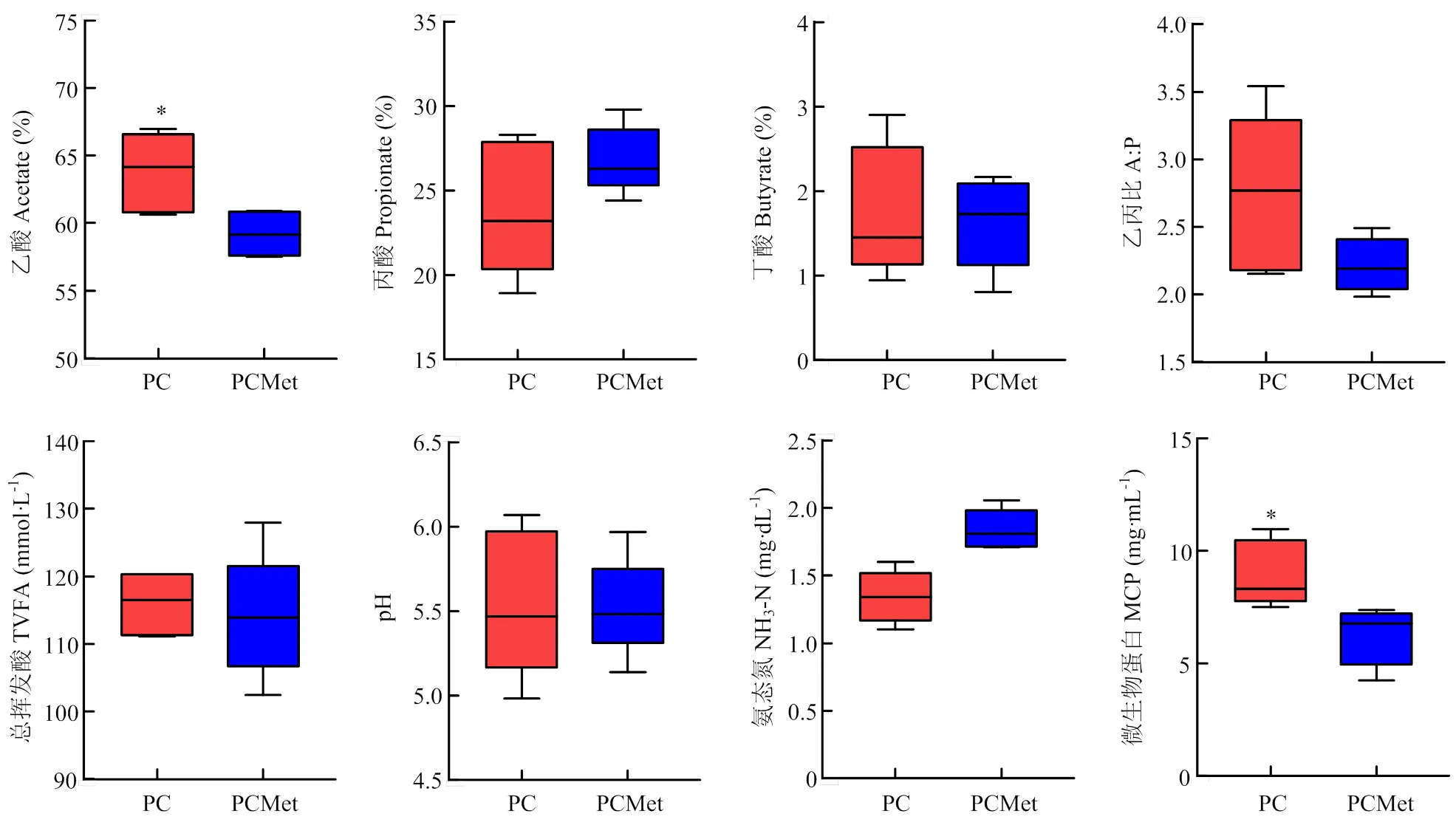
图1 部分扣除蛋氨酸对母犊牛瘤胃发酵参数的影响
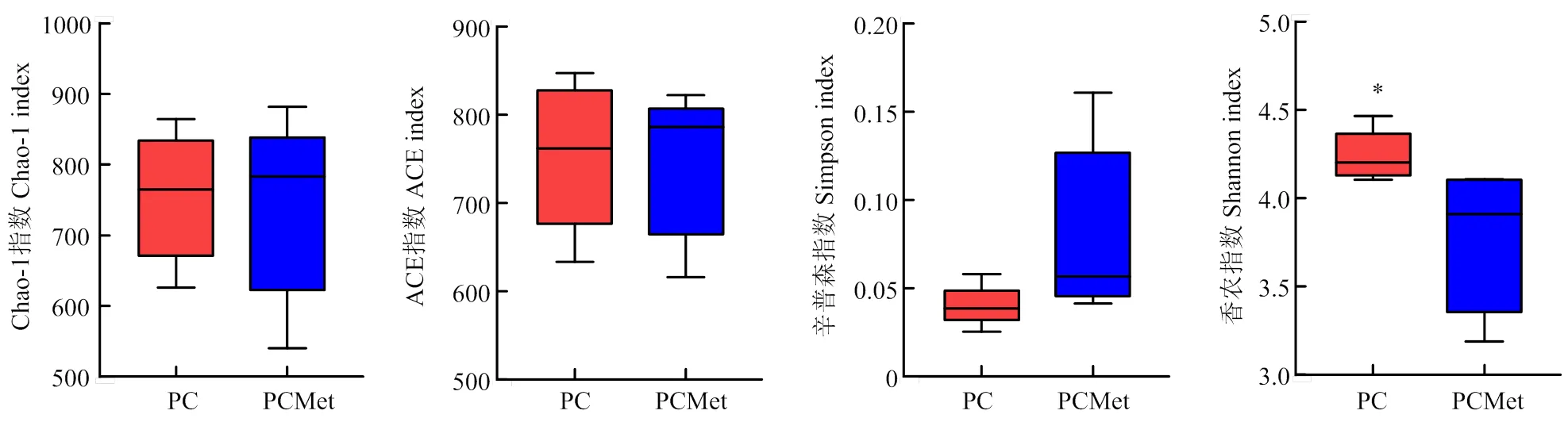
图2 组间α多样性指数的差异性比较
2.3.2 β多样性 由图3可知,两组样品依据所处组别并没有聚类到一起,存在明显的分离,说明组间相似性比组内相似性高,PERANOVA的结果也说明二组之间存在显著差异(<0.05)。
2.3.3 不同分类水平上的物种组成分析 由图4-a可知,两处理组的优势门(>1%)分别为后壁菌门(Firmicutes,48.56%)、拟杆菌门(Bacteroidetes,36.40%)、变形菌门(Proteobacteria,10.44%)和放线菌门(Actinobacteria,3.59%)。其中,在门水平上(图4-b),与PC组相比,PCMet组后壁菌门的相对丰度显著降低(<0.05),而拟杆菌门的相对丰度显著升高(<0.05)。进一步对相对丰度大于0.1%的菌属进行差异性分析(图4-c),结果表明,与PC组相比,属于后壁菌门的5个菌属的相对丰度在PCMet中显著降低(<0.05),分别为斯莱克氏菌属()、瘤胃球菌属(group)、聚乙酸菌属()、真杆菌属(group)和粪球菌属()。
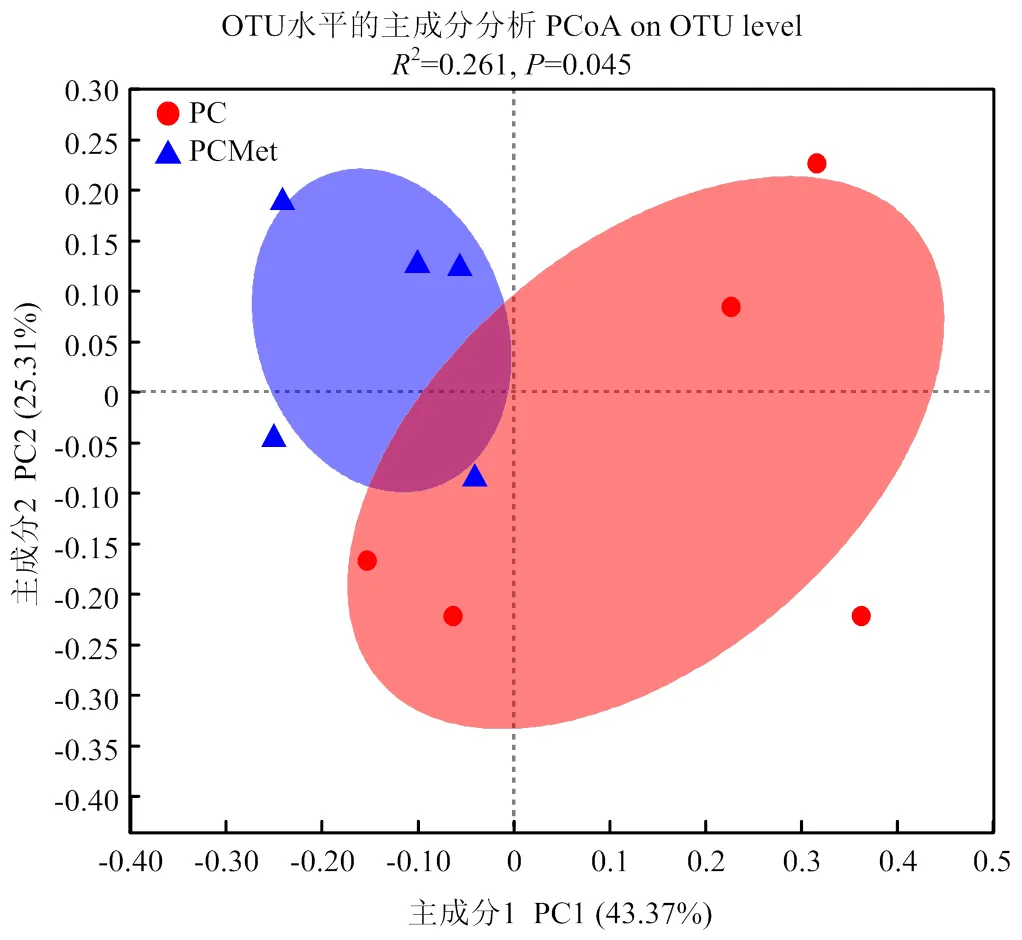
图3 Principal coordinate analysis聚类分析
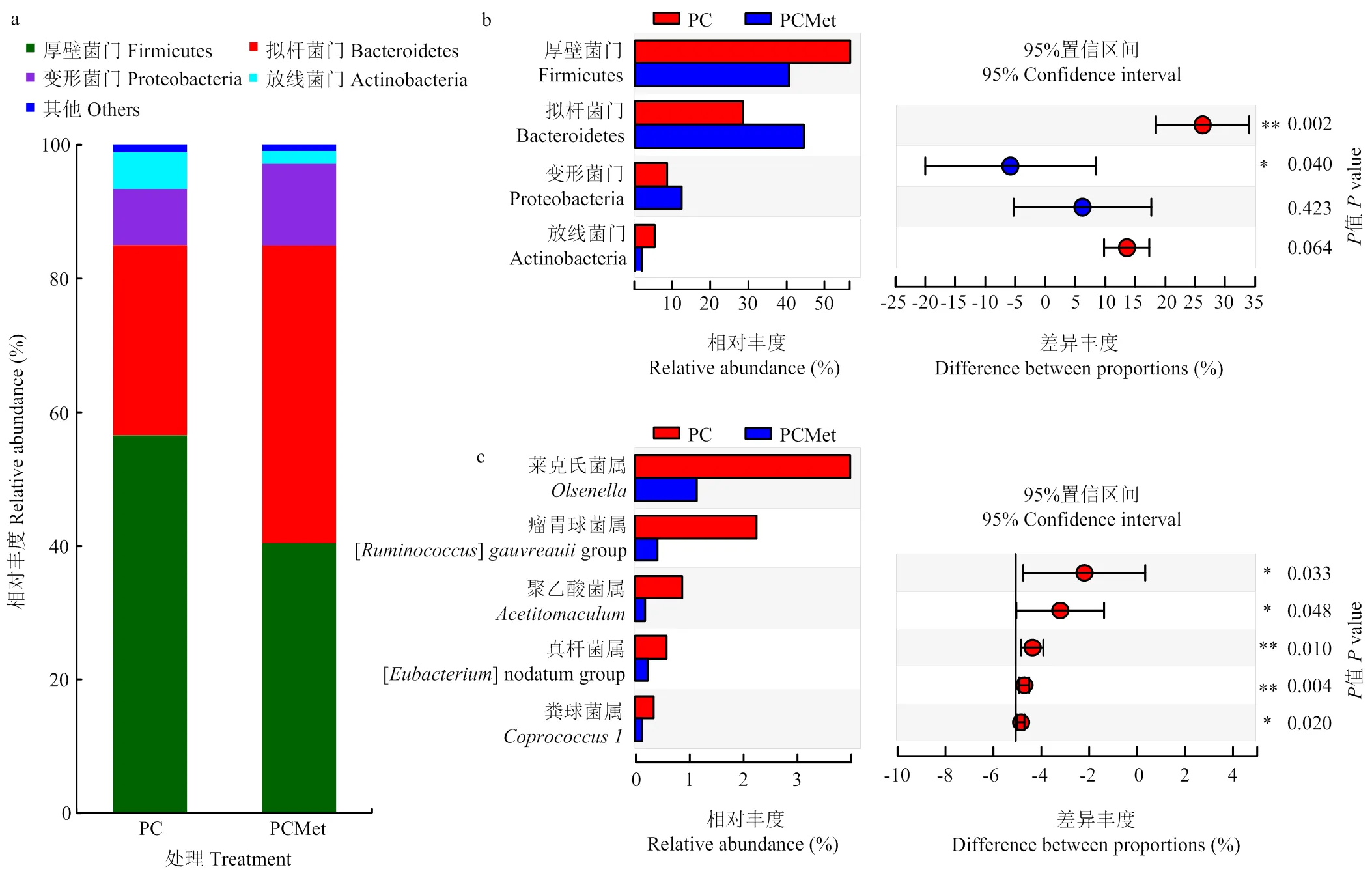
标星号表示不同处理中的相对丰度差异显著。*表示P<0.05,**表示P<0.01
2.3.4 功能预测分析 使用PICRUSt对细菌组成进行功能预测,结果显示相对丰度占比在前5的KEGG通路和与Met代谢有关的KEGG通路(表4)。结果显示两组之间相对丰度排名前5的通路无显著差异(>0.05),与Met代谢有关的通路也同样没有显著差异(>0.05)。
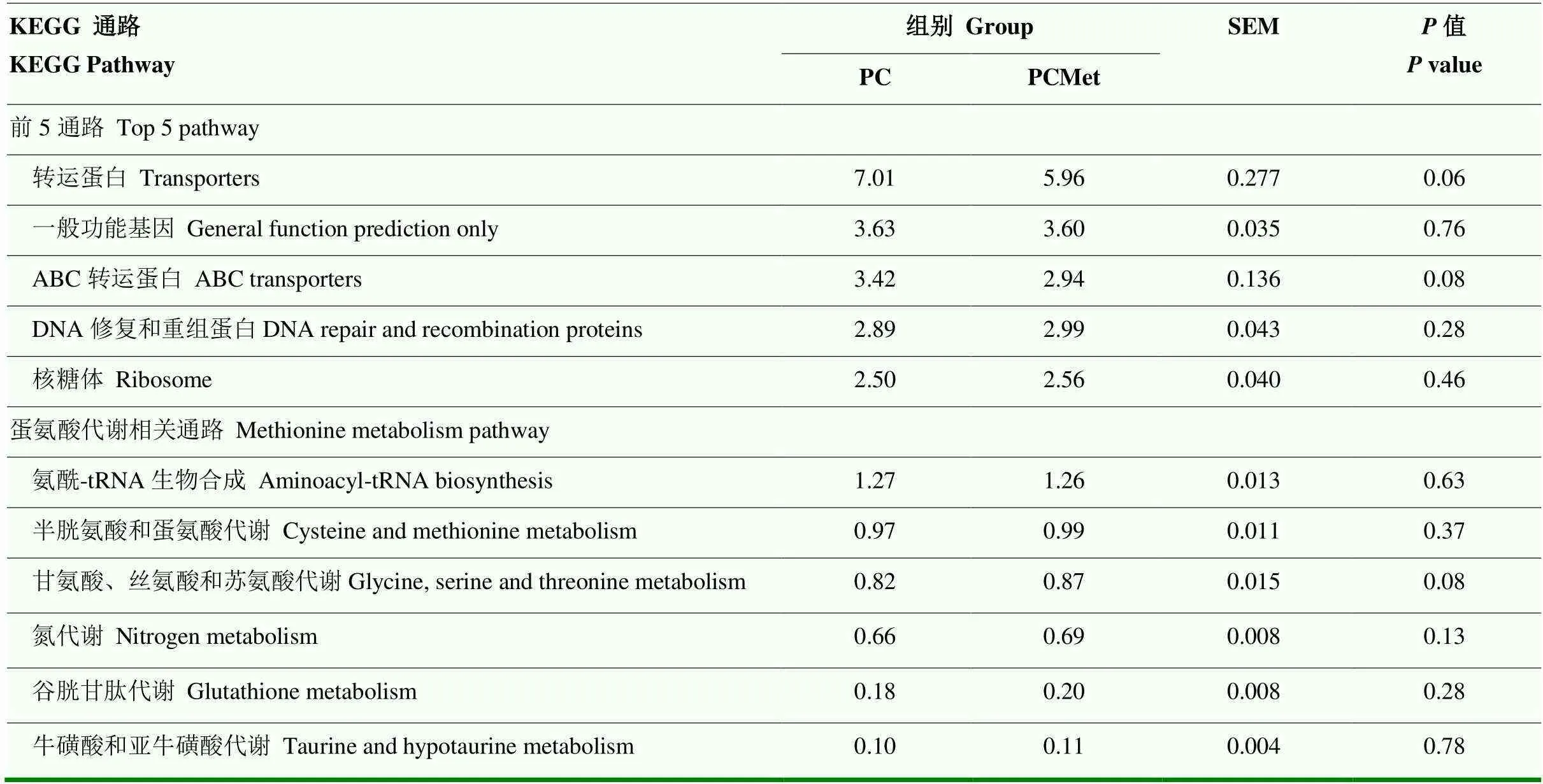
表4 蛋氨酸扣除对瘤胃微生物基因KEGG通路的影响
2.3.5 相关性分析 对两组间相对丰度出现显著差异的菌属与表型指标进行Spearman相关性分析,结果如图5所示,其中,、group和与乙酸的摩尔百分比之间存在正相关关系(<0.05,>0.7),group和与MCP之间存在正相关关系(<0.05,>0.7)。
3 讨论
3.1 部分扣除蛋氨酸对生长性能和血清蛋氨酸的影响
Met和Lys是荷斯坦后备牛的第一或第二限制性氨基酸[1, 22],研究表明Lys和Met添加对泌乳牛产奶量存在互作效应[23]。本研究根据本团队在该阶段犊牛上获得的日粮中适宜的Lys和Met比例添加过瘤胃赖氨酸[15],其目的在于防止Lys不足可能通过破坏日粮氨基酸平衡来影响试验结果。本研究结果表明扣除日粮中30%Met对3—6月龄母犊牛生长性能无影响,这与前人在生长母牛阶段获得的结果一致[22],但在断奶前犊牛的研究中表明扣除30%的Met显著降低犊牛BW和饲料转化比[24],这一方面与断奶后母牛瘤胃发育逐渐完善有关,瘤胃微生物利用NH3-N合成MCP能力逐渐增强,MCP中含有的Met可以部分弥补日粮中缺乏的Met[25];另一方面也与动物体内存在AA代谢池有关,由于包括新生犊牛在内的新生哺乳动物机体尚未发育完全,体蛋白动员分解从而补充氨基酸的能力不足,导致新生哺乳动物较其他生长阶段动物对氨基酸缺乏敏感[26]。
本研究中尽管Met扣除并未影响生长性能,但血清Met含量的降低说明日粮HMBi扣除经过瘤胃发酵、小肠吸收等消化、吸收和代谢过程后,最终使得到达血清中的Met降低,多项研究表明血清Met是评价日粮Met有效性的重要指标,随日粮中Met数量的增加而增加[8, 27]。因此,本研究结果表明日粮中Met扣除的处理效果由日粮差异反映在瘤胃发酵、小肠吸收等多个过程,直至血清Met浓度变化。
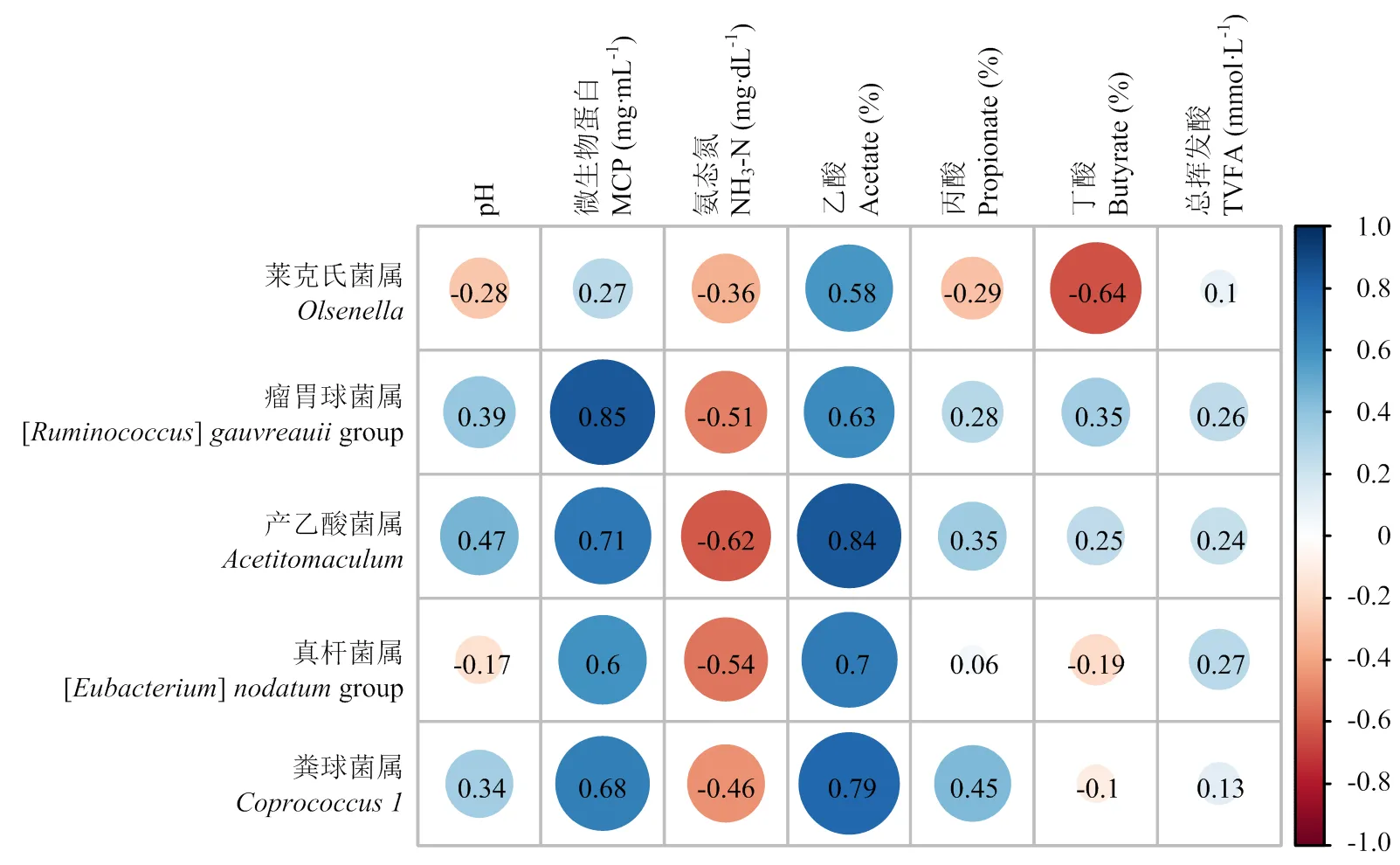
*标星号表示具有相关性(P<0.05,|r|>0.7),变量间相关性的强度由正方形的颜色深浅来表示,而正方形的颜色表示正相关关系(蓝)和负相关关系(红)
3.2 部分扣除蛋氨酸对瘤胃发酵参数的影响
本研究目的在于探究HMBi作为补充Met的外源添加剂对荷斯坦断奶后犊牛瘤胃发酵和微生物区系的影响。当日粮中的HMBi到达瘤胃后,约50%的HMBi被瘤胃壁快速吸收,然后脱去异丙醇转化为蛋氨酸羟基类似物(HMB),随后进入到外周血液中被吸收,剩余HMBi在瘤胃中被微生物降解为HMB和异丙酯[8,28],50%—90%的HMB在瘤胃中被降解用于合成MCP,另一部分进入小肠被吸收,所以HMBi在瘤胃中损失25%—50%[9-10]。对于降解的HMBi对瘤胃发酵的影响,在体外试验上的结果显示日粮中添加1%的HMBi可提高日粮产气量、乙酸和TVFA浓度[12],说明HMBi可以提高日粮在瘤胃中的消化率,但由于体外试验无法模拟瘤胃上皮吸收HMBi,所以与动物饲养试验结果相比,体外试验的剂量要远高于本试验的剂量,这可能会扩大HMBi的效果。另一体外试验脉冲供给日粮占比为0.11%的HMBi时发现乙酸、丙酸和TVFA浓度下降[13],而NH3-N转化成的MCP和小肽的比例增加,这可能与VFA为NH3-N转化为MCP提供能量有关。基于体外试验结果可以看出HMBi对瘤胃发酵存在促进效果,但是由于培养条件和添加量的不同导致试验结果不一,这也是开展该动物试验的原因。当日粮中AA达到瘤胃后即可以被微生物脱氨基生成NH3-N,也可以与NH3-N共同参与合成MCP[25],本研究发现NH3-N浓度因Met扣除而增加,而MCP合成降低,这与Met参与细菌转氨作用、减少饲料氨基酸脱氨作用有关[11, 13, 29]。另一方面,与未保护的Met相比,50%的HMBi虽被瘤胃上皮快速吸收,但瘤胃中剩余的HMBi可缓慢释放HMB,为瘤胃细菌合成MCP提供稳定的Met供应[30],本研究中Met扣除后合成MCP的原料减少,NH3-N无法参与MCP合成进而有所剩余。
3.3 微生物区系
瘤胃发酵参数是评价瘤胃发酵能力和日粮营养价值的重要指标,与瘤胃中微生物的组成有密切关系。有研究表明包被Met对围产期奶牛瘤胃中的主要细菌的生长无影响,包括产琥珀酸丝状杆菌和反刍兽新月形单胞菌等[31],但这可能与围产期奶牛特殊的生理状态以及脂肪包被Met在瘤胃中降解量较小的原因有关。当使用HMBi饲喂干奶期荷斯坦奶牛时发现产琥珀酸丝状杆菌和黄色瘤胃球菌在瘤胃中的浓度升高,瘤胃中纤维分解酶活性却并未增加[11],瘤胃菌群作为一个整体,该结果可能与瘤胃中其他微生物的活动改变有关,但仍能说明HMBi对瘤胃微生物具有调控作用。
本研究首次使用16s rRNA微生物测序技术对HMBi对瘤胃微生物区系的影响进行全面评价,MCP浓度和微生物区系α多样性的降低说明微生物生长受到抑制,原因在于微生物用于生长和合成MCP的原料因HMBi扣除而减少[25],这与前人获得的结论一致[32]。此外,泌乳牛日粮中添加0.1%的HMBi可提高观测到的OTU数量和Shannon指数,这与本研究的结果一致,且诱导泌乳牛乳脂含量下降的日粮中添加HMBi可减缓乳脂含量降低的程度,来自Firmicutes的菌属包括、、以及的相对丰度随HMBi的添加而降低,仅相对丰度随HMBi添加而增加[33],这些菌属的变化均与缓解乳脂降低相关,但这与本研究发现来自Firmicutes的菌属随HMBi供应降低而降低的结果相矛盾。这一方面与犊牛阶段和泌乳牛阶段的日粮组成和动物营养分配方式不同有关;其次,尽管HMBi对瘤胃中微生物区系的影响在不同生长阶段奶牛上表现不一,但均表现为促进奶牛生长和泌乳,在本研究中,是一种将碳水化合物发酵为乳酸的乳酸菌[34],在差异菌属中相对丰度最大,尽管本研究未测定日粮中碳水化合物的降解率,在瘘管母羊上的研究结果表明HMBi添加可提高日粮在瘤胃中的有机物降解率[30],另一项研究表明相对丰度在瘤胃酸中毒的情况下增加[35]。因此,结合本研究结果说明Met可通过调控瘤胃中的碳水化合物分解菌来影响瘤胃发酵能力。LEE等[35]饲喂荷斯坦奶牛HMBi后发现粪球菌属()和出现显著变化,其认为瘤胃微生物比例的变化是导致瘤胃微生物氮沉积增加的原因,这与本研究结果一致。此外,有研究表明扣除过瘤胃Lys后断奶后犊牛瘤胃中group和的相对丰度降低[36],本研究扣除Met同样使得二者相对丰度降低,二者连同均被认为是产乙酸菌,这也是差异菌属与乙酸具有相关性的原因之一,也说明瘤胃中存在部分菌属对日粮中AA的变化非常敏感,Lys更多是影响产丁酸菌[37],而本研究说明Met扣除降低产乙酸菌相对丰度。尽管Met扣除后瘤胃菌群发生改变,但微生物功能并未发生显著变化,包括Met相关代谢通路和氮代谢通路。Met扣除后微生物生长虽受到抑制,但微生物菌群作为一个相互掣肘和稳定的生态系统,总数的减少并没有改变微生物菌群整体的功能,此外,对于微生物功能的精准预测还需要技术的进一步更新[31]。总之,本研究认为HMBi在瘤胃中调控多个产乙酸菌属的生长和MCP的产量。
4 结论
本研究以3—6月龄的断奶后荷斯坦母犊牛为对象,探究部分扣除HMBi形式的Met对瘤胃发酵参数和微生物区系的影响。结果表明扣除30%的Met不影响母犊牛生长性能,但使得瘤胃微生物区系和发酵模式改变,瘤胃中乙酸和MCP的变化与微生物组成的变化紧密相关,HMBi扣除后抑制瘤胃中属于Firmicutes的多个菌属的生长,包括group和等产乙酸菌属。本研究说明HMBi尽管是过瘤胃氨基酸,但仍然对瘤胃代谢具有调控作用,在使用HMBi时需同样关注其对瘤胃的影响。未来可通过同位素标记技术来进一步明确HMBi在瘤胃中的代谢途径。
[1] WANG J H, DIAO Q Y, TU Y, ZHANG N F, XU X C. The limiting sequence and proper ratio of lysine, methionine and threonine for calves fed milk replacers containing soy protein. Asian-Australasian Journal of Animal Sciences, 2012, 25(2): 224-233. doi:10.5713/ ajas.2011.11190.
[2] 孔凡林, 李媛, 唐梦琪, 马满鹏, 付彤, 刁其玉, 成思源, 屠焰. 氨基酸缺乏对母犊牛生长和日粮养分消化代谢的影响. 中国农业科学, 2020, 53(2): 418-430. doi: 10.3864/j.issn.0578-1752.2020.02.016.
KONG F L, LI Y, TANG M Q, MA M P, FU T, DIAO Q Y, CHENG S Y, TU Y. Effects of amino acid deficiency on growth development, dietary nutrients digestion and metabolism in heifers. Scientia Agricultura Sinica, 2020, 53(2): 418-430. doi: 10.3864/j.issn.0578- 1752.2020.02.016. (in Chinese)
[3] SOBERON F, RAFFRENATO E, EVERETT R W, VAN AMBURGH M E. Preweaning milk replacer intake and effects on long-term productivity of dairy calves. Journal of Dairy Science, 2012, 95(2): 783-793. doi:10.3168/jds.2011-4391.
[4] 任春燕, 毕研亮, 郭艳丽, 杜汉昌, 于博, 屠焰, 刁其玉. 开食料中性洗涤纤维水平对犊牛生长性能、血清生化指标和抗氧化功能的影响. 中国农业科学, 2020, 53(2): 440-450. doi:10.3864/j.issn.0578- 1752.2020.02.018.
REN C Y, BI Y L, GUO Y L, DU H C, YU B, TU Y, DIAO Q Y. Effects of NDF level of starter on growth performance, serum biochemical parameters and antioxidant indices in calves. Scientia Agricultura Sinica, 2020, 53(2): 440-450. doi:10.3864/j.issn.0578- 1752.2020.02.018. (in Chinese)
[5] KERTZ A F, HILL T M, QUIGLEY J D 3rd, HEINRICHS A J, LINN J G, DRACKLEY J K. A 100-Year Review: calf nutrition and management. Journal of Dairy Science, 2017, 100(12): 10151-10172. doi:10.3168/jds.2017-13062.
[6] WHELAN S J, MULLIGAN F J, FLYNN B, MCCARNEY C, PIERCE K M. Effect of forage source and a supplementary methionine hydroxy analog on nitrogen balance in lactating dairy cows offered a low crude protein diet. Journal of Dairy Science, 2011, 94(10): 5080-5089. doi:10.3168/jds.2011-4174.
[7] ORDWAY R S, BOUCHER S E, WHITEHOUSE N L, SCHWAB C G, SLOAN B K. Effects of providing two forms of supplemental methionine to periparturient Holstein dairy cows on feed intake and lactational performance. Journal of Dairy Science, 2009, 92(10): 5154-5166. doi:10.3168/jds.2009-2259.
[8] GRAULET B, RICHARD C, ROBERT J C. Methionine availability in plasma of dairy cows supplemented with methionine hydroxy analog isopropyl ester. Journal of Dairy Science, 2005, 88(10): 3640-3649. doi:10.3168/jds.S0022-0302(05)73049-6.
[9] KOENIG K M, RODE L M, KNIGHT C D, MCCULLOUGH P R. Ruminal escape, gastrointestinal absorption, and response of serum methionine to supplementation of liquid methionine hydroxy analog in dairy cows. Journal of Dairy Science, 1999, 82(2): 355-361. doi:10.3168/jds.S0022-0302(99)75242-2.
[10] NOFTSGER S, ST-PIERRE N R, SYLVESTER J T. Determination of rumen degradability and ruminal effects of three sources of methionine in lactating cows. Journal of Dairy Science, 2005, 88(1): 223-237. doi:10.3168/jds.S0022-0302(05)72680-1.
[11] MARTIN C, MIRANDE C, MORGAVI D P, FORANO E, DEVILLARD E, MOSONI P. Methionine analogues HMB and HMBi increase the abundance of cellulolytic bacterial representatives in the rumen of cattle with no direct effects on fibre degradation. Animal Feed Science and Technology, 2013, 182(1/2/3/4): 16-24. doi:10.1016/ j.anifeedsci.2013.03.008.
[12] 周帅, 韩兆玉, 刘军彪, 王群, 唐波. 蛋氨酸羟基类似物异丙酯对瘤胃体外发酵参数的影响. 动物营养学报, 2012, 24(6): 1105-1109. doi:10.3969/j.issn.1006-267x.2012.06.016.
ZHOU S, HAN Z Y, LIU J B, WANG Q, TANG B. Influence of 2-hydroxy-4-(methylthio)butanoic acid isopropyl ester on rumen fermentation parameters. Acta Zoonutrimenta Sinica, 2012, 24(6): 1105-1109. doi:10.3969/j.issn.1006-267x.2012.06.016. (in Chinese)
[13] FOWLER C M, PLANK J E, DEVILLARD E, BEQUETTE B J, FIRKINS J L. Assessing the ruminal action of the isopropyl ester of 2-hydroxy-4-(methylthio) butanoic acid in continuous and batch cultures of mixed ruminal microbes. Journal of Dairy Science, 2015, 98(2): 1167-1177. doi:10.3168/jds.2014-8692.
[14] ZINN R A, SHEN Y. An evaluation of ruminally degradable intake protein and metabolizable amino acid requirements of feedlot calves. Journal of Animal Science, 1998, 76(5): 1280-1289. doi:10.2527/ 1998.7651280x.
[15] 云强. 蛋白水平及Lys/Met对断奶犊牛生长、消化代谢及瘤胃发育的影响[D]. 北京: 中国农业科学院, 2010.
YUN Q. Effects of protein level and Lys/met on performance, nutrient digestibility and rumen development for weaned calves[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010. (in Chinese)
[16] NATION RESEARCH COUNCIL. Requirements of Dairy Cattle. 7th revised. W. Washington, D.C.: National Academies Press, 2021. doi:10.17226/25806.
[17] VERDOUW H, VAN ECHTELD C J A, DEKKERS E M J. Ammonia determination based on indophenol formation with sodium salicylate. Water Research, 1978, 12(6): 399-402. doi:10.1016/0043-1354(78) 90107-0.
[18] 王洪荣, 陈旭伟, 王梦芝. 茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响. 中国农业科学, 2011, 44(8): 1710-1719.
WANG H R, CHEN X W, WANG M Z. Effect ofsaponin and tea saponin mixture on the rumen fermentation and its fibrolytic bacterial activity in the rusitec substrates with different concentrate to forage ratio. Scientia Agricultura Sinica, 2011, 44(8): 1710-1719. (in Chinese)
[19] SCHLOSS P D, WESTCOTT S L, RYABIN T, HALL J R, HARTMANN M, HOLLISTER E B, LESNIEWSKI R A, OAKLEY B B, PARKS D H, ROBINSON C J, SAHL J W, STRES B, THALLINGER G G, VAN HORN D J, WEBER C F. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. doi:10.1128/AEM.01541-09.
[20] CHEN J, BITTINGER K, CHARLSON E S, HOFFMANN C, LEWIS J, WU G D, COLLMAN R G, BUSHMAN F D, LI H Z. Associating microbiome composition with environmental covariates using generalized UniFrac distances. Bioinformatics, 2012, 28(16): 2106-2113. doi:10.1093/bioinformatics/bts342.
[21] LANGILLE M G I, ZANEVELD J, CAPORASO J G, MCDONALD D, KNIGHTS D, REYES J A, CLEMENTE J C, BURKEPILE D E, VEGA THURBER R L, KNIGHT R, BEIKO R G, HUTTENHOWER C. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology, 2013, 31(9): 814-821. doi:10.1038/nbt.2676.
[22] LI Y, BI Y L, DIAO Q Y, PIAO M Y, WANG B, KONG F L, HU F M, TANG M Q, SUN Y, TU Y. The limiting sequence and appropriate amino acid ratio of lysine, methionine, and threonine for seven-to nine-month-old Holstein heifers fed corn-soybean M-based diet. Animals: an Open Access Journal from MDPI, 2019, 9(10): 750. doi:10.3390/ani9100750.
[23] WANG C, LIU H Y, WANG Y M, YANG Z Q, LIU J X, WU Y M, YAN T, YE H W. Effects of dietary supplementation of methionine and lysine on milk production and nitrogen utilization in dairy cows. Journal of Dairy Science, 2010, 93(8): 3661-3670. doi:10.3168/jds. 2009-2750.
[24] 王建红, 刁其玉, 许先查, 屠焰, 张乃锋, 云强. 日粮Lys、Met和Thr添加模式对0-2月龄犊牛生长性能、消化代谢与血清学生化指标的影响. 中国农业科学, 2011, 44(9): 1898-1907. doi:10.3864/j. issn.0578-1752.2011.09.017.
WANG J H, DIAO Q Y, XU X C, TU Y, ZHANG N F, YUN Q. Effects of dietary addition pattern of lysine, methionine and threonine in the diet on growth performance, nutrient digestion and metabolism, and serum biochemical parameters in calves at the ages of 0-2 months. Scientia Agricultura Sinica, 2011, 44(9): 1898-1907. doi:10.3864/j. issn.0578-1752.2011.09.017. (in Chinese)
[25] SOK M, OUELLET D R, FIRKINS J L, PELLERIN D, LAPIERRE H. Amino acid composition of rumen bacteria and protozoa in cattle. Journal of Dairy Science, 2017, 100(7): 5241-5249. doi:10.3168/jds. 2016-12447.
[26] BERGEN W G. Measuringintracellular protein degradation rates in animal systems. Journal of Animal Science, 2008, 86(suppl_ 14): E3-E12. doi:10.2527/jas.2007-0430.
[27] KOENIG K M, RODE L M. Ruminal degradability, intestinal disappearance, and plasma methionine response of rumen-protected methionine in dairy cows. Journal of Dairy Science, 2001, 84(6): 1480-1487. doi:10.3168/jds.S0022-0302(01)70181-6.
[28] BREVES G, SCHRÖDER B, HEIMBECK W, PATTON R A. Short communication: transport of 2-hydroxy-4-methyl-thio-butanoic isopropyl ester by rumen epithelium. Journal of Dairy Science, 2010, 93(1): 260-264. doi:10.3168/jds.2009-2200.
[29] OR-RASHID M M, ONODERA R, WADUD S. Biosynthesis of methionine from homocysteine, cystathionine and homoserine plus cysteine by mixed rumen microorganisms. Applied Microbiology and Biotechnology, 2001, 55(6): 758-764. doi:10.1007/ s002530100548.
[30] BAGHBANZADEH-NOBARI B, TAGHIZADEH A, KHORVASH M, PARNIAN-KHAJEHDIZAJ F, MALONEY S K, HASHEMZADEH- CIGARI F, GHAFFARI A H. Digestibility, ruminal fermentation, blood metabolites and antioxidant status in ewes supplemented with DL-methionine or hydroxy-4 (methylthio) butanoic acid isopropyl ester. Journal of Animal Physiology and Animal Nutrition, 2017, 101(5): e266-e277. doi:10.1111/jpn.12600.
[31] ABDELMEGEID M K, ELOLIMY A A, ZHOU Z, LOPREIATO V, MCCANN J C, LOOR J J. Rumen-protected methionine during the peripartal period in dairy cows and its effects on abundance of major species of ruminal bacteria. Journal of Animal Science and Biotechnology, 2018, 9: 17. doi:10.1186/s40104-018-0230-8.
[32] 林奕, 王之盛, 周安国. 2-羟基-4-甲硫基丁酸异丙酯(HMBi)以及2-羟基-4-甲硫基丁酸(HMB)在反刍动物中的应用. 中国奶牛, 2008(11): 11-15.
LIN Y, WANG Z S, ZHOU A G. Application of 2-Hydroxy-4- (Methylthio) butanoic acid isopropyl ester and Methionine hydroxyl analogue in ruminants. China Dairy Cattle, 2008(11): 11-15. (in Chinese)
[33] KRAATZ M, WALLACE R J, SVENSSON L.sp. nov., a microaerotolerant anaerobic lactic acid bacterium from the sheep rumen and pig jejunum, and emended descriptions of,uli and. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(Pt 4): 795-803. doi:10.1099/ijs.0.022954-0.
[34] KHAFIPOUR E, LI S C, PLAIZIER J C, KRAUSE D O. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. doi:10.1128/AEM.00739-09.
[35] LEE C, OH J, HRISTOV A N, HARVATINE K, VAZQUEZ-ANON M, ZANTON G I. Effect of 2-hydroxy-4-methylthio-butanoic acid on ruminal fermentation, bacterial distribution, digestibility, and performance of lactating dairy cows. Journal of Dairy Science, 2015, 98(2): 1234-1247. doi:10.3168/jds.2014-8904.
[36] KONG F L, GAO Y X, TANG M Q, FU T, DIAO Q Y, BI Y L, TU Y. Effects of dietary rumen-protected Lys levels on rumen fermentation and bacterial community composition in Holstein heifers. Applied Microbiology and Biotechnology, 2020, 104(15): 6623-6634. doi:10. 1007/s00253-020-10684-y.
[37] DENMAN S E, MORGAVI D P, MCSWEENEY C S. Review: The application of omics to rumen microbiota function. Animal, 2018, 12: s233-s245. doi:10.1017/S175173111800229X.
Effects of 2-Hydroxy-4-(Methylthio)-Butanoic Acid on Rumen Fermentation and Microbiota in Holstein Female Calves
KONG FanLin1, LI Yuan1, FU Tong2, DIAO QiYu1, TU Yan1
1Feed Research Institute, Chinese Academy of Agricultural Sciences/Beijing Key Laboratory for Dairy Cow Nutrition, Beijing 100081;2College of Animal Science and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450000
【】2-Hydroxy-4-(Methylthio)-Butanoic Acid (HMBi) is widely used to satisfy the absent of methionine (Met) in ruminal diet. Although the characteristic of HMBi is a rumen protected product, there is still an amount of HMBi degraded in rumen, which should be taken seriously. Hence, this study was conducted to evaluate the effects of HMBi on rumen fermentation and microbiota. 【】The experiment was conducted for 97 days with 36 Holstein female calves aged about 84 day-old with (101±10) kg body weight, and those calves were allocated to 2 groups, including PC group (0.40% Met) and PCMet group (0.28% Met). The treatment was achieved by deducting HMBi in diet of PCMet group and made Met level 30% lower than that of PC group. The first 7 d were an adaptation to the diets and the next 90 d for sampling. The body weight was measured at 0 d and 90 d, respectivley. The dry matter intake was recorded daily throughout the whole trial period. The serum and rumen fluid samples from five calves in each group were sampled on day 90 to determine rumen fermentation parameters and microbial communities. 【】(1) Compared with PC group, the growth performance of PCMet group was not changed (>0.05). The Met in serum of PCMet group had trend to be significantly decreased when compared with PC group (0.05<<0.1); (2) The molar proportion of acetate and microprotein concentration in PCMet group was significantly decreased by Met deduction (<0.05). There were no significant differences on concentrations of total volatile fatty acid and ammonia nitrogen between two groups (>0.05). (3) The Shannon index of microbiota in PCMet group was lower than that in PC group (<0.05). The PCoA and PREANOVA analysis showed the significant distinction between microbiota in two groups (<0.05). Furthermore, the relative abundance of Firmicutes in PCMet group was decreased and the relative abundance of Bacteroidetes was increased when compared with PC group (<0.05). At genus level, the relative abundance of,group,,group, andwere decreased in PCMet group (<0.05). The correlation analysis showed thatgroupandwere significantly correlated with acetate andgroup was significantly correlated with MCP (<0.05,>0.7). 【】The ruminal microbiota was inhibited by HMBi deduction, which led to the decrease of MCP and Shannon index. Among them, the acetogen was sensitive with HMBi. In conclusion, although HMBi was a rumen protected product, the part of HMBi degraded in rumen still had the ability to regulate rumen fermentation.
HMBi; female calves; microbiota; rumen fermentation parameters

10.3864/j.issn.0578-1752.2022.04.014
2020-06-30;
2021-12-30
河北省重点研发计划(19226621D)、河南省科技开放合作项目(182106000035)、奶牛产业技术体系北京市创新团队项目(BAIC06-2017)
孔凡林,Tel:13240129429;E-mail:a895833622@163.com。通信作者屠焰,E-mail:tuyan@caas.cn
(责任编辑 林鉴非)

