6种水稻初级代谢物对水稻抗瘟性的影响
陈红凤 马笑晴 杨荣涛 唐萍 李淑旎 邵世豪 杨静

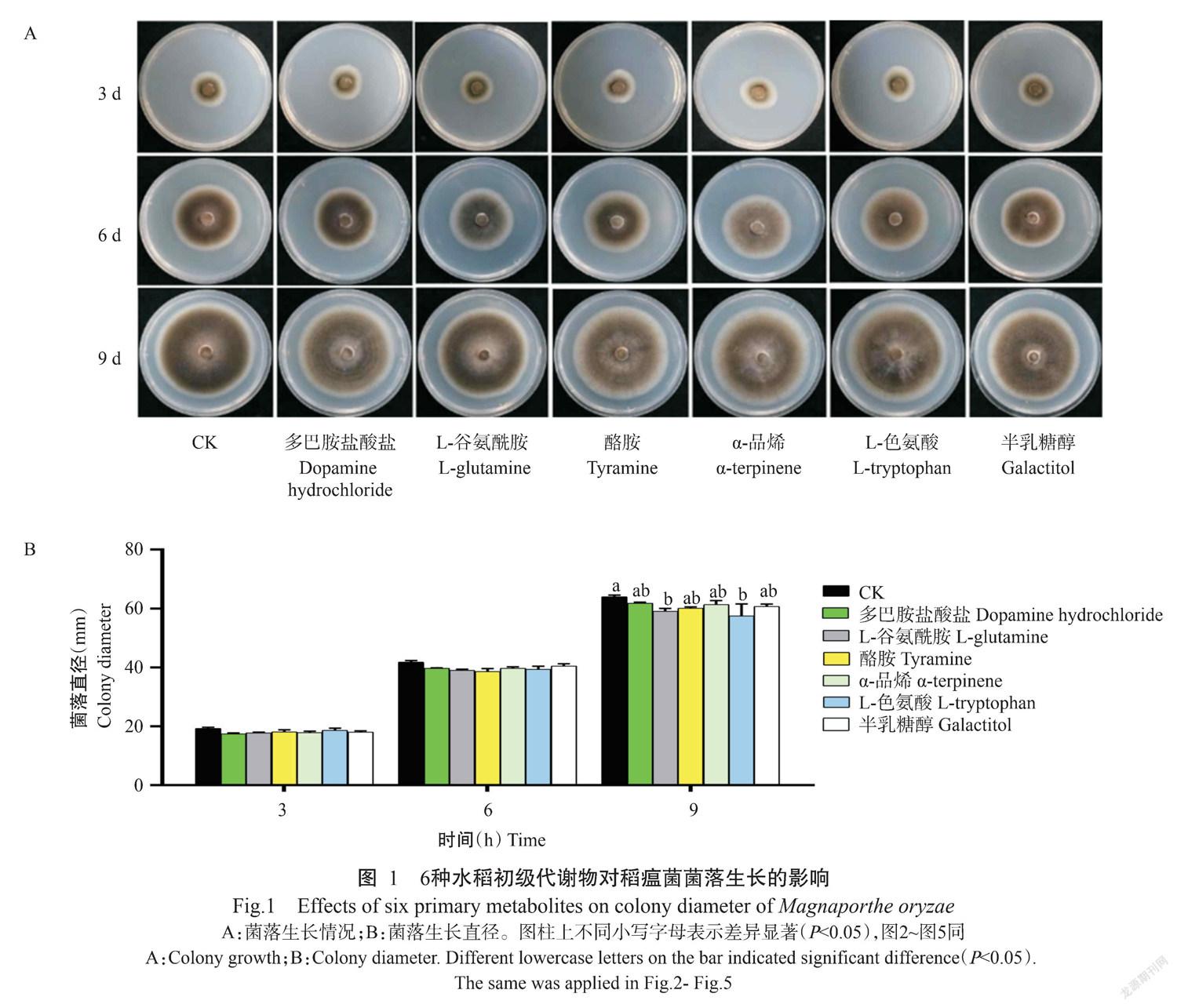



摘要:【目的】解析稻瘟菌與水稻互作时的水稻初级代谢物对稻瘟菌形态发育和水稻防御响应的影响,为生产上水稻稻瘟病绿色防控措施的制定提供基础数据。【方法】利用6种水稻初级代谢物(多巴胺盐酸盐、L-谷氨酰胺、酪胺、α-品烯、L-色氨酸和半乳糖醇)标准品按一定浓度处理稻瘟病菌株,观察代谢物对稻瘟菌菌落生长和菌株形态发育(产孢、菌丝生长和附着胞形成等)的影响;在此基础上,利用相同浓度的代谢物标准品处理稻瘟菌侵染36和48 h时的感病水稻丽江新团黑谷,进行稻瘟病病害调查、防御基因表达分析、活性氧(ROS)含量和过氧化物酶(POD)活性等生理指标测定。【结果】除L-谷氨酰胺和L-色氨酸对生长第9 d的稻瘟病菌菌落生长有显著影响外(P<0.05,下同),其余4种代谢物对稻瘟病菌菌落生长无显著影响(P>0.05,下同);6种水稻初级代谢物对稻瘟菌产孢有抑制作用,其中以酪胺和α-品烯的抑制效果最明显;多巴胺盐酸盐显著抑制稻瘟菌孢子的萌发,其余5种代谢物对稻瘟菌孢子萌发无显著影响;6种水稻初级代谢物对稻瘟菌芽管生长有显著的促进作用;多巴胺盐酸盐和L-色氨酸对附着胞形成有明显的促进作用,L-谷氨酰胺和酪胺对附着胞形成具有抑制作用。6种水稻初级代谢物明显降低稻瘟菌接种36和48 h时的水稻稻瘟病症状和病情指数,其中以多巴胺盐酸盐、酪胺和半乳糖醇对稻瘟病的控制效果最佳;6种水稻初级代谢物对稻瘟菌接种48 h时的稻瘟病控制效果高于其对接菌36 h时的水稻。进一步研究发现多巴胺盐酸盐和半乳糖醇抑制了稻瘟菌侵染36和48 h水稻中茉莉酸(JA)信号基因OsCOI1a、OsCOI1b和OsMYC2表达,但JA抑制子基因OsJAZ9上调,诱导ROS相关基因OsRbohB和OsRbohA以及病程相关基因OsPR10a和OsPR5上调,其中以2种代谢物诱导稻瘟菌侵染48 h时水稻中的ROS相关基因和病程相关基因的表达量高于稻瘟菌侵染36 h时的感病水稻;多巴胺盐酸盐诱导稻瘟菌侵染36和48 h时的水稻中POD活性明显增加,ROS含量有一定程度的增加。【结论】水稻初级代谢物通过影响稻瘟菌形态发育、诱导防御相关基因表达和POD活性增加等提高水稻抗瘟性,具有作为植物病害绿色防控激发子的潜力。
关键词: 水稻;稻瘟病;代谢物;防御相关基因;绿色防控
中图分类号: S511 文献标志码: A 文章编号:2095-1191(2022)01-0057-11
Effects of six metabolites on rice resistance to blast fungus, Magnaporthe oryzae
CHEN Hong-feng, MA Xiao-qing, YANG Rong-tao, TANG Ping, LI Shu-ni,
SHAO Shi-hao, YANG Jing*
(State Key Laboratory for Conservation and utilization of Bio-resources in Yunnan/Key Laboratory of
Agro-biodiversity and Pest Management of Ministry of Education/College of Plant Protection,
Yunnan Agricultural University,Kunming 650201, China)
Abstract:【Objective】Analyzing the effect of primary metabolites during interaction of rice and Magnaporthe oryzae on rice blast morphogenesis and defense response, to provide basic data for the formulation of green control measures for rice blast in production. 【Method】The six primary metabolites with a certain concentration (dopamine hydrochloride, L-glutamine, tyramine, α-pinene, L-tryptophan, galactinol) were used to treat the rice blast strains to observe the effects of metabolites on colony growth, strain morphology(sporulation, hypha germination and appressorium formation) of M. oryzae. On this basis, the same concentrations of metabolite standards were used to treat 36 h- and 48 h- infected rice to investigate symptom of rice blast disease, analyze defense gene expression, and detect reactive oxygen species (ROS) content and peroxidase(POD) activity. 【Result】Except for L-glutamine and L-tryptophan, which had a significant effect on the growth of the rice blast fungus colony on the ninth day of growth (P<0.05, the same below), the other four metabo-lites had no significant effect on the growth of the rice blast fungus colony (P>0.05). Six kinds of primary metabolites of rice had inhibitory effect on sporulation of M. oryzae, among which tyramine and α-pinene had the most obvious inhibitory effect. Dopamine hydrochloride significantly inhibited the spore germination of M. oryzae, while the other five metabolites had no obvious effect on the spore germination of M. oryzae. Six kinds of primary metabolites of rice could significantly promote the growth of germ tube of M. oryzae. Dopamine hydrochloride and L-tryptophan promoted appressorium formation, while L-glutamine and tyramine inhibited appressorium formation. Six kinds of primary metabolites in rice reduced the symptoms and disease index of rice blast at 36 and 48 h after inoculation with M. oryzae, among which dopamine hydrochloride, tyramine and galactitol had the best control effect on rice blast. The control effect of the six kinds of primary metabolites on rice blast at 48 h was higher than that at 36 h. Further studies found that dopamine hydrochloride and galactitol inhibited the expression of jasmonic acid (JA) signaling genes OsCOI1a, OsCOI1b and OsMYC2 in rice at 36 and 48 h of rice blast fungus infection, but the JA repressor gene OsJAZ9 was up-regulated and induced ROS-related genes OsRbohB, OsRbohA and the disease-related genes OsPR10a, OsPR5 were up-regulated. Among them,the expression levels of ROS-related genes and disease course-related genes in rice induced by the two metabolites at 48 h of M. oryzae infection were higher than those in infected rice at 36 h after M.oryzae. Both metabolites inhibited JA signaling genes. Dopamine hydrochloride induced obvious increase in POD activity and a certain degree of increase in ROS content in rice at 36 and 48 h of M. oryzae infection. 【Conclusion】Metabolites can improve rice blast resistance of susceptible rice variety through affecting the morphological development of rice blast fungus, inducing the expression of defense-related genes and increasing POD activity in susceptible rice. Therefore, the six metabolites have potential applications in the green control of rice blast disease.
Key words: rice; rice blast disease; metabolites; defense-related genes; green control
Foundation items: National Natural Science Foundation of China(31860483); Yunnan Fundamental Research Pro-ject (202101AS070038)
0 引言
【研究意义】据联合国粮农组织(FAO)报道,随着全球人口的持续增长及对粮食需求的不断增加,至2050年,全球粮食增长需达60%~100%才能满足100亿人口的粮食需求(Fróna et al.,2019)。当前全球粮食生产受极端气候、日益减少的可用耕地以及加剧的生物/非生物脅迫等的限制(Jaganathan et al.,2018;杨敏慎等,2021),而粮食产量和品质的保证是实现粮食安全生产的基础(张淑华等,2021),为此,2021年4月国务院新闻办举行的粮食和物资储备发展情况发布会上首次将粮食安全战略纳入国家五年规划(刘俊杰和马钧巧,2022)。水稻(Oryza Sativa)作为当今世界及我国主要的粮食作物之一,每年因稻瘟病造成10%~30%的产量损失(Nalley et al.,2016),而化学防治带来的一系列农田生态污染和稻米农残等问题严重影响着稻米品质。为保证粮食安全生产,除选育新的广谱抗(逆)病水稻品种外,施用激发子进行病害防治也是绿色、安全、有效的水稻病害防治方法。【前人研究进展】植物在受到各种病原菌侵染时,除启动病原相关分子模式引发的免疫响应(Pathogen-associated molecular patterns-triggered immunity,PTI)和效应蛋白引发的免疫响应(Effector-triggered immunity,ETI)等分子机制抵御病原菌外,还会在其受侵染部位周围产生各种特有代谢物,这些代谢物以信号分子的方式参与植物防御响应(Kachroo and Robin,2013;Zaynab et al.,2019;陈灿等,2020,2021)。其中莽草酸、半乳糖醇、海藻糖、D-甘露糖、亚麻酸、多巴胺、酪胺和L-谷氨酰胺等初级代谢物与植物防御反应和抗性增强有关(Duan et al.,2021)。如苏氨酸在拟南芥抗病性中作为信号分子参与拟南芥防御响应(Stuttmann et al.,2011)。α-品烯是一种挥发性芳香化合物,存在于多种食物和芳香植物(如薄荷)的精油中,具有抗氧化和抗真菌特性(Rudbäck et al.,2012)。酪胺(Tyramine)是一种天然存在的单胺化合物和从氨基酸酪氨酸衍生的微量胺(Dhakal and Macreadie,2020),已有研究发现根腐病病菌侵染的大麦叶片中积累了酪胺,大麦防御反应被激活(Ishihara et al.,2017)。糖信号分子在植物免疫响应中发挥作用(Bolouri Moghaddam and Van den Ende,2012)。如半乳糖醇是棉子糖家族的合成前体,参与植物对非生物(干旱和温度)和生物胁迫的响应,在受到病原菌侵染的植物中显著积累,参与植物对病原菌的系统诱导抗性(Meyer et al.,2018)。多巴胺是儿茶酚胺途径的天然产物,植物中的多巴胺具有多种功能,能影响糖代谢,并在应对非生物胁迫响应中发挥重要作用(Liang et al.,2018)。如多巴胺盐酸盐处理苹果幼苗,减轻了干旱对苹果幼苗生长的抑制作用,提高苹果苗的光合作用和叶绿素水平;同时,多巴胺具有重要的抗衰老作用,外源施用100 µmol/L多巴胺盐酸盐可延缓干旱诱导的叶片衰老(Liang et al.,2018)。谷氨酰胺是一种重要的氨基酸,是所有生物体合成核苷酸和其他含氮化合物的主要氨基供体,作为信号分子参与植物防御响应(Qiu et al.,2020)。除初级代谢物外,次生代谢物(酚、多元醇、糖苷和氮化合物等)同样在植物应对非生物和生物胁迫过程中发挥作用(Erb and Kliebenstein,2020),许多次生代谢产物如生物碱、酚类和类黄酮等在植物防御响应中发挥重要作用(Zaynab et al.,2018)。有研究发现吲哚硫甙生物合成缺陷的拟南芥突变体在Flg22处理后不再产生胼胝质防御反应,通过添加4-甲氧基-吲哚-3-基甲基硫代葡萄糖酸盐能恢复胼胝质形成(Clay et al.,2009),表明这种次生代谢产物可诱导防御响应产生。此外,尿囊素、谷氨酸盐、硫胺素、甘氨酸、丝氨酸和天冬酰胺等初级代谢物也可外源施用于植物,不仅能促进植物生长,还能提高植物的抗性(Luo et al.,2018)。Duan等(2021)利用多巴胺盐酸盐、L-谷氨酰胺、酪胺、α-品烯、L-色氨酸和半乳糖醇等6种水稻初级代谢物标准品外源处理稻瘟菌侵染72 h时的感病水稻,可降低水稻稻瘟病症状。综上,代谢物在植物与病原菌互作时的防御响应中发挥重要作用。【本研究切入点】目前,代谢物处理稻瘟菌对稻瘟菌形态发育(孢子、附着胞和菌丝生长等)的影响,及代谢物处理稻瘟菌侵染早期(36和48 h)的水稻,对稻瘟病症状的影响及其相应的分子机制尚未见报道。【拟解决的关键问题】利用6种水稻初级代谢物(多巴胺盐酸盐、L-谷氨酰胺、酪胺、α-品烯、L-色氨酸和半乳糖醇)标准品按一定浓度处理稻瘟菌菌株,观察水稻初级代谢物对稻瘟菌菌落生长和菌株形态发育(产孢、菌丝生产和附着胞形成等)的影响;进一步利用6种水稻初级代谢物外源处理稻瘟菌侵染36和48 h时的感病水稻丽江新团黑谷,观察稻瘟病症状;在此基础上,从生理和分子水平解析对稻瘟病控制效果最佳的代谢物对水稻防御体系的影响,为生产上水稻稻瘟病绿色防控措施的制定提供基础数据。
1 材料与方法
1. 1 试验材料
供试高感粳稻丽江新团黑谷(LTH)几乎对所有稻瘟病菌株敏感(凌忠专等,2001)。供试菌株为强致病性稻瘟菌95234I-1b,该菌株可引起抗病水稻Ilimibeyo出现稻瘟病病斑(Wang et al.,2019;Duan et al.,2021)。水稻品种丽江新团黑谷和稻瘟病菌株95234I-1b均由省部共建云南生物资源保护与利用国家重点实验室保存。
1. 2 水稻育苗及稻瘟病菌接种
水稻育苗和稻瘟病菌接种方法参照Duan等(2021)的方法。水稻种子经1.5%次氯酸钠溶液消毒5 min,清水冲洗3~5遍,置于28 ℃恒温培养箱中催芽至露白后播种于灭菌的基质土中。待水稻长至3叶1心期(约14 d)时用于稻瘟病菌接种。
挑取保存的95234I-1b菌丝块于PDA固体培养基(马铃薯200 g、葡萄糖20 g、琼脂粉15 g、蒸餾水1000 mL)上,置于28 ℃恒温培养箱中活化培养,将活化菌丝块移至PDB液体培养基(马铃薯200 g、葡萄糖20 g、蒸馏水1000 mL)中培养4~5 d有大量菌丝产生。将菌丝涂布于西梅汁培养基(西梅汁40 mL、酵母提取物1 g、 乳糖5 g、琼脂粉15 g、蒸馏水定容至1000 mL,pH 6.5)上,置于28 ℃光照培养箱(12 h黑暗和12 h光照交替)中培养,至培养基表面长满菌丝,刮去菌丝后再持续光照培养5 d,即可产生大量分生孢子。
配制孢子悬浮液,使孢子悬浮液浓度达1.5×105个孢子/mL,将孢子悬浮液喷雾接种于3叶1心期的水稻叶片上,置于培养箱中黑暗保湿24 h,然后置于28 ℃温室中保湿培养,至第7 d时进行病害调查。
1. 3 6种水稻初级代谢物标准品浓度配制
参照Duan等(2021)报道的6种水稻初级代谢物酪胺、L-色氨酸、L-谷氨酰胺、半乳糖醇、多巴胺盐酸盐和α-品烯标准品外源处理植物时的浓度进行配制,分别为1、0.01、0.35、0.5、0.01和0.0007 mmol/L。
1. 4 代谢物处理稻瘟病菌孢子和菌丝
1. 4. 1 代谢物母液制备 配制6种水稻初级代谢物酪胺、L-色氨酸、L-谷氨酰胺、半乳糖醇、多巴胺盐酸盐和α-品烯母液,浓度分别为146、98、137、110、105和147 mmol/L。
1. 4. 2 代谢物对稻瘟菌菌落生长的影响 将配制好的代谢物母液按一定体积分别加入冷却至60 ℃左右的PDA培养基中摇匀倒平板,使6种水稻初级代谢物浓度达到Duan等(2021)报道的浓度。取培养4 d的稻瘟菌菌落边缘处的菌丝块放在上述含有相应浓度代谢物的PDA培养基上,置于28 ℃恒温培养箱中培养,于培养3、6和9 d时测量稻瘟菌菌落直径。以5块相同大小的稻瘟菌菌丝块放置于灭菌水代替代谢物的PDA培养基上作为对照。
1. 4. 3 代谢物对稻瘟菌产孢的影响 将配制好的代谢物母液按一定体积分别加入到冷却至60 ℃左右的西梅汁培养基中摇匀倒平板。将摇好的稻瘟菌菌液均匀涂布于西梅汁上,于光照培养箱中培养9 d后用5 mL无菌水洗下孢子,制备孢子悬浮液并于血球计数板(16×25)上取4个角的中方格(100个小方格)统计孢子数,计数重复3次,取其平均值。计数完毕后,依下列公式计算:孢子数/mL=100个小方格孢子总数/100×400×10000×稀释倍数。
1. 4. 4 代谢物对附着胞形成的影响 取10 μL经6种代谢物处理后的孢子悬浮液均匀涂布于玻璃纸上,置于光照培养箱中培养2、4、6、8和10 h后于显微镜下观察孢子形态并拍照,然后分别统计产孢数、2 h的芽管萌发率和6 h的附着胞形成率。
1. 5 代谢物处理稻瘟菌接种36和48时的水稻
将配置制好浓度的6种水稻初级代谢物喷施到经稻瘟菌95234I-1b接种36和48 h的丽江新团黑谷水稻叶片上,以无菌水喷施的水稻叶片为对照,于接种第7 d时进行水稻稻瘟病调查和统计,稻瘟病病害调查和统计参照Duan等(2021)的方法。代谢物处理稻瘟菌接种36 h时的水稻,于接菌36、48、72、96和120 h取样水稻叶片;代谢物处理稻瘟菌接种48 h时的水稻,于接菌48、72、96和120 h取样水稻叶片。
1. 6 水稻防御基因表达分析
基因表达分析参照Wang等(2019)的方法,引物序列见表1。先将所取样品根据TransZol UP试剂盒进行总RNA提取,然后利用GoldenstarTM RT6 cDNA Synthesis Kit TSK301M逆转录试剂盒(北京擎科新业生物技术有限公司)进行逆转录,最后利用2XTSINGKE® MasterqPCR Mix (SYBR Green I) TSE201(北京擎科新业生物技术有限公司)试剂盒进行实时荧光定量PCR(qRT-PCR)分析。反应体系20.0 µL:上、下游引物各0.8 µL,cDNA模板0.5 µL,荧光染料10.0 µL,ddH2O补足至20.0 µL。扩增程序:95 ℃预变性1 min;95 ℃ 10 s,57 ℃ 10 s,72 ℃ 15 s,进行40个循环。65 ℃升高到95 ℃获取熔解曲线。试验重复3次。用2-△△Ct法对表1中所列基因的表达水平进行计算分析,即基因的相对表达量=2-(Ct1-actinCt1)-(Ct2-actinCt2)。
1. 7 代谢物处理稻瘟菌侵染的水稻活性氧(ROS)和过氧化物酶(POD)测定
利用ELISA检测试剂盒(上海极威生物科技有限公司)对经代谢物处理的稻瘟菌接种水稻叶片进行POD活性和ROS含量测定。利用液氮研磨水稻样品,取0.1 g研磨后的样品粉末放入1.5 mL离心管中,加入500 µL 1XPBS剧烈振荡后4 ℃下10000 r/min离心20 min,取200 µL上清液备用。
加入50 µL标准品于标准品孔,每个标准品3个重复,用于制备标准曲线;样品孔中加入10 µL上清液和40 µL样品稀释液,每种样品3个重复,然后加入100 µL HRP,于37 ℃恒温箱孵育60 min后洗板,加入反应底物A和底物B各50 µL,37 ℃避光孵育15 min后,加入终止液50 µL,置于波长450 nm酶标仪(Varioskan LUX,美国)测定样品OD值,代入标准曲线计算样品浓度。
1. 8 统计分析
所有数据采用SPSS 19.0进行处理,运用GraphPad Prism 8.0.2作图。
2 结果与分析
2. 1 6种水稻初级代谢物对稻瘟病菌菌落生长的影响
前期研究发现酪胺、L-色氨酸、L-谷氨酰胺、半乳糖醇、多巴胺盐酸盐和α-品烯处理稻瘟菌接种72 h时的水稻能有效减轻水稻稻瘟病症状(Duan et al.,2021)。本研究进一步利用上述6种水稻初级代谢物处理稻瘟病菌菌落,于处理后不同时间点(3、6和9 d)测量稻瘟病菌菌落直径。结果(图1)显示,经6种水稻初级代谢物处理的稻瘟菌在处理后3和6 d时菌落直径与对照基本一致,差异不显著(P>0.05,下同);至处理后9 d时,除L-谷氨酰胺和L-色氨酸处理的菌落直径显著小于对照外(P<0.05,下同),其余4种代谢物处理的菌落直径与对照差异不显著。表明除L-谷氨酰胺和L-色氨酸对生长第9 d的稻瘟病菌菌落生长有显著影响外,其余4种代谢物对稻瘟病菌菌落生长无明显影响。
2. 2 6种水稻初级代谢物对稻瘟病菌菌株形态发育的影响
为明确水稻代谢物对稻瘟病菌菌株形态发育的影响,利用6种水稻初级代谢物处理稻瘟病菌,分析代谢物对稻瘟菌产孢、萌发率、芽管长度和附着胞形成等形态发育的影响。与对照相比,6种水稻初级代谢物对稻瘟菌产孢有抑制作用,其中酪胺和α-品烯显著抑制了稻瘟菌产孢,其余4种代谢物均抑制了稻瘟菌产孢,但与对照未达显著差异水平(图2-A);多巴胺盐酸盐显著抑制稻瘟菌孢子的萌发,其余5种代谢物对稻瘟菌孢子萌发无显著影响(图2-B);6种水稻初级代谢物对稻瘟菌芽管生长有显著的促进作用(图2-C);多巴胺盐酸盐和L-色氨酸对附着胞形成有明显的促进作用,L-谷氨酰胺和酪胺对附着胞形成具有抑制作用(图2-D)。表明6种水稻初级代谢物均能影响稻瘟菌形态发育,其在稻瘟菌形态发育过程中起促进或抑制作用。
2. 3 6种水稻初级代谢物处理稻瘟菌接种不同时间点的水稻对其稻瘟病症状的影响
为明确6种水稻初级代谢物对感病水稻丽江新团黑谷稻瘟病症状的影响,利用6种水稻初级代谢物处理稻瘟菌接种36和48 h时的丽江新团黑谷,分析其对稻瘟病的控制效果。结果(图3)显示,与对照相比,6种水稻初级代谢物处理稻瘟菌接种48 h时的丽江新团黑谷的稻瘟病症状明显减轻、病情指数显著降低,稻瘟病症状由急性型转变成慢性型,其中以多巴胺盐酸盐和酪胺处理的控病效果最佳;6种水稻初级代谢物处理稻瘟菌接种36 h时的丽江新团黑谷的稻瘟病症状减轻、病情指数显著降低,稻瘟病症状由急性型转变成慢性型,其中以半乳糖醇处理的控病效果最佳。表明6种水稻初级代谢物处理对稻瘟菌接种48 h时的感病水稻控病效果高于对接菌36 h时的感病水稻。
2. 4 多巴胺盐酸盐和半乳糖醇对稻瘟菌侵染的水稻防御相关基因表达的影响
依据6种水稻初级代谢物处理稻瘟菌侵染36和48 h时的水稻稻瘟病症状统计结果,进一步选取多巴胺盐酸盐和半乳糖醇处理稻瘟菌侵染36和48 h时的感病水稻,分析2种代谢物对水稻茉莉酸(JA)信号基因OsCOI1a、OsCOI1b、OsMYC2和JA抑制子基因OsJAZ9、ROS相关基因OsRbohA和OsRbohB及病程相关基因OsPR10a和OsPR5 表达的影响。
多巴胺盐酸盐处理稻瘟菌侵染36 h的感病水稻,分析接菌后36、48、72、96和120 h时的水稻防御相关基因表达,发现OsJAZ9在各测定时间点均上调或显著上调,OsCOI1b和OsMYC2 除96 h时显著上调外,其余时间点表达量与对照相近或显著低于对照,OsCOI1a则被抑制(图4-A);OsRbohA在36和72 h时显著上调,其余3个时间点被抑制或与对照相近,OsRbohB仅在36 h时显著上调,其余4个时间点被抑制(图4-B);OsPR10a和OsPR5在36、72和96 h时显著上调,在48和120 h时表达量被抑制或小幅上调(图4-C)。多巴胺盐酸盐处理稻瘟菌侵染48 h的感病水稻,分析接菌48、72、96和120 h时的水稻防御相关基因表达,发现OsCOI1b在接菌48、96和 120 h显著上调,OsCOI1a、OsMYC2和OsJAZ9在96 h时显著上调,其余时间点表达量变化不大(图4-D);OsRbohA在4个时间点表达量显著上调,OsRbohB在48和96 h时显著上调,72和120 h时的表达量被抑制或与对照相近(图4-E);OsPR10a和 OsPR5在4个时间点显著上調(图4-F)。
半乳糖醇处理稻瘟菌侵染36 h的感病水稻,分析接菌36、48、72、96和120 h时的水稻防御相关基因表达,发现OsJAZ9在各时间点均显著上调,OsMYC2在接菌48、72、 96和120 h显著上调,OsCOI1a和OsCOI1b在72 h略上调,其余时间点表达量与对照相似或被抑制(图4-G);OsRbohA在72 h时显著上调,其余4个时间点与对照相近或被抑制,OsRbohB仅在48和120 h时显著上调,其余3个时间点与对照相近或被抑制(图4-H);OsPR10a在各时间点均显著上调,OsPR5在36、72和96h时显著上调,其余2个时间点被抑制(图4-I)。半乳糖醇处理稻瘟菌侵染48 h时的感病水稻,分析接菌48、72、96和120 h时的水稻防御相关基因表达,发现OsJAZ9在接菌72、96和120 h时显著上调,OsCOI1a和OsCOI1b在接菌72和96 h时显著上调,其他时间点表达量变化不大;OsMYC2在4个时间点的表达量与对照相近被抑制或(图4-J);OsRbohA和OsRbohB在48和96 h时表达量显著上调,72 h时被抑制(图4-K);OsPR10a在72、96和120 h时显著上调,OsPR5在72和96 h时显著上调(图4-L)。
综上所述,OsRbohA和OsRbohB介导ROS产生及OsPR10a和OsPR5上调在2种代谢物处理稻瘟菌侵染48 h时的感病水稻中发挥作用,但JA防御响应被抑制,其中2种代谢物诱导稻瘟菌侵染48 h时感病水稻中的OsRbohA、OsRbohB、OsPR10a和OsPR5的上调幅度高于2种代谢物诱导稻瘟菌侵染36 h时感病水稻,2种代谢物均抑制了JA信号基因表达。
2. 5 多巴胺盐酸盐对稻瘟菌侵染的水稻中ROS含量和POD活性的影响
在明确多巴胺盐酸盐显著降低感病水稻稻瘟病症状和诱导ROS产生相关基因表达的基础上,鉴于ROS清除与积累间的动态平衡在植物与病原菌互作中能发挥重要作用(Tian et al.,2013),进一步检测多巴胺盐酸盐处理对稻瘟菌侵染36和48 h时的水稻中ROS含量及POD活性。与对照相比,多巴胺处理稻瘟菌侵染36 h的水稻中POD活性显著上升(图5-A),而ROS含量在36、72和96 h时增加(图5-B);多巴胺盐酸盐处理稻瘟菌侵染48 h的水稻中POD活性增加(图5-C),而ROS含量仅在48 h时增加,其余时间点与对照相近(图5-D)。表明多巴胺盐酸盐通过诱导POD活性增加提高水稻抗瘟性。
3 讨论
前期研究表明供试6种水稻初级代谢物多巴胺盐酸盐、L-谷氨酰胺、酪胺、α-品烯、L-色氨酸和半乳糖醇能有效减轻稻瘟菌侵染72 h的抗病水稻的稻瘟病病斑数量(Duan et al.,2021),在此基础上,本研究继续深入分析6种水稻初级代谢物对稻瘟菌形态发育的影响及对感病水稻稻瘟病的控制效果。本研究发现6种水稻初级代谢物能有效抑制稻瘟菌产孢,而孢子是稻瘟病发生的要素之一,同时也是初侵染源之一,表明6种水稻初级代谢物在抑制稻瘟菌产孢以减少初侵染源方面发挥作用。
6种水稻初级代谢物能有效降低稻瘟菌侵染36和48 h时感病水稻丽江新团黑谷稻瘟病症状,体现在其将稻瘟病病斑由急性型转变成慢性型。急性型病斑发展快,是稻瘟病流行的先兆,而急性型病斑经药剂防治后转变成慢性型病斑,使得病情发展趋向缓慢。为明确代谢物是否诱导水稻防御响应,本研究依据OsRbohA和OsRbohB介导ROS含量增加来提高水稻抗瘟性(Shi et al.,2020),病程相关基因PR10a和OsPR5的高表达意味着植物抗性增强(Gravot et al.,2012;Lemarié et al.,2015)检测了ROS相关基因和病程相关基因的表达,发现以多巴胺盐酸盐和半乳糖醇为代表的代谢物确实可诱导OsRbohA和OsRbohB、OsPR10a和OsPR5上调,因此,本研究结果进一步表明水稻初级代谢物可作为信号分子参与植物防御响应(Stuttmann et al.,2011)。6种水稻初级代谢物诱导OsJAZ9高表达,却抑制JA信号基因表达,表明代谢物抑制了JA防御响应。H2O2和POD等在植物防御响应中发挥重要作用(Xu et al.,2016),但过量ROS积累会加速细胞衰老和死亡,而ROS解毒对活性氧动态平衡至关重要,POD在过量ROS解毒中发挥重要作用(Mittler et al.,2004;Tian et al.,2013)。本研究检测到多巴胺盐酸盐代谢物诱导高的POD活性、诱导ROS含量早期增加、后期下降,表明代谢物可使感病水稻内的ROS处于动态平衡。
稻瘟菌是半活体寄生真菌,当其孢子接触水稻叶片表面后,在适宜条件下孢子会发芽,形成附着胞,16~20 h是附着胞穿透寄主角质层侵入第1个细胞的时间,20~36 h是初生菌丝长满侵入的第1个细胞的时间;36~48 h是次生菌丝长出并向临近细胞扩展的时间(Bhadauria et al.,2011;Nalley et al.,2016),此时为稻瘟菌活体营养期。本研究发现6种水稻初级代谢物对稻瘟菌侵染48 h的水稻稻瘟病控制效果显著高于其对稻瘟菌侵染36 h的水稻,同时结合6种水稻初级代谢物对稻瘟菌菌落直径无明显影响,推测6种水稻初级代谢物可能对稻瘟菌活体营养期的次生菌丝有抑制作用。进一步发现以多巴胺盐酸盐和半乳糖醇为代表的代谢物诱导稻瘟菌侵染48 h的水稻中ROS相关基因和病程相关基因表达量高于稻瘟菌侵染36 h的水稻中4个基因表达量,证实植物防御响应在半活体寄生真菌的活体营养期激活是控制植物病害发生的关键(Chowdhury et al.,2017)。综上,6种水稻初级代谢物可有效控制抗病和感病水稻稻瘟病症状,具有作为生产上植物病害绿色防控的潜在激发子的特性。
4 结论
水稻初级代谢物通过影响稻瘟菌形态发育、诱导防御相关基因表达和POD活性增加等提高水稻抗瘟性,具有作为植物病害绿色防控激发子的潜力,为安全、高效、绿色防治水稻稻瘟病提供了新思路。
参考文献:
陈灿,郭辉,张晓丽,刘百龙,秦学毅,冯锐. 2020. 水稻内源化学物质及其与抗稻飞虱的关系[J]. 南方农业学报,51(5):1047-1052. [Chen C,Guo H,Zhang X L,Liu B L,Qin X Y,Feng R. 2020. Relationship between endogenous chemical substances in rice and resistance to rice planthopper[J]. Journal of Southern Agriculture,51(5):1047-1052.] doi:10.3969/j.issn.2095-1191.2020.05.008.
陳灿,张宗琼,夏秀忠,杨行海,农保选,张晓丽,徐志健,李丹婷,郭辉,冯锐. 2021. 代谢组学揭示水稻—稻瘿蚊互作的潜在生化标识物[J]. 南方农业学报,52(10):2662-2670. [Chen C,Zhang Z Q,Xia X Z,Yang X H,Nong B X,Zhang X L,Xu Z J,Li D T,Guo H,Feng R. 2021. Metabolomics reveals potential biomarkers of rice gall midge (Orseolia oryzae) interactions[J]. Journal of Southern Agriculture,52(10):2662-2670.] doi:10.3969/j.issn. 2095-1191.2021.10.005.
凌忠專,蒋琬如,王久林,雷财林. 2001. 水稻品种丽江新团黑谷普感特性的研究和利用[J]. 中国农业科学,34(1):116-117. [Lin Z Z,Jiang W R,Wang J L,Lei C L. 2001. Research and utilization of universally susceptible property of japonica rice variety Lijiangxintuanheigu[J]. Scientia Agricultura Sinica,34(1):116-117.]
刘俊杰,马钧巧. 2022. 新冠疫情背景下对我国粮食安全问题的思考[J]. 现代农业科技,(2):205-207. [Liu J J,Ma J Q. 2022. Reflection on China’s food security under the background of COVID-19[J]. Modern Agricultural Scien-ce and Technology,(2):205-207.] doi:10.3969/j.issn. 1007-5739.2022.02.065.
杨敏慎,刘晓雨,郭辉. 2021. 气候变暖和CO2浓度升高对农作物的影响[J]. 江苏农业学报,37(1):246-258. [Yang M S,Liu X Y,Guo H. 2021. Effects of climate warming and elevated CO2 concentration on crops[J]. Jiangsu Journal of Agricultural Sciences,37(1):246-258.] doi:10. 3969/j.issn.1000-4440.2021.01.032.
张淑华,黄高彦,张一帆,李炳军. 2021. 基于灰色关联分析的关键粮食生产技术筛选[J]. 河南农业大学学报,55(2):356-363.[Zhang S H,Huang G Y,Zhang Y F,Li B J. 2021. Screening of key grain production technologies based on grey relational analysis[J]. Journal of Henan Agricultural University,55(2):356-363.] doi:10.16445/j.CNKI.1000-2340.20210406.002.
Bhadauria V,Banniza S,Vandenberg A,Selvaraj G,Wei Y. 2011. Cataloging proteins putatively secreted during the biotrophy-necrotrophy transition of the anthracnose pathogen Colletotrichum truncatum[J]. Plant Signaling & Behavior,6(10):1457-1459. doi:10.4161/psb.6.10.17700.
Bolouri Moghaddam M R,Van den Ende W. 2012. Sugars and plant innate immunity[J]. Journal of Experimental Botany,63(11):3989-3998. doi:10.1093/jxb/ers129.
Chowdhury S,Basu A,Kundu S. 2017. Biotrophy-necrotrophy switch in pathogen evoke differential response in resistant and susceptible sesame involving multiple signaling pathways at different phases[J]. Scientific Reports,7(1):17251. doi:10.1038/s41598-017-17248-7.
Clay N K,Adio A M,Denoux C,Jander G,Ausubel F M. 2009. Glucosinolate metabolites required for an Arabidopsis innate immune response[J]. Science,323(5910):95-101. doi:10.1126/science.1164627.
Dhakal S,Macreadie I. 2020. Tyramine and amyloid beta 42:A toxic synergy[J]. Biomedicines,8(6):145:1-10. doi:10.3390/biomedicines8060145.
Duan G,Li C,Liu Y,Ma X,Luo Q,Yang J. 2021. Magnaporthe oryzae systemic defense trigger 1(MoSDT1)-mediated metabolites regulate defense response in rice[J]. BMC Plant Biology,21:40. doi:10.1186/s12870-020-02821-6.
Erb M,Kliebenstein D J. 2020. Plant secondary metabolites as defenses,regulators,and primary metabolites:The blurred functional trichotomy[J]. Plant Physiology,184(1):39-52. doi:10.1104/pp.20.00433.
Fróna D,Szenderák J,Harangi-Rákos M. 2019. The challenge of feeding the world[J]. Sustainability,11(20):5816. doi:10.3390/su11205816.
Gravot A,Deleu C,Wagner G,Lariagon C,Lugan R,Todd C,Wendehenne D,Delourme R,Bouchereau A,Manzanares Dauleux M J. 2012. Arginase induction represses gall development during clubroot infection in Arabidopsis[J]. Plant & Cell Physiology,53(5):901-911. doi:10.1093/pcp/pcs037.
Ishihara A,Kumeda R,Hayashi N,Yagi Y,Sakaguchi N,Kokubo Y,Ube N,ebayashi S I,Ueno K. 2017. Induced accumulation of tyramine,serotonin,and related amines in response to Bipolaris sorokiniana infection in barley[J]. Bioscience,Biotechnology & Biochemistry,81(6):1090-1098. doi10.1080/09168451.2017.1290520.
Jaganathan D,Ramasamy K,Sellamuthu G. 2018. CRISPR for crop improvement:An update review[J]. Frontiers in Plant Science,9:985. doi:10.3389/fpls.2018.00985.
Kachroo A,Robin G P. 2013. Systemic signaling during plant defense[J]. Current Opinion in Plant Biology,16(4):527-533. doi:10.1016/j.pbi.2013.06.019.
Lemarié S,Robert-Seilaniantz A,Lariagon C,Lemoine J,Marnet N,Jubault M,Manzanares-Dauleux M J,Gravot A. 2015. Both the jasmonic acid and the salicylic acid pathways contribute to resistance to the biotrophic clubroot agent Plasmodiophora brassicae in Arabidopsis[J]. Plant & Cell Physiology,56(11):2158-2168. doi:10.1134/S1021443718010168.
Liang B W,Gao T T,Zhao Q,Ma C Q,Chen Q,Wei Z W,Li C Y,Li C,Ma F W. 2018. Effects of exogenous dopamine on the uptake,transport,and resorption of apple iono-me under moderate drought[J]. Frontiers in Plant Science,9:755. doi:10.3389/fpls.2018.00755.
Luo Y,Wang W,Fan Y Z,Gao Y M,Wang D. 2018. Exogenously-supplied trehalose provides better protection for D1 protein in winter wheat under heat stress[J]. Russian Journal of Plant Physiology,65(1):115-122. doi:10.1134/s1021443718010168.
Meyer T,Comte,G,Vial L,Lavire C l,Vigouroux A,Aumont-Nicaise M,Moréra S. 2018. The plant defense signal galactinol is specifically used as a nutrient by the bacterial pathogen Agrobacterium fabrum[J]. Journal of Biological Chemistry,293(21):7930-7941. doi:10.1074/jbc.RA118.001856.
Mittler R,Vanderauwera S,Gollery M,Van Breusegem F. 2004. Reactive oxygen gene network of plants[J]. Trends in Plant Science,9(10):490-498. doi:10.1016/j.tplants. 2004.08.009.
Nalley L,Tack J,Barkley A,Jagadish K,Brye K. 2016. Quantifying the agronomic and economic performance of hybrid and conventional rice varieties[J]. Agronomy Journal,108(4):1514-1525. doi:10.2134/agronj2015.0526.
Qiu X M,Sun Y Y,Ye X Y,Li Z G. 2020. Signaling role of glutamate in plants[J]. Frontiers in Plant Science,10:1743. doi:10.3389/fpls.2019.01743.
Rudbäck J,Bergström M A,Börje A,Nilsson U,Karlberg A T. 2012. α-Terpinene,an antioxidant in tea tree oil,auto-xidizes rapidly to skin allergens on air exposure[J]. Che-mical Research in Toxicology,25(3):713-721. doi:10. 1021/tx200486f.
Shi Y,Chang Y L ,Wu H T,Abdullah S,Liu W T,Li W Q,Xu J W,Chen K M. 2020. OsRbohB-mediated ROS production plays a crucial role in drought stress tolerance of rice[J]. Plant Cell Reports,39(12):1767-1784. doi:10. 1007/s00299-020-02603-2.
Stuttmann J,Hubberten H M,Rietz S,Kaur J,Muskett P,Guerois R,BednareK P,Hoefgen R,Parker J E. 2011. Perturbation of Arabidopsis amino acid metabolism causes incompatibility with the adapted biotrophic pathogen Hyaloperonospora arabidopsidis[J]. The Plant Cell,23(7):2788-2803. doi:10.1105/tpc.111.087684.
Tian S P,Qin G Z,Li B Q. 2013. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity[J]. Plant & Molecular Biology,82:593-602. doi:10.1007/s11103-013-0035-2.
Wang C M,Li C Q,Duan G H,Wang Y F,Zhang Y L,Yang J. 2019. Overexpression of Magnaporthe oryzae systemic defense trigger 1(MoSDT1) confers improved rice blast resistance in rice[J]. International Journal of Molecular Sciences,20(19):4762. doi:10.3390/ijms20194762.
Xu J,Meng J,Meng X Z,Zhao Y T,Liu J M,Sun T F,Liu Y D,Wang Q M,Zhang S Q. 2016. Pathogen-responsive MPK3 and MPK6 reprogram the biosynthesis of indole glucosinolates and their derivatives in Arabidopsis immunity[J]. Plant Cell,28:1144-1162. doi:10.1105/tpc.15.00 871.
Zaynab M,Fatima M,Abbas S,Sharif Y,Umair M,Zafar H,Bahadar K. 2018. Role of secondary metabolites in plant defense against pathogens[J]. Microbial Pathogenesis,124:198-202. doi:10.1016/j.micpath.2018.08.034.
Zaynab M,Fatima M,Sharif Y,Zafar M H,Ali H,Khan K A. 2019. Role of primary metabolites in plant defense against pathogens[J]. Microbial Pathogenesis,137:103728. doi:10.1016/j.micpath.2019.103728.
(責任编辑 麻小燕)

