盐酸莫西沙星片微生物限度检查方法讨论
杨美琴 蔡春燕 刘鹏 刘枕 马仕洪 胡昌勤
(1 中国食品药品检定研究院,北京 100050;2 淄博市食品药品检验研究院,淄博 255086)
盐酸莫西沙星属于第四代喹诺酮类抗菌药物,通过干扰细菌的拓扑异构酶Ⅱ和Ⅳ影响细菌的繁殖代谢,有广谱杀菌作用[1]。目前,盐酸莫西沙星片在国内已经广泛应用于上呼吸道感染、尿路感染、前列腺感染等临床治疗,效果良好[2-7]。
2014年,盐酸莫西沙星片在国内首次获批进口;2018年国内研制的盐酸莫西沙星片也获批上市;截至2021年,国内已有10个企业的盐酸莫西沙星片获批上市。监管紧跟临床需求[8],作为成熟的上市药品,盐酸莫西沙星片微生物限度符合中国药典的规定是对其最基本的质量要求。但由于本品对革兰阳性菌、阴性菌,以及厌氧菌、抗酸菌、非典型病原菌都具有较好的抗菌作用,在微生物限度检查时,较强的抑菌活性大大影响了方法的重现性、合理性。目前仅部分国产盐酸莫西沙星片的质量标准中明确收载了微生物限度检查方法。随着喹诺酮类产品升级换代,此类抗菌药物的微生物限度检查难度会不断增加,因此关于喹诺酮类抗生素、包括盐酸莫西沙星的微生物限度检查方法讨论一直都是相关领域关注和讨论的技术难点[9-17]。
本文基于2021年盐酸莫西沙星片国家评价性抽验结果,在汇总不同药品质量标准中收载的微生物限度检查方法的基础上,参考文献研究结果,讨论该品种方法操作中可能存在的问题,并针对日常检验给出相对粗放、简便的检查方法,提高该品种的检验效率。本文的结果对其他喹诺酮类口服制剂微生物限度检验控制工作亦有所启示。
1 仪器与试药
1.1 仪器
高压灭菌器,Yamato-SQ510C/SQ810C;电子天平,Sartorius-CPA2202S-DS;生物安全柜,Thermo-12854FT;恒温培养箱,Yamato-INC821C;薄膜过滤系统,Millipore-MILLIFLEX PLUS/EZSTREAM1。
1.2 试药与耗材
pH7.0无菌氯化钠蛋白胨缓冲液(北京三药科技开发公司,20210125),0.9%无菌氯化钠溶液(石家庄四药有限公司,2001033205),胰酪大豆胨琼脂培养基(对照培养基,135025-201803),胰酪大豆胨液体培养基(Merck,F0BB21915),沙氏葡萄糖琼脂培养基(上海诺狄生物科技有限公司,4333201224-14N),六水合氯化镁(Merck, A0725033837),无水硫酸镁(天津市大港亿中化工厂,20050405),羟丙基-β-环糊精(HPCD,北京华威锐科化工有限公司,HW20B1201-6),聚山梨酯80(吐温80,国药化学试剂有限公司,20190919),无菌滤杯(默克化工技术,
EFHAW10MS,F0JB82610C)。
1.3 菌种
铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104];金黄色葡萄球菌 (Staphylococcus aureus)[CMCC(B)26003];大肠埃希菌(Escherichia coli)[CMCC(B)44102];枯草芽胞杆菌(Bacillus subtilis)[CMCC(B)63501];白念珠菌 (Candida albicans)[CMCC(F)98001];黑曲霉 (Aspergillus niger)[CMCC(F)98003]来自中国食品药品检定研究院,中国医学细菌保藏中心。
2 试验方法
2.1 方法比较
汇总各标准中微生物限度检查方法的异同,包括:供试液制备用稀释剂类型,需氧菌总数(TAMC)和大肠埃希菌检查用供试液浓度、冲洗液及中和剂使用情况,霉菌和酵母菌总数(TYMC)的检查条件。
2.2 镁离子中和剂适用性讨论
2.2.1 镁离子与溶液的相容性
根据《中国药典》2020年版四部通则配方,制备6种无菌溶液:0.9%氯化钠溶液(NS)、pH7.0无菌氯化钠蛋白胨缓冲液(PB)、pH6.8/7.2/7.6磷酸盐缓冲液(PBS6.8/7.2/7.6)和0.1%蛋白胨水溶液(PW)。按照表1要求,在3个温度条件下,观察不同浓度的镁离子在各溶液中是否产生沉淀,判断其相容性。
2.2.2 镁离子对微生物生长的影响
采用TSA培养基,以表面涂布接种的方式,比较中国药典规定的6株测试菌株在2种浓度氯化镁条件下的回收率(表2)。回收率在80%~130%时,认为相应浓度的镁离子则对测试菌株生长无影响。氯化镁溶液添加量不超过培养基体积的10%。
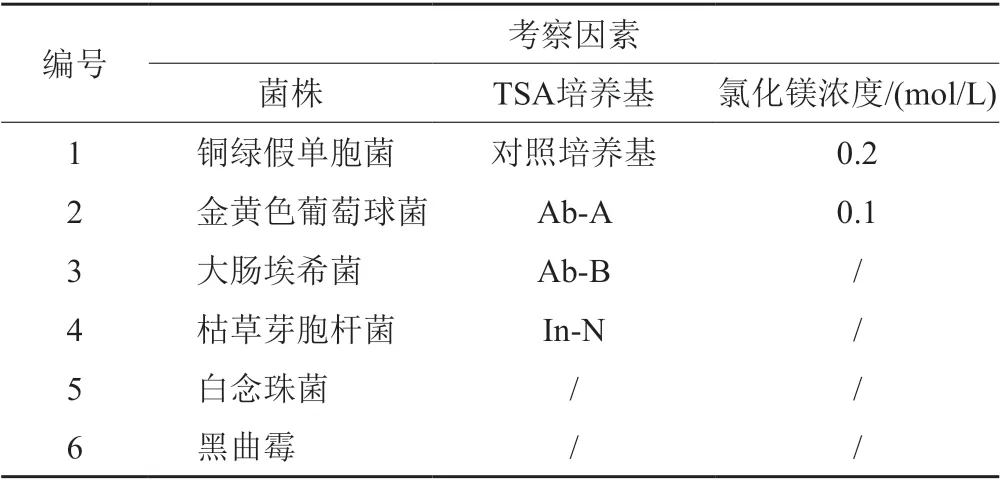
表2 TSA-镁离子对微生物生长的影响条件Tab.2 The condition of different TSA-magnesium affects the growth of test organisms
2.3 稀释剂/冲洗液对微生物生长的影响
在标准比较、文献调研的基础上,制备无菌1%HPCD-1%吐温80-0.1 mol/L氯化镁水溶液(HTMg),测试该冲洗液灭菌后pH。在10 mL/支HTMg溶液中,分别接种表2列举6种测试菌株1000 cfu/0.1 mL,分别在1 h、2 h进行“HTMg-菌液”注皿计数,计算两个时间相对于0 h的回收率,回收率在80%~130%则认为冲洗液对测试菌株生长无影响。
2.4 优化的盐酸莫西沙星片微生物限度检查方法及适用性讨论
以HTMg pH(7.0±0.2)溶液分别制备4个企业盐酸莫西沙星片的1:10,1:100供试液。取1:100供试液上清,按1 mL/膜至100 mL HTMg pH(7.0±0.2)中,全量过滤后,以HTMg pH(7.0±0.2)冲洗3次(100mL/次);将滤膜贴于TSA平板(含0.1 mol/L 氯化镁)检查需氧菌总数。取1:10供试液,按1 mL/皿,依法检查霉菌和酵母菌总数;取1:10供试液上清液10 mL分膜过滤,按5 mL/膜至100 mL HTMg pH(7.0±0.2)中,全量过滤后,以HTMg pH(7.0±0.2)冲洗3次(100 mL/次);取2膜至100 mL的TSB(0.1 mol/L氯化镁)中,依法检查大肠埃希菌。
制备5批次TSA培养基,其中Ab-A、Ab-Y为国外培养基,In-N为国产预制培养基;Ab-A-Mg、Ab-Y-Mg为含0.1 mol/L 氯化镁的TSA平板。
TAMC和大肠埃希菌检查在最后一次冲洗液添加约100 cfu测试菌株,计算回收率;TYMC,在供试液中添加测试菌株,计算回收率;回收率应满足药典要求。
3 结果
3.1 方法分析汇总
对各企业盐酸莫西沙星片质量标准中微生物限度检查方法的汇总结果见表3~4。可见,由于莫西沙星对细菌具有非常强的抗菌活性,其对需氧菌总数(TAMC)、大肠埃希菌检查需要综合使用稀释剂、中和剂、薄膜过滤等多种方式,才能满足方法适用性的要求。

表3 需氧菌总数(TAMC)检查方法汇总列表Tab.3 Summary of TAMC examination methods from different manufactures
在对TAMC的检查中,稀释剂、检测量、薄膜过滤冲洗、TSA培养基是影响试验的关键因素:(1)稀释剂:通过在供试液稀释剂中添加离子/非离子中和剂(吐温80、卵磷脂、HPCD、Mg2+)可抑制莫西沙星的活性,实现第一步预处理;(2)检测量:检测量大部分在0.01 g(1:100供试液1 mL/膜),较低的检测量可降低冲洗难度,但当检测量为0.001 g时,无论标准为1000 cfu/g或是2000 cfu/g,检验结果均存在较大的误判风险[18];(3)薄膜冲洗过程:主要通过调整吐温80、卵磷脂、Mg2+和冲洗量4个因素去除活性成分,冲洗量一般控制在400~1000 mL/膜;(4)TSA培养基:在培养基中添加Mg2+是进一步抑制残留于薄膜上的莫西沙星活性的关键。
大肠埃希菌的检查条件与TAMC基本相同,但由于检测量大(相当于1 g样品),大多采用分膜的方式降低单膜过滤冲洗难度,总冲洗量一般控制在600~3200 mL不等(表4)。鉴于喹诺酮类药物对真菌的抑制作用较弱,霉菌和酵母菌总数(TYMC)检测的实际检测量都在0.05~0.1 g,多采用直接接种法检查(表4)。

表4 大肠埃希菌、霉菌和酵母菌总数(TYMC)检查方法汇总列表Tab.4 Summary of Escherichia coli , TYMC examination methods from different manufactures
通过表3~4汇总可见,各标准中的检查方法在使用时各有其特点,总体而言,对中和剂的使用尚有描述不甚明确的地方,如镁离子(0.2%,12 g/L)的浓度,1:10供试液10 mL薄膜过滤的可操作性,镁离子中和剂的添加方式,镁离子液体在滤膜的作用时间控制等。
3.2 镁离子中和剂的适用性考察
3.2.1 镁离子与溶液的相容性
本部分讨论的6种溶液可以分为两类:不含磷酸盐的NS与0.1%蛋白胨水溶液(PW),含磷酸盐的PB与3种PBS。含有磷酸盐的4种溶液,在“2.2.1镁离子与溶液的相容性”试验中,经121℃、15 min灭菌,不同的镁离子浓度条件下均产生沉淀;不含磷酸盐的2种溶液在此条件下无沉淀;说明镁离子与磷酸盐体系在灭菌过程中会产生沉淀。
在57℃条件下,NS、PW和PBS6.8未见沉淀,PB、PBS7.2、PBS7.6在0.05 mol/L及以上浓度都有沉淀产生(表5)。但室温条件下,各溶液均未产生肉眼可见沉淀。

表5 57℃条件下3种溶液与镁离子相容性结果Tab.5 The results of compatibility between magnesium and solution at 57℃
上述结果提示,镁在碱性和磷酸盐系统中,加热易发生沉淀。这也是表3中,镁离子大多要求在使用时添加的原因。
3.2.2 镁离子对微生物生长的影响
镁离子对微生物生长的影响不仅与镁离子浓度有关,也与镁离子存在时TSA对微生物的促生长能力有关。由表6可见,大部分条件下“TSA-镁离子”培养条件对测试菌株的生长没有影响,但当镁离子在培养基中大的浓度等于或高于0.2 mol/L时,枯草芽胞杆菌的生长受抑制;当镁离子浓度达0.3 mol/L时,大肠埃希菌回收率为0。文献[9]在无菌检查工作中,也证实0.1 mol/L镁离子具有较好的中和效果且对微生物生长无影响。
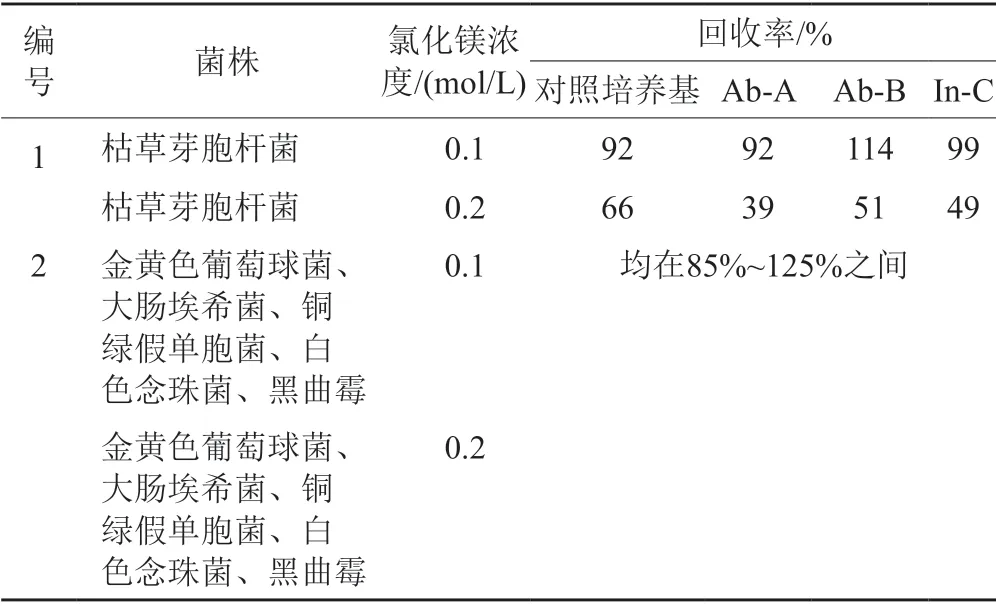
表6 TSA-镁离子对微生物生长的影响Tab.6 The basic attribute of magnesium reagent
3.3 稀释剂/冲洗液对微生物生长的影响
溶解性更好、冲洗效率更高的稀释剂/冲洗液是提高薄膜过滤法效率的重要因素。为了更好地满足实际操作及固化程序,经测试,pH未经调试的1%HPCD-1%吐温80~0.1 mol/L氯化镁水溶液(HTMg),121℃,15 min灭菌后pH约为5.2。此时,虽然HTMg呈偏酸性,但6株测试菌株2 h内回收率稳定,提示HTMg可作为稀释剂/冲洗液使用,详见表7。为更好的满足实际操作并固化操作程序,可适当调整该稀释剂/冲洗液pH用于检验工作。

表7 稀释剂/冲洗液适用性检查结果(%)Tab.7 The suitability results of diluent/flushing fluid(%)
3.4 优化的盐酸莫西沙星片微生物限度检查方法适用性结果
4个企业的产品按照“2.4”中优化的盐酸莫西沙星片微生物限度检查方法进行检验,TAMC、TYMC计数方法条件下,白念珠菌和黑曲霉回收率均在80%~130%范围;大肠埃希菌检查的阳性对照则生长良好。
TAMC检验时,测试细菌的回收情况随产品处方的差异、培养基差异而表现出略有不同(表8):①含有镁离子的TSA对测试菌株的回收更优,提示镁离子对于滤膜残留的活性组分有显著的中和效果。②不含镁离子的3种TSA培养基,虽然均可满足培养基适用性的要求,但当残留有莫西沙星时,生长情况不尽相同;总体而言,金黄色葡萄球菌和枯草芽胞杆菌两个测试菌株可以更敏感地反映检验系统对莫西沙星的去除效率。③相同的冲洗系统对不同企业产品的冲洗效率差异较大,提示制剂处方的差异对检测方法具有一定的影响。
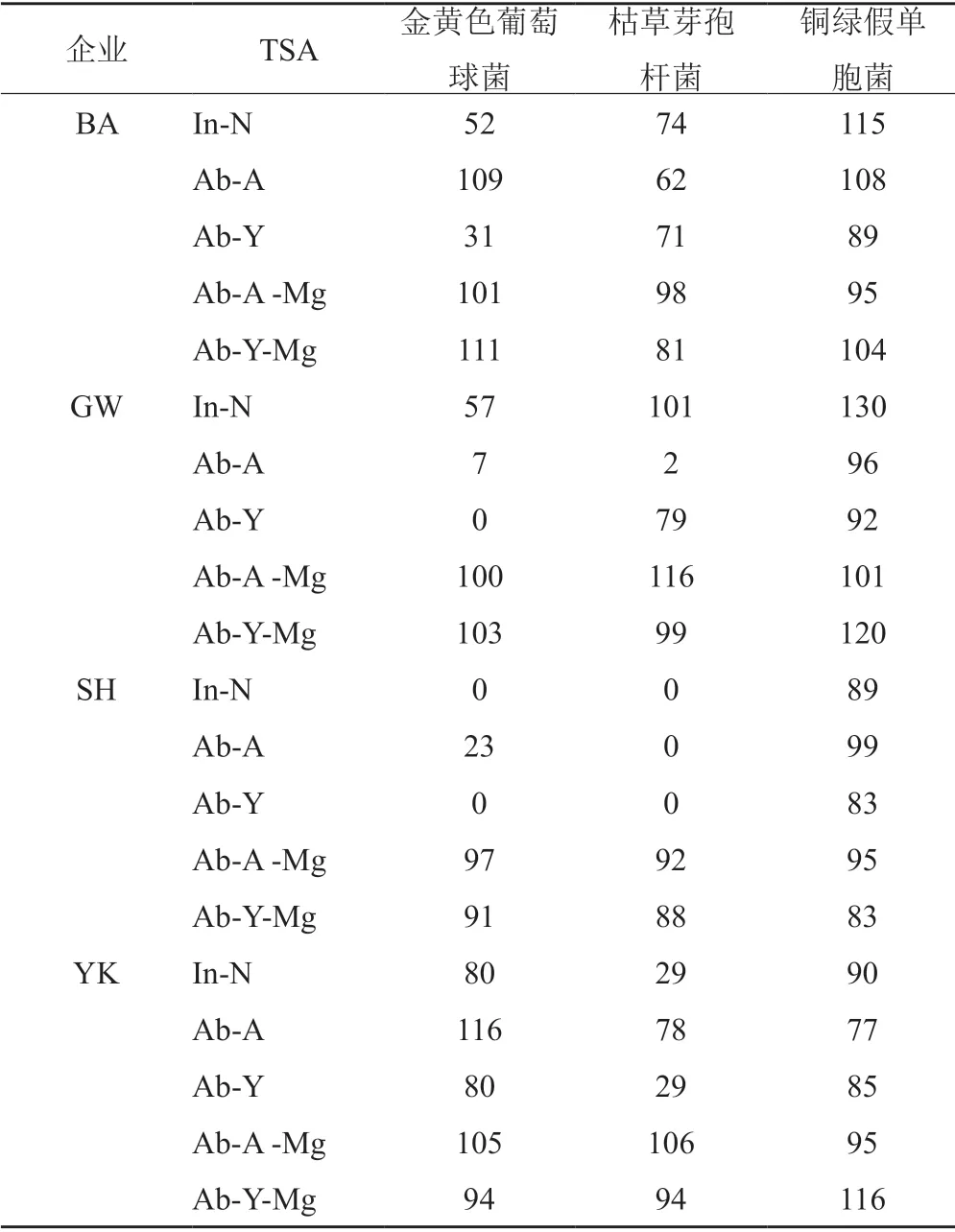
表8 各企业盐酸莫西沙星片TAMC检查测试细菌回收率结果(%)Tab.8 The test strain recovery of TAMC method used for moxifloxacin hydrochloride tablet of different manufactures(%)
TAMC和大肠埃希菌检验用的供试液为不均一的混悬溶液,供试液的颗粒物影响薄膜过滤的效率。因此,薄膜过滤时候可将供试液稍静置,取上清液检测。这也是表3中部分方法要求使用上清液的原因。通常供试液静置0.5 min就能达到较好分离颗粒的效果。
综上所述,本优化方法的冲洗量为400 mL/膜,采用含镁离子(0.1 mol/L)TSA检查TAMC;大肠埃希菌检查的冲洗量为800 mL/2膜,接种于含镁离子(0.1 mol/L)TSB中。稀释剂与冲洗液一致,便于标准化制备,较表3~4中的大部分方法更为简便。本优化方法适用4个企业的盐酸莫西沙星片微生物限度检查,方法具有良好的粗放性。
4 讨论
4.1 中和剂
4.1.1 镁离子
虽然镁离子可显著提高检查方法的冲洗效率[19],但本文结果提示,镁离子与冲洗液、培养基都存在相容性问题,在使用环节有诸多需要注意的事项。相对准确的镁离子浓度直接影响方法的重现性。
无水硫酸镁常用作干燥剂,无水氯化镁也有较强的引湿性。由表9可见,含镁试剂水合物分子量大约是无水物的2倍,若简单以质量分数表示镁离子的实际含量,常易导致镁离子浓度出现偏差。由于结晶水的差异,且水合物的溶质体积较大,因此不建议使用百分质量浓度的方式标示实际的用量。应用时,建议采用容量瓶准确配制特定浓度的浓溶液,使用时按比例稀配至培养基或冲洗液中,以保证离子浓度的准确。镁离子浓溶液添加至培养基时,为保证培养基体系的稳定性,建议添加量不超过培养基体积的10%。

表9 含镁试剂基本属性Tab.9 The basic attribute of magnesium reagent
4.1.2 吐温80、卵磷脂和羟丙基β环糊精
喹诺酮类抗生素分子基本骨架均为氮(杂)双并环结构,水溶性差,成盐后可提高其生物利用度[20]。表3~4以及“2.4”的方法都是以水为基质的体系,部分药品标准收载的方法中采用了吐温80(聚山梨酯80)、卵磷脂、羟丙基β环糊精(HPCD)提高抑菌活性组分在稀释剂/冲洗液中的溶解性,提高冲洗效率去除抑菌成分。
吐温80为非离子表面活性剂,卵磷脂为两性离子表面活性剂,羟丙基β环糊精(HPCD)作为包合材料[21-23]在药物制剂增溶、稳定等方面有广泛的应用。
但吐温80和卵磷脂在水系统中,需要注意乳化效果以保证溶液均一。例如,吐温80在稀释剂/冲洗液中灭菌后容易沉底,需要摇匀;卵磷脂若未经充分乳化立即灭菌,则易结块,难以保证其增溶效果。
4.2 离子浓度、滤膜及培养基
“2.2.1镁离子与溶液的相容性”中的5种溶液均含有无机盐离子,其中pH7.0氯化钠蛋白胨缓冲液和0.9%氯化钠溶液中钠离子的浓度大概0.15 mol/L ;3种PBS均含钠、钾离子,两种阳离子总浓度在PBS6.8中约0.001 mol/L ,在PBS7.2中约0.06 mol/L ,在PBS7.6中约0.05 mol/L 。据此,结合“2.2.2镁离子对微生物生长的影响”的结果,确定优化方法中稀释剂/冲洗液仅含氯化镁一种无机盐,适当以氢氧化钠调pH,阳离子总体浓度约为0.1 mol/L 。
不同供应商的滤器、滤杯可能采用不同尺寸、不同材质的过滤薄膜(醋酸纤维素膜/尼龙膜/聚偏二氟乙烯膜等),在进行测试菌株的回收检查时,可能会影响方法重现。本文采用的滤膜是混合纤维素膜(直径47 mm),未对其他薄膜材质进行验证。表6和表8中涉及的TSA培养基均满足培养基适用性检查的要求,但当培养基系统出现选择性因素(高浓度镁离子、残留的抑菌活性组分),也会造成上述测试菌株的回收失败。因此,当采用不同的滤器及培养基时,应考虑方法的重复性。
4.3 对产品污染微生物的控制
对药品生产的全过程控制包括原辅料前端控制、生产环境洁净控制、生产设备清洁验证、人员卫生防护、生产过程取样检测等环节。目前,微生物污染已经不是化学药品口服固体制剂终产品的主要质量问题。本次抽验涉及上述4个企业共28批样品,微生物限度检查结果全部符合《中国药典》的规定。
《中国药典》2020年版四部通则9202中已明确对诸如盐酸莫西沙星片等化学口服固体制剂,通过风险评估、回顾性验证,可不进行批批放行检验。针对本品,若执行不定期检验,应有完整合理的质量保障体系保证每批产品均符合微生物限度的规定,应有重现性好、易操作的检测方法保证检测结果的有效性。
由本文结果可见,本品不同标准中收载的微生物限度检查方法还存在不甚明确的地方,可能导致实际执行中检查方法不可重现的情况。对此,建议各企业质控部门完善各自SOP,例如TAMC检查时,随行以金黄色葡萄球菌、枯草芽胞杆菌作为阳性对照菌确认检验条件的有效性等。
本文优化的盐酸莫西沙星片的微生物限度检查方法,适用于4个企业的产品,在一定程度上反映了方法本身良好的粗放性、便捷性。但通过本文的讨论,更希望质控人员能结合各自具体的产品,制订各自更具有执行性的SOP,提高自有方法的可执行性及稳定性。

