离子液体中通过ATRP法制备大豆蛋白胶黏剂∗
张泽宇 王 堡 林玥彤 刘笑航 庞久寅
(北华大学木质材料科学与工程重点实验室,吉林省吉林市 132013)
近年来可再生资源的应用备受关注[1]。大豆蛋白作为一种天然高分子可再生材料,在自然界中含量丰富,具有环境友好、生物相容性好等优点,未来可代替化石原料[2-3]。随着大豆分离蛋白纤维、膜及胶黏剂等以大豆分离蛋白为基质的新产品开发及应用,大豆分离蛋白在材料行业中的应用更加广泛[4-6]。然而,大豆蛋白分子内及分子间肽键、二硫键、氢键、疏水作用力等价键的紧密连接,使相邻的多肽链和自身多肽链相交形成紧密的球状结构,导致大豆蛋白的溶解性较低,活性基团被包埋,制约了大豆蛋白的改性及应用研究[7]。
随着人们对无污染清洁技术的日益关注,传统有机试剂被视为具有危害的化学物质。而离子液体作为一种不挥发、不可燃的新型绿色溶剂,对无机、有机化合物以及高分子材料具有良好的溶解性,可将植物蛋白、动物蛋白、纤维素等天然高分子材料溶解、再生以及利用其衍生化反应[8-9],并且离子液体具有强烈的氢键破坏能力,可破坏大豆蛋白复杂的球状结构[10]。
在离子液体中溶解和接枝改性大豆蛋白[11],引入特定的功能基团,赋予大豆蛋白特定的功能特性,在新材料领域拥有良好的应用前景[12-13]。接枝聚合是在大豆蛋白的表面引入各种功能性高分子,从而改善大豆蛋白的物理及化学性质的有效手段[14-16]。目前聚合方法主要有离子型活性聚合[17]、基团转移聚合[18]、等离子体聚合[19]、点击化学[20]及自由基活性可控聚合[21-23]等。原子转移自由基聚合(ATRP)通过利用活性种与休眠种之间的动态平衡,实现对聚合反应的控制[24-27],将甲基丙烯酸缩水甘油酯(GMA)接枝到大豆蛋白分子表面。本研究以(2-溴异丁基)功能化大豆蛋白的大分子引发剂为ATRP的起始位点,以CuBr/PMDETA为催化剂体系,应用ATRP技术制备大豆蛋白-甲基丙烯酸缩水甘油酯共聚物(SPI-g-PGMA)。
1 材料与方法
1.1 材料
大豆分离蛋白(SPI),苏州美亿辰生物科技有限公司;2-溴代异丁酰溴(纯度98%)、N,N,N',N″,N″-五甲基-二乙烯三胺(PMDETA,纯度99%)、甲基丙烯酸缩水甘油酯(GMA)、1-丁基-2,3-二甲基咪唑氯盐、亚硫酸氢钠(NaHSO3),阿拉丁工业公司;甲醇、4-二甲氨基吡啶(DMAP,纯度99%)、四氢呋喃(THF),南京试剂化工有限公司;N,N-二甲基甲酰胺(DMF)、溴化亚铜(CuBr),上海麦克林生化科技有限公司;中性Al2O3柱,宁波鸿谱仪器科技有限公司。
1.2 设备
智能油浴锅(DF-101S),力辰科技仪器有限公司;磁力搅拌器(JJ-1A),金坛市富华仪器有限公司;热压机(DQ),上海人造板机器厂;精密推台踞(RT-SB 250 U),新马木工机械设备有限公司;傅里叶红外光谱仪(WQF-510A FT-IR),德国布鲁克公司。
1.3 大豆蛋白预处理
首先将大豆分离蛋白分散于去离子水(1∶100,w/v)中,在温度30 ℃下用磁力搅拌器搅拌30 min。然后将1 mg/mL的离子液体/4 %(质量分数)的NaHSO3或两者的混合物加入到悬浮液中,30 ℃搅拌2 h,最后将SPI悬浮液在转速 3 000 r/min的条件下离心10 min,收集上清液冷冻干燥备用。在相同的条件下,以不含离子液体与亚硫酸氢钠的磁性搅拌装置处理为对照。
1.4 大豆蛋白大分子引发剂合成
取1.00 g 预处理后的大豆蛋白粉末和0.578 7 g DMAP溶解在20 mL无水DMF中并放置于冰水浴中,然后缓慢加入2-溴代异丁酰溴0.585 mL,在室温下搅拌反应24 h。反应结束后将该反应液滴入大量蒸馏水中,并用蒸馏水重复洗涤3~5 次,冷冻干燥得到大豆蛋白大分子引发剂(SPI-Br)。
1.5 大豆蛋白接枝共聚物合成
在100 mL的Schlenk瓶中加入 SPI-Br 32.8 mg、9 mL THF和1 mL DMF,在室温下搅拌0.5 h,再加入配体PMDETA 10.8 mg、GMA 8.45 mL,经过一段时间的充氮过程后,加入CuBr,再经过一段时间的充氮后将其放入80 ℃的油浴中。反应一段时间后反应液通过中性Al2O3柱,再利用冷甲醇作为沉淀剂多次沉淀,冷冻干燥后得到接枝共聚物(SPI-g-PGMA)。
1.6 胶合板制备
三层胶合板:尺寸为 300 mm×300 mm,单板含水率为6%~8%,平均厚度为1.2 mm;手工涂胶,涂胶量为300~320 g /m2。室温下陈化20 min,在单位压力1.5 MPa、温度为120 ℃、固化时间900 s下进行热压。室温下放置3 d进行检测。
1.7 胶合强度检测
用游标卡尺检查试件是否合格,按 GB/T 9846—2015《普通胶合板》中规定的Ⅱ类胶合板检测方法测试胶合强度。
1.8 正交试验设计
选择L9(34)正交试验方案设计正交试验,以甲基丙烯酸缩水甘油酯质量、溴化亚铜质量、油浴时间为试验因素,每个因素取3 个水平,如表1 所示。

表1 正交试验因素和水平Tab.1 Factor and level of orthogonal experiment
1.9 傅里叶红外光谱分析
将大豆蛋白、大豆蛋白大分子引发剂、大豆蛋白接枝共聚物干燥后用溴化钾压片法制备样品,利用傅里叶红外光谱仪进行光谱分析,波数为400~4 000 cm-1,扫描 32 次,分辨率4 cm-1。
2 结果与分析
2.1 预处理后大豆蛋白的结构分析
大豆蛋白具有紧密球状结构,分子之间互相缠绕包裏,屏蔽了活性位点,加大空间位阻,不利于接枝反应的进行。因此在大豆蛋白接枝改性前,先对其进行预处理,强化反应活性。
图1为未改性的大豆蛋白与经过预处理的大豆蛋白的红外光谱对比图。对比可知,1 550 cm-1处连接氢键的N—H(O…H—NH)的弯曲振动吸收峰有所增加,这是由于1-丁基-2,3-二甲基咪唑氯盐中N—H的存在会与大豆蛋白分子间形成部分氢键,而导致峰强增强。NaHSO3改性后的大豆蛋白在此处峰强度降低,说明存在氢键断裂,为亚硫酸氢根的弱酸性起作用所致;1 710 cm-1处为大豆蛋白羧基(—COOH)中的羰基(—C==O)形成的氢键伸缩振动吸收峰,吸收峰的消失表明改性大豆蛋白成功。在3 400 cm-1处依旧由较为尖锐的特征峰形变化为较为平滑的吸收峰,表明硫酸氢钠处理破坏了大豆蛋白原有分子内的氢键结构。比较未改性大豆蛋白,改性后的大豆蛋白,在2 360 cm-1处的吸收峰明显显现,这是由于大豆蛋白高级结构展开程度加大,暴露了脯氨酸、组氨酸等,生成—NH+与—NH2+。并且亚硫酸氢钠和离子液体共同处理对大豆蛋白的破坏程度更大,振动吸收峰更加明显, 2 960 cm-1处端甲基的伸缩振动吸收峰更为显著,说明大豆蛋白紧密的高级结构展开,端甲基更为明显。二硫键是影响大豆蛋白弯曲性、展开性和溶解度的主要分子作用力之一。NaHSO3是一种还原剂,可以加速展开并溶解球状蛋白,有效地裂解二硫化物之间和内部的键。在7S球蛋白的三级结构中,半胱氨酸残基侧链两两结合,形成二硫键(—S—S—),11S球蛋白中半胱氨酸残基侧链一部分以二硫键形式存在,一部分以—SH形式存在,505~540 cm-1处特征峰的变化表示二硫键的断裂情况,峰强度降低说明在NaHSO3作用下大豆蛋白的二硫键含量明显降低。505 cm-1处二硫键(S—S)的振动吸收峰减弱,说明离子液体也可以帮助二硫键断裂。破坏原本水分子间的全氢键水结构,部分氢键结构增多,原本水中较稳定的四面体氢键网络结构被打破。图2 为未改性大豆蛋白(SPI)与预处理大豆蛋白(SPI)的接触角。由图可知,经离子液体预处理的SPI(b)被破坏程度加大,亲水性增强。SPI经NaHSO3处理后(c),由于HSO3-呈酸性,溶液的pH降低,其α-螺旋结构向β-折叠结构转化,α-螺旋结构减少,表面暴露的疏水位点增多,疏水性增强,接触角增大。混合处理的SPI(d)的接触角在前述两者之间,接触角的变化也证明了大豆蛋白高级结构被破坏。

图1 大豆蛋白素材与预处理大豆蛋白的红外光谱图Fig.1 FT-IR spectra of SPI and pre-modified SPI

图2 大豆蛋白素材与预处理大豆蛋白的接触角Fig.2 Contact angle between SPI and premodified SPI
2.2 SPI-g-PGMA胶合强度
由表2可知,反应过程中,影响胶合强度的主要因素排序为油浴时间>溴化亚铜>甲基丙烯酸缩水甘油酯。在其他条件相同的情况下,因素的最佳组合为A2B2C3。确定优化工艺参数为GMA 140 mL,CuBr 147.2 mg,油浴时间为3 h,此时胶的质量较好,压板效果较佳,胶合强度达到1.44 MPa,符合国家标准GB/T 9846—2015 Ⅱ类胶合板要求。

表2 正交试验设计及胶合强度检测结果Tab.2 Experimental design and test results of bonding strength
利用SPSS19.0软件进行数据处理,结果见表3。由表3可知,在95%置信区间内,溴化亚铜的质量和油浴时间的显著性小于0.05,差异显著,而甲基丙烯酸缩水甘油酯质量的显著性大于0.05,差异不显著。比较而言,油浴时间对胶合强度的影响最大,其次是溴化亚铜的质量。
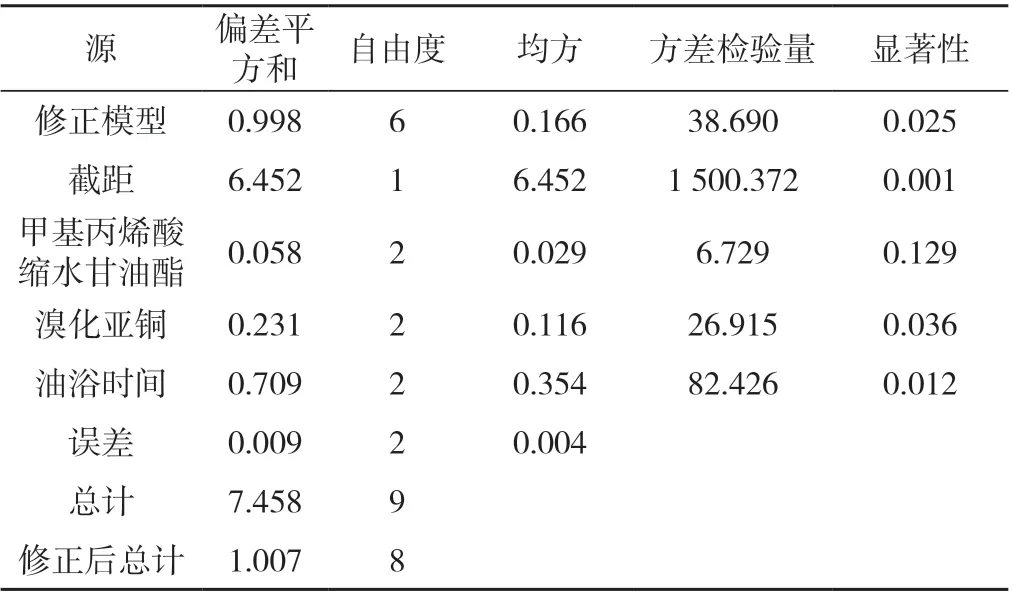
表3 胶合强度检测结果显著性分析Tab. 3 Significance analysis of the test results of adhesive strength
2.3 红外光谱分析
图3为大豆分离蛋白(SPI)、大豆蛋白大分子引发剂(SPI-Br)及大豆蛋白甲基丙烯酸缩水甘油酯共聚物(SPI-g-PGMA)的红外光谱对比图。图中a为SPI素材,b为SPI-Br,c为SPI-g-PGMA,624 cm-1处为C—Br的反式构象伸缩振动吸收峰,939 cm-1和847 cm-1处为环氧基团的特征振动峰;1 159 cm-1和1 242 cm-1处为酯键的特征伸缩振动带[—(C==O)O—];1 740 cm-1有明显的酯羰基伸缩振动峰(—C==O),GMA特征基团吸收峰的出现证明了SPI-g-PGMA的成功合成。

图3 大豆蛋白素材、大豆蛋白大分子引发剂与大豆蛋白甲基丙烯酸缩水甘油酯的红外光谱图Fig.3 FT-IR spectra of SPI、SPI-Br and SPI-g-PGMA
3 结论
本研究采用原子转移自由基聚合法,以CuBr/PMDETA作为催化剂体系,制备大豆蛋白-甲基丙烯酸缩水甘油酯共聚物(SPI-g-PGMA),并检测所得大豆蛋白胶黏剂的胶合强度。研究表明:离子液体预处理打开了大豆蛋白的高级结构,增大了大豆蛋白的溶解性。大豆蛋白大分子引发剂及大豆蛋白甲基丙烯酸缩水甘油酯共聚物成功制备,并且在GMA 为140 mL,CuBr为147.2 mg,油浴时间为3 h时,用其压制的胶合板性能较优,胶合强度可达1.44 MPa,符合国家标准 GB/T 9846—2015 Ⅱ类胶合板要求。

