短暂清除小胶质细胞减缓光诱导损伤小鼠视网膜视功能退变
饶必林 肖家怡 林鑫 臧科多 谭航 汤纯 张军 高美玲
作者单位:温州医科大学附属眼视光医院 眼视光与视觉科学国家重点实验室 视网膜生理和疾病研究组,温州 325027
光线是视觉形成的必要因素,但长期较强的光照会造成视网膜光感受器和视网膜色素上皮细胞的凋亡,称之为光毒性。流行病学研究表明,可见光照射是视网膜变性,尤其是年龄相关性黄斑变性(AMD)发生和病变的危险因素,因此视网膜光损伤的研究在临床眼科和视觉科学中占有重要的地位。在AMD中,光感受器细胞变性是不可逆性视力丧失的主要原因。小胶质细胞是视网膜内的常驻免疫细胞,在免疫监视和宿主防御中发挥重要作用,但其在视网膜变性中究竟是起神经保护还是神经毒性作用仍不明确。在光感受器细胞变性刺激下,小胶质细胞的激活增加,活化的小胶质细胞会产生大量的促炎细胞因子和趋化因子。有研究表明通过干预小胶质细胞免疫反应可以减轻光感受器细胞的损伤,保持视网膜结构和功能的完整性。集落刺激因子1受体(Colony stimulating factor 1 receptor,CSF1R)小分子抑制剂可以选择性地消除中枢神经系统中的小胶质细胞,已被广泛用于生理和病理条件下小胶质细胞起源、复制和功能发挥的研究。本研究旨在通过构建稳定的光诱导视网膜损伤模型,利用CSF1小分子抑制剂短暂清除小胶质细胞,研究其能否减缓急性光诱导的视网膜损伤,以期制定1种通过调节小胶质细胞来抑制视网膜变性的策略。
1.料与方法
1.1.料
1.1.1.验动物 选取ICR雄性白化小鼠30只,8周龄,体质量为22~24 g,购自上海杰思捷实验动物技术有限公司。所有动物均饲养在温度为25 ℃,相对湿度为70%的环境中,光照和黑暗周期为12 h,并给予充足的饲料和水。实验动物的饲养和使用均严格遵守国家技术委员会颁布的《实验动物质量管理办法》。
1.1.2.要试剂及仪器 TUNEL试剂盒(0000452295,Promega公司);兔抗鼠Cone-arrestin抗体(AB15282,1:400,美国Millipore公司)、鼠抗C-terminalbindingprotein-2(CtBP2)抗体(612044,1:100,美国BD公司)、兔抗Protein kinase C-ɑ(PKC-ɑ)抗体(P4334,1:300,德国Sigma公司)、兔抗IBA1抗体(019-19741,1:400,日本WAKO公司)、鼠抗CD68抗体(MCA1957,1:400,美国Bio-Rad公司),Alexa Fluor 488偶联驴抗鼠IgG(715-545-150,1:500,美国Jackson公司),Alexa Fluor 594 偶联驴抗兔IgG(711-585-152,1:500,美国Jackson公司);小分子抑制剂PLX5622(S887405,美国Selleck公司);超高分辨率激光共聚焦显微镜(LSM880,德国蔡司公司),罗兰视觉电生理仪(RETI-Port 21,德国罗兰公司),体式显微镜(SZM0850,深圳微特视界科技有限公司)。
1.2.法
1.2.1.组及造模 将30只ICR小鼠随机分为对照组、光损伤组和清除小胶质细胞组,每组10只。光损伤组小鼠在光照前进行24 h暗适应,随后将小鼠暴露于15 000 lx的白光下,照射20 h;结束光照后置于黑暗饲养条件下过夜,并转入正常光照周期,直到5 d后利用视网膜电图(ERG)检查视网膜功能。清除小胶质细胞组则先连续5 d以腹腔注射的方式给予20 µl浓度为100 mmol/L的PLX5622溶液,之后暴露于15 000 lux白光下20 h,紧接着连续注射3 d PLX5622溶液,直至取材。
1.2.2.RG检测 强光照射结束后5 d,通过对ICR小鼠进行ERG检查,评价视网膜功能。ERG检查前小鼠暗适应8 h,腹腔注射0.8%的戊巴比妥钠进行麻醉,并用1%托吡卡胺进行散瞳。将引导电极轻触摸角膜,参考电极置于耳后皮下,接地电极连接尾巴根部。按照暗适应0.01,暗适应3.0,暗适应10.0,暗适应3.0振荡电位,明适应3.0和明适应闪烁3.0 的程序记录双眼的反应,取a、b波振幅平均值进行统计分析。
1.2.3.UNEL试验 采用细胞凋亡原位检测试剂盒对视网膜切片进行TUNEL染色。将30 μm的视网膜冰冻切片晾干,用磷酸盐缓冲盐水(PBS)洗涤5 min,重复3次。0.2%的TritonX-100穿透5 min;加入平衡液平衡10 min,弃平衡液;加入含有平衡缓冲液、核苷酸和rTdT酶混合物;盖上塑料盖玻片,37 ℃避光孵育1 h。移除塑料盖玻片,加入2X SSC终止反应,封片,置于超高分辨率激光共聚焦显微镜下观察拍照。
1.2.4.疫荧光染色 分别采集各组小鼠的眼球并解剖得到视网膜,将其置于4%多聚甲醛(Polyformaldehyde,PFA)中固定40 min,经10%,20%和30%蔗糖脱水后进行OCT包埋,然后冰切。切片用兔抗Cone-arrestin抗体、鼠抗C-terminalbindingprotein-2(CtBP2)抗体、兔抗Protein kinase C-ɑ(PKC-ɑ)抗体、兔抗IBA1抗体、鼠抗CD68抗体等一抗过夜孵育;用Alexa Fluor 594偶联驴抗兔和Alexa Fluor 488偶联驴抗鼠二抗对切片进行染色。DAPI染色检测细胞核。
1.2.5.聚焦显微镜成像及图像分析 将免疫荧光染色后的视网膜切片或铺片置于超高分辨率激光共聚焦显微镜下成像。对于TUNEL切片染色都选取视神经附近的切片,统计该片上所有TUNEL阳性细胞数量;视网膜铺片则将其平均分为4个象限,每个象限在距离视神经大约0.5 mm的位置拍1 张图片,该图片包含视神经纤维层(Retinal nerve fiber layer,RNFL),内网状层(Inner plexiform layer,IPL),外网状层(Outer plexiform layer,OPL)和外核层(Outer nuclear layer,ONL)层,统计各层小胶质细胞的数量。
1.3.计学方法
实验研究。采用IBM SPSS Statistics(26版)统计学软件进行统计分析。每组数据先进行方差齐性检验,组间数据比较采用单因素方差分析,若方差齐性,则选用LSD比较;方差不齐,则选用Tamhane’s T2(M)比较。以P
<0.05为差异有统计学意义。2.果
2.1.损伤模型的建立
相比于对照组,光损伤组在暗适应ERG反应中a波和b波的振幅均出现显著性下降,差异有统计学意义(P
<0.001,P
=0.008)(见图1A-B),说明光损伤组的光感受器细胞层和双极细胞层出现功能障碍。TUNEL染色结果显示,对照组基本上无TUNEL阳性细胞,而光损伤组在神经节细胞层,内核层及外核层均有TUNEL阳性细胞出现。统计结果显示,外核层TUNEL阳性细胞数量增加,差异有统计学意义(P
=0.035)(见图1C-D)。上述结果表明,光诱导小鼠视网膜损伤后ERG反应显著下降,凋亡细胞显著增多,说明本研究成功建立了稳定的光损伤模型。
图1.强光造成ICR小鼠视网膜损伤A:代表性的ERG记录;B:视网膜电图a波和b波的振幅统计(柱高和误差柱代表平均值和SD,n=24);C:小鼠视网膜切片TUNEL染色,绿色为TUNEL阳性信号,蓝色为DAPI信号(标尺=50 μm);D:小鼠各核层TUNEL阳性细胞数量统计(柱高和误差柱代表平均值和SEM,n=3,每只小鼠在视神经附近选取2~3张切片染色)。Control表示对照组,LD5表示光损伤组;a,P<0.05;b,P<0.01;c,P<0.001Figure 1.Strong light cause ICr retinal damage.A:A representative ERG records.B:Statistics of the ERG a wave and b wave amplitude (column height and error bars represent mean value and SD,n=24).C:TUNEL staining of mouse retinal sections,green represents TUNEL positive signal,blue represents DAPI signal (Bar=50 μm).D:Statistics of TUNEL positive cells in each nuclear layer of mouse retina (column height and error bars represent mean value and SEM,n=3,2-3 sections were selected near the optic nerve from each mouse).Control represents the control group,and LD5 represents light damage group;ERG,electroretinogram;SD,standard error of mean;SEM,standard error of mean.a,P<0.05;b,P<0.01;c,P<0.001.
2.2.损伤后视网膜小胶质细胞的变化
对照组小胶质细胞主要分布在IPL和OPL,在内核层和外核层鲜有小胶质细胞胞体出现,但光损伤5 d后,激活的小胶质细胞数量增多,并向外核层甚至视网膜下腔迁移(见图2A、B)。视网膜铺片染色的结果与切片染色一致,可以看到相较于对照组,光损伤组在外网层的小胶质细胞数目明显增加。此外,对照组中的小胶质细胞的特点为胞体小,分枝细且长,呈典型的静息状态;但光损伤组小胶质细胞除了数目增多外,胞体变大,分枝短而粗,呈变形虫样,是典型的激活状态(见图2B)。对分布在外网状层和外核层的小胶质细胞进行统计,光损伤组相较于对照组小胶质细胞增多,差异有统计学意义(P
<0.001)(见图2D)。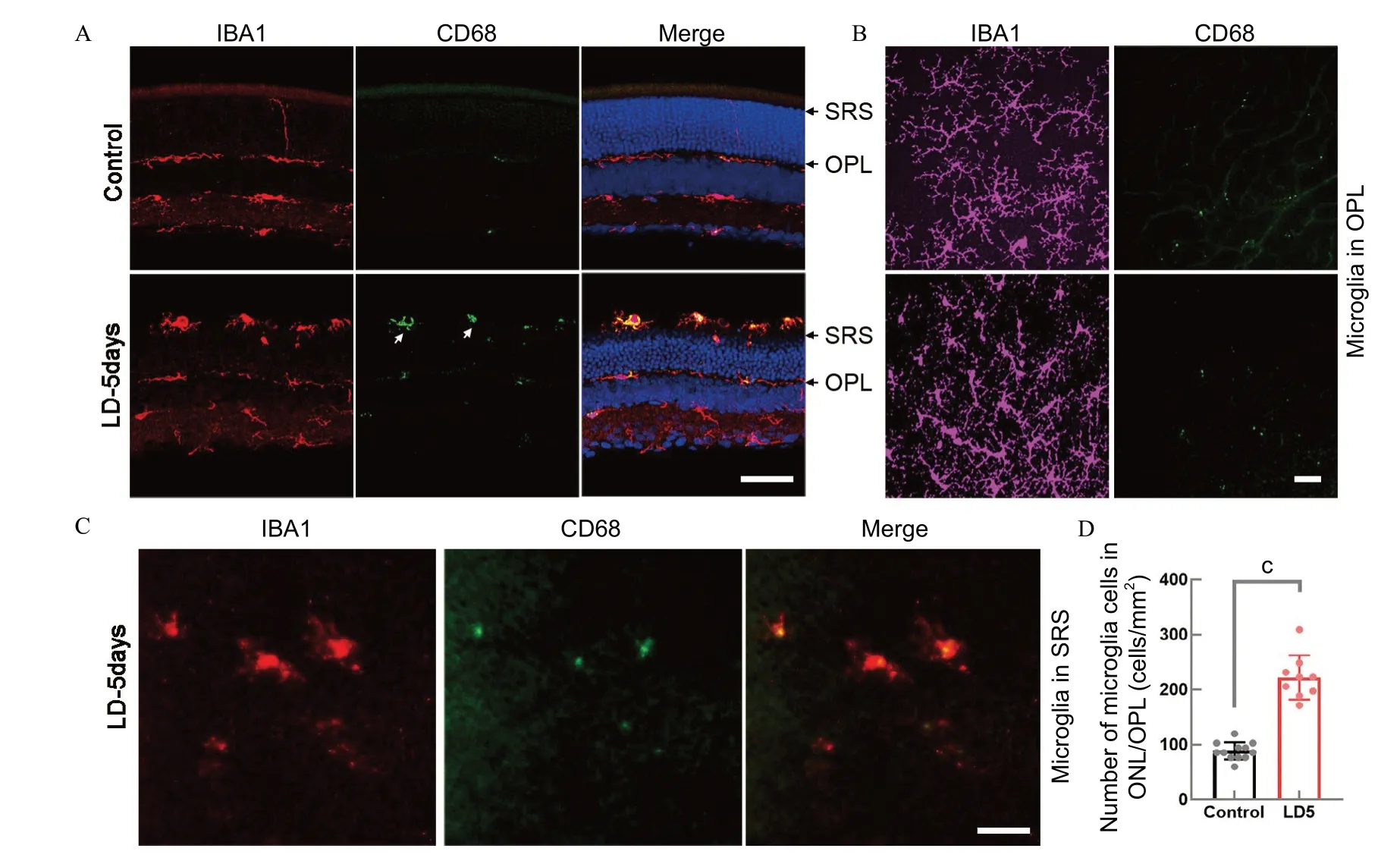
图2.光损伤导致小胶质细胞的增殖激活和迁移A:小鼠视网膜切片染色,红色表示IBA1信号,绿色表示CD68信号,蓝色表示DAPI信号,SRS表示视网膜下腔,OPL表示外网状层。B:小鼠视网膜铺片染色,紫色表示IBA1信号,绿色表示CD68信号。C:光损伤组视网膜下腔小胶质细胞分布情况,红色表示IBA1信号,绿色表示CD68信号。D:视网膜铺片外网状层和外核层小胶质细胞的统计结果,黑色为对照组,红色为光损伤组(柱高和误差柱代表平均值和SD,n=3,每个视网膜拍3~4张照片)。标尺=50 μm;c,P<0.001Figure 2.Light damage leads to proliferation,activation and migration of microgliaA:Staining of mouse retinal sections,red indicates IBA1 signal,green indicates CD68 signal,blue indicates DAPI signal,SRS indicates subretinal space,OPL indicates outer plexiform layer.B:Retinal whole-mount staining,purple indicates IBA1 signal,green indicates CD68 signal.C:Distribution of microglia in the subretinal lumen of the light damage group,red indicates IBA1 signal,green indicates CD68 signal.D:Statistical results of microglia in the retinal outer plexiform layer and outer nuclear layer.Black represents the control group,and red represents the light-damaged group (column height and error bar represent mean value and SD,n=3,3-4 photos per retina).SRS,subretinal space;OPL,outer nuclera layer;Bar=50 μm;c,P<0.001.
2.3.除小胶质细胞减少光损伤造成的细胞凋亡
小胶质细胞的清除策略见图3A。视网膜切片免疫组织化学结果显示,清除小胶质细胞使光损伤引起活化的小胶质细胞数量减少,浸润到视网膜下腔和外核层的小胶质细胞也显著减少,见图3B。视网膜铺片免疫组织化学直观体现了OPL/ONL小胶质细胞数量的减少,且差异有统计学意义(P
=0.027),见图3C-D。与之相符的是,清除小胶质细胞后由光损伤造成视网膜TUNEL阳性细胞数量明显减少,主要体现在OPL(见图3E-F)。
图3.清除小胶质细胞对光损伤后视网膜的保护作用A:小胶质细胞的清除策略图;B:各组视网膜切片有代表性的免疫荧光图,红色信号表示IBA1信号,绿色信号表示CD68信号,蓝色信号表示DAPI信号;C:小鼠视网膜铺片免疫组织化学,红色表示IBA1信号;D:视网膜铺片外网状层和外核层小胶质细胞数目的统计结果,1表示光损伤组,2表示小胶质细胞清除组(柱高和误差柱代表平均值和SEM,n=3,每个视网膜拍3~4张);E:小鼠视网膜切片TUNEL染色,绿色为TUNEL阳性信号,蓝色为DAPI信号;F:小鼠视网膜各核层TUNEL阳性细胞统计结果(柱高和误差柱代表平均值和SEM,n=3~4,每个眼球染3张切片)。标尺=50 μm;aP<0.05Figure 3.Protective effect of microglia depletion on retina after light damageA:Microglia clearance strategy.B:Representative immunofluorescence images of each group,red signal represents IBA1 positive cells,green signal represents CD68 positive cells,and blue signal represents DAPI positive cells.C:Retinal whole-mount immunohistochemistry,red signal represents IBA1.D:Statistical results of the number of microglia in the retinal outer plexiform layer and outer nuclear layer,1 represents the light damage group,2 represents the microglia depletion group (column height and error bars represent mean value and SEM,n=3,3-4 shots per retina).E:TUNEL staining of mouse retina section,green is TUNEL positive signal,blue is the DAPI signal.F:Statistical results of TUNEL positive cells in each nuclear layer of the mouse retina (column height and error bars represent mean value and SEM,n=3-4,each eyeball is stained with 3 slices).SEM,standard error of mean;Bar=50 μm;a,P<0.05.
2.4.胶质细胞的清除对突触的影响
突触前和突触后的形态学改变(如结构和数量的异常)会影响突触传递。因此,本研究检测了突触前相关蛋白CtBP2的表达情况和与突触后靶点密切相关的PKC-α信号。视网膜切片免疫组织化学结果显示,与对照组相比,光损伤组的CtBP2信号明显减弱,但小胶质细胞清除组相比于光损伤组CtBP2信号减弱程度较轻(见图4A)。PKC-α的免疫组织化学结果显示,双极细胞的信号传递在光损伤后,也出现明显的减弱;但小胶质细胞清除组较于光损伤组有一定程度的增强(见图4B)。
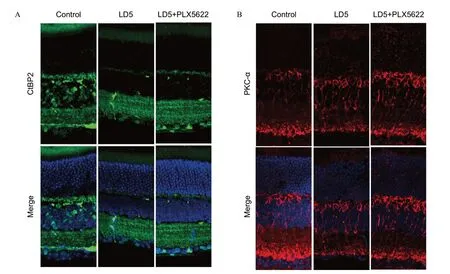
图4.清除小胶质细胞保护细胞间信号传递A:CtBP2免疫组织化学结果,绿色表示CtBP2信号,蓝色表示DAPI信号;B:PKC-α免疫组织化学结果,红色表示PKC-α信号,蓝色表示DAPI信号。标尺=10 μmFigure 4.Microglia depletion protects intercellular signaling transmission.A:Immunohistochemical results of CtBP2 (green) and DAPI (blue).B:Immunohistochemical results of PKC-α (red) and DAPI (blue);Bar=10 μm.
2.5.除小胶质细胞减缓光诱导感光细胞功能损伤
从上述结果可知,光损伤会引起视网膜感光细胞的凋亡,所以本研究探究了视锥细胞的外节长度变化。免疫组织化学结果显示,光损伤后视锥细胞的外节变短;小胶质细胞清除组中视锥细胞外节长度几乎维持在正常水平(见图5A)。统计结果显示,光损伤组与小胶质细胞清除组的外节长度差异有统计学意义(P
<0.001),且对照组与小胶质细胞清除组差异无统计学意义,见图5B。ERG的结果表明,光损伤前是否注射PLX5622 对ERG反应无显著影响;但注射PLX5622 后,ERG反应损伤程度减轻,但差异不具有统计学意义(见图5C-D)。
图5.清除小胶质细胞对光损伤后视网膜功能的影响A:Cone-arrestin免疫组织化学结果;B:视锥细胞外节统计结果,1 代表对照组,2 代表光损伤组,3 代表小胶质细胞清除组;C:代表性的视网膜电图记录;D:视网膜电图b波的振幅统计,灰色表示未注射PLX5622,红色表示注射PLX5622(柱高和误差柱代表平均值和SD,Non PLX5622 n=10,PLX5622 n=8);标尺=20 μm,cP<0.001Figure 5.The effects of microglia depletion on retinal function after light damageA:Cone-arrestin immunohistochemical results.B:Statistical results of cone outer segment length,1 represents the control group,2 represents the light damage group,and 3 represents the microglia depletion group.C:Representative electroretinogram records.D:Amplitude statistics of ERG b wave,gray indicates no injection PLX5622,red indicates injection PLX5622 (column height and error bars represent mean value and SD,Non PLX5622 n=10,PLX5622 n=8);Bar=20 μm,cP<0.001.
3.论
实验性光诱导视网膜变性构建模型已被广泛用于视网膜疾病相关机制的研究中。与遗传性视网膜变性相比,光损伤模型具有如下优点,首先它不依赖于动物的遗传缺陷和年龄;其次,由于视网膜变性是诱发的,研究人员可以通过调节光照强度、曝光时间和光谱来控制视网膜退化的程度。但在照射过程中,要注意笼中小鼠的密度,防止出现个体差异大的情况。本研究以对光诱导视网膜损伤极其敏感的白化小鼠作为动物模型,15 000 lx的白光照射白化小鼠20 h,成功造成小鼠视网膜功能下降和感光细胞变性。上述结果表明本研究成功构建了稳定的光诱导视网膜损伤模型。
当光照诱导视网膜发生损伤后,负责监控视网膜微环境的小胶质细胞被激活,活化的小胶质细胞将产生促炎因子和趋化因子,如CCL2调节小胶质细胞的迁移,使其在神经元损伤部位出现并聚集。研究发现视网膜小胶质细胞浸润到OPL,通过吞噬作用清除凋亡变性的光感受器,并进一步分泌促进光感受器凋亡的促炎细胞因子。与之相似的是,本研究发现在光损伤后,小胶质细胞被激活,其形态和结构发生变化;随着时间的推移,活化的小胶质细胞逐渐从IPL向OPL甚至视网膜下腔迁移,到达光感受器损伤部位。光损伤组分布在OPL/ONL中小胶质细胞的数目相较于对照组显著增多。
有学者认为小胶质细胞可以清除受损视网膜中凋亡的光感受器和细胞碎片,从而有利于光感受器的存活,但也有人认为小胶质细胞的活化及其细胞炎性反应可能是视网膜变性发病机制的早期改变,小胶质细胞的持续活化将最终导致视网膜功能和结构的损伤。除了光诱导视网膜变性模型,在遗传性视网膜变性中小胶质细胞的激活甚至比光感受器细胞凋亡发生的更早,而且激活的小胶质细胞吞噬活的光感受器细胞,可能是加速视网膜变性的关键。利用四环素调节免疫反应可以挽救幼年神经元蜡样脂褐质病小鼠光照引起的视网膜病变,而通过腺相关病毒(Adeno-associated virus,AAV)过表达TGF-β1来调节小胶质细胞的激活,也可以保护遗传性视网膜病变小鼠中视锥细胞的凋亡。因此,通过调节小胶质细胞的激活以及免疫调节治疗可能成为挽救视网膜变性的潜在手段。
CSF1R主要表达在髓系细胞中,尤其是巨噬细胞和小胶质细胞。该受体介导的信号通路对于髓系细胞的存活、增殖和迁移等功能均具有重要作用。早期研究者通过该基因敲除的小鼠来研究免疫细胞缺失的影响,但由于该基因的重要性,敲除小鼠表现出诸多弊端。直至2014 年,Elmore等开发了CSF1R的小分子抑制剂,可以在短期内清除小胶质细胞,开启了小胶质细胞研究的新纪元。他们的研究表明,持续使用CSF1R小分子抑制剂可以抑制斑块形成,并显著改善阿尔兹海默症小鼠模型的学习和记忆功能。此外,在创伤性脑损伤模型中,损伤后通过CSF1R小分子抑制剂短暂清除小胶质细胞,可以显著改善神经病变和认知功能。因此,本研究尝试通过CSF1R小分子抑制剂短暂清除小胶质细胞干预光照引起的视网膜变性。
既往研究表明光诱导小鼠视网膜损伤后,小胶质细胞迅速激活,于光照后6 h便可在OPL观察到迁移的小胶质细胞,而在小鼠饲料中添加或者通过腹腔注射小分子抑制剂PLX5622,需要1周左右才可以显著清除视网膜小胶质细胞。为了排除小胶质细胞早期激活对光感受器细胞的影响,本研究在光诱导损伤前5 d开始通过腹腔注射PLX5622进行处理,试图在光损伤前杀死大部分小胶质细胞,并在损伤后继续注射PLX5622,排除短期内小胶质细胞对光感受器细胞的影响。清除小胶质细胞后,发现被激活的小胶质细胞数量显著减少,同时分布在OPL/ONL的小胶质细胞数量也随之减少,进一步分析发现光感受器凋亡的数量也减少,一定程度上缓解了急性光损伤导致的光感受器损伤。通过突触相关蛋白和双极细胞的免疫组化结果发现短期清除小胶质细胞对光损伤后视网膜的信号传导有一定的保护作用。最后ERG显示清除小胶质细胞对视网膜功能有保护作用,但差异不具有统计学意义。因此在急性光诱导视网膜损伤模型中,小胶质细胞的迅速活化和增殖可能引发了过度的炎症反应,加重了光感受器的变性。
本研究在OPL 凋亡细胞数量和改善视功能方面实验组和对照组差异不具有统计学意义。可能存在以下原因,第一,本研究采用的腹腔注射PLX5622 与饲料添加PLX5622 清除小胶质细胞的方式,清除效果上存在一定的差距。虽然大部分研究者采用在饲料中添加PLX5622 的方式,也证明了该方法可以实现99%的清除率,但该方法无法用于新生的小鼠,而且在饲料中添加需要的PLX5622量较大。为了克服以上问题,Riquier等采用腹腔注射的方式清除小胶质细胞,他们的研究发现,该方法可以实现新生小鼠和成年鼠中99%的清除率。第二,Todd等研究表明,在NMDA致小鼠视网膜兴奋性损伤模型中,运用PLX5622清除小胶质细胞将导致视网膜神经元死亡增加。相矛盾的是Takeda等发现清除小胶质细胞可以保护神经节细胞抵抗N-甲基-D-天冬氨酸(N-methyl-Daspartate,NMDA)。那么在光诱导损伤条件下,清除小胶质细胞对光感受器细胞虽有保护作用,但对于其他神经元和细胞产生的影响并不明确,这可能导致结果不具有统计学意义。第三,本研究样本数较少,标准误偏大。此外,本研究还发现,停止注射PLX5622后,小胶质细胞迅速增殖,甚至超过正常小鼠视网膜中小胶质细胞的数量(结果未发表)。我们在检测视网膜功能时,已经停止注射48 h,这也可能对小鼠视网膜功能造成一定的影响。因此,本研究仍存在不足之处,后期将增加动物数量,进一步开展光损伤后进行小胶质细胞清除对视网膜变性的影响的研究。
总之,本研究结果显示调节小胶质细胞的激活状态可以有效改善光感受器的损失率,挽救视网膜功能。因此,未来针对调节小胶质细胞活性的药物研发将给眼病患者带来福音。
利益冲突申明
本研究无任何利益冲突作者贡献声明
饶必林:收集数据,资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。肖家怡:收集数据,资料的分析和解释。林鑫、臧科多、谭航、汤纯:收集数据。张军:参与选题、设计和修改论文的结果结论。高美玲:参与选题、设计、资料的分析和解释,修改论文中关键性结果、结论,根据编辑部的修改意见进行核修。
