甘草GuWOX基因家族的鉴定与表达分析
葛甜甜,王 楠,高 静*,张 岗,颜永刚,沈雨璇
(1 陕西中医药大学 药学院/陕西省中医药管理局秦药研发重点实验室,西安 712046;2 陕西中医药大学 陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究与开发国家重点实验室(培育),陕西咸阳 712083)
WOX(WUSCHEL-related homeobox)转录因子基因家族属于植物同源框(homeobox)转录因子超家族的一个亚进化支[1],其保守序列是由60个左右的氨基酸以“螺旋-环-螺旋-转角-螺旋(helix-loop-helix-turn-helix)”构成的同源异型结构域(homeodomain,HD)。WOX转录因子通过HD与特定的DNA序列结合发挥生物学功能[2],目前在拟南芥[3]、水稻[4]、乌拉尔图小麦[5]、小桐子[6]和玉米[7]等植物中均有研究报道,广泛参与干细胞分裂分化的调控、胚胎和器官的形成、花的发育等过程[8]。
拟南芥基因组中有15个WOX成员,分别是AtWUS和AtWOX1-AtWOX14[9],其中,AtWOX13和AtWOX14对根和花器官的发育产生影响,AtWOX8和AtWOX9在受精卵发育成胚的过程中发挥作用,AtWOX11和AtWOX12共同参与影响外植体根的器官发育。WUS基因作为形成和维持茎顶端分生组织所必需的基因,其对茎尖分生组织中心区细胞的表达和子房、花药的发育过程都具有一定的作用[10]。AtWOX5具有与WUS基因相似的功能,可以调控根尖分生组织的表达[11]。AtWOX1和AtWOX3共同调控叶片的横向生长,影响叶片的宽度[12]。在水稻中有13个WOX成员,OsWUS在腋芽的背面表达,OsWOX3是AtWOX3的同源基因,在叶片和花器官原基中表达,并且其表达是叶片发育所必需的。OsWOX9是AtWOX5的同源基因,参与根尖分生组织的维持,在根的静止中心(QC)的细胞中特异性表达[4]。
此外,有研究表明,WOX基因在植物响应干旱、低温或盐胁迫等非生物胁迫中发挥了关键作用[13]。在HOS9-1拟南芥突变体中,AtWOX6可影响冷胁迫的应答[14]。在水稻中,OsWOX11通过调节根毛发育来增强水稻的抗旱性[15]。同时,WOX基因受生长素(IAA)、脱落酸(ABA)和赤霉素(GA)和细胞分裂素(CTK)等激素的调控[4]。王培杰等[16]在不同激素处理茶树的研究中发现,CsWOX5、CsWOX3、CsWOX2和CsWOX6分别受到乙烯(ETH)、ABA、茉莉酸甲酯(MeJA)和GA的显著影响。Ohmori等[17]研究发现,OsWOX4通过参与CTK介导的水稻茎尖分生组织可维持未分化的状态,促进植物地上部分的生长。OsWOX11可以直接抑制细胞分裂素A型响应调节剂(RR2)基因的表达,进而调控IAA和CTK,影响水稻不定根的生长发育[15]。
甘草(GlycyrrhizauralensisFisch.)是豆科甘草属植物,以其根及根茎入药,具有清热解毒,缓急止痛,润肺止咳的功效,对糖尿病、哮喘等有一定治疗作用[18]。干旱[19]、高温[20]和盐胁迫[21]等非生物胁迫会严重威胁甘草的生长,降低甘草的产量和质量。本研究通过生物信息学的方法对GuWOX基因家族进行分析,并采用实时荧光定量PCR技术(qRT-PCR)研究GuWOX基因在不同组织(茎、幼叶、成熟叶、主根根尖、主根、侧根根尖和侧根)和不同处理(无磷、干旱和盐胁迫以及ABA和GA3)下的表达模式,成功克隆4个GuWOX基因,为进一步探索GuWOX基因家族的功能和多样化表达模式提供一定的理论参考。
1 材料和方法
1.1 实验材料及处理
试验材料为甘草种子,于2020年4月采自新疆乌鲁木齐,经陕西中医药大学黄文静副教授鉴定为豆科植物甘草。挑选健康饱满的种子以体积比为1∶3的30%过氧化氢:纯净水消毒30 min,用蒸馏水冲洗干净后,放入铺有2层滤纸的培养皿中,加适量水后进行催芽萌发,于人工气候箱中(温度25 ℃,相对湿度75%,光暗周期交替为12 h/12 h)进行为期7 d的催芽育苗,选择长势一致的幼苗植株移栽至塑料水培盆中,采用Hoagland全营养液水培1个月进行实验。选取正常生长条件下的甘草茎、幼叶、成熟叶、主根根尖、主根、侧根根尖和侧根用于组织特异性表达分析。以缺磷的霍格兰营养液(WP)、15 g/L聚乙二醇6000(PEG)[19]、150 mmol/L氯化钠(NaCl)[21]模拟无磷、干旱和盐胁迫处理,以霍格兰全营养液培养作为对照组(CK)。用100 μmol/L ABA、100 μmol/L GA3[16]喷洒甘草叶片进行激素处理,对照用纯水进行喷洒。实验均设置3个生物学重复,在处理3、6、12和24 h后取甘草的叶和根,蒸馏水洗净后,用锡纸包裹标记,液氮速冻后,于-80 ℃冰箱保存备用。
1.2 方 法
1.2.1GuWOX基因家族成员的鉴定利用http://ngs-data-archive.psc.riken.jp/Gur-genome/网站获取甘草的全基因组序列数据[22],从TAIR(https://www.arabidopsis.org/)中获取拟南芥15个AtWOX家族成员的蛋白全长序列。以AtWOX蛋白序列为查询序列,进行Blast同源序列比对以获得GuWOX的所有成员,并运用EBL-EBI(http://www.ebi.ac.uk/interpro/search/sequence/)在线工具分析候选蛋白序列的保守结构域,结合SMART(http://smart.embl-heidelberg.de/)在线分析工具进行验证,使用DOG2.0软件绘制蛋白结构域图。
1.2.2 系统进化树的构建利用MEGA7.0软件通过邻接法(Neighbor-Joining,NJ)对GuWOX、AtWOX和OsWOX蛋白进行比对建树;bootstrap值设置为1 000,其他为默认参数。
1.2.3 GuWOX蛋白信息学分析利用ProtParam(https://web.expasy.org/protparam/)在线工具分析GuWOX蛋白的理化性质,主要包括氨基酸残基数、分子量、理论等电点、总平均亲水性等。
分别利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、Cell-PLOC2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线分析工具对GuWOX蛋白的二级结构组成形式、亚细胞定位进行预测。利用TBtools软件提取GuWOX基因起始密码子上游2 000 bp的序列,将其提交到PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线工具分析启动子区域的顺式作用元件。
1.2.4GuWOX基因的表达分析利用甘草的全基因组序列数据库获得GuWOX基因家族的CDS序列,使用Primer Premier5.0软件,随机选取5条GuWOX基因家族的CDS序列设计引物,并交由生工生物工程股份有限公司(上海)合成引物,引物序列见表1,以Actin作为内参基因[23]进行特异性表达分析。按照天根多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司)的方法提取甘草根和叶RNA,并使用0.8%的凝胶电泳检测RNA质量。模板cDNA采用FastKing RT Kit (With gDNase)试剂盒的方法合成。qRT-PCR采用SuperReal PreMix Plus (SYBR Green)试剂在qTOWER2.0实时PCR仪上完成,扩增体系含20 μL,分别包含1 μL cDNA,上下游引物各0.6 μL,10 μL SYBR MIX,

表1 qRT-PCR和基因克隆的引物序列
7.8 μL ddH2O;反应程序为:95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次,试验3次重复。数据结果采用2-ΔΔCT法[24]进行分析,用SPSS 25.0对数据进行显著性分析,并用GraphPad Prism 8.0绘图。
1.2.5GuWOX基因克隆利用甘草的全基因组序列数据库获得GuWOX基因家族的CDS序列设计克隆引物(表1),以甘草叶片cDNA为模板进行PCR扩增,PCR反应体系(20 μL)为cDNA 2.0 μL,上、下游引物各1 μL,ddH2O 7 μL,2×Hieff TM PCR Master Mix酶10 μL。PCR扩增程序设置为94 ℃预变性4 min,95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸90 s,35个循环,最后72 ℃延伸10 min。将PCR产物送生工生物工程股份有限公司(上海)测序。
2 结果与分析
2.1 GuWOX基因家族蛋白结构的鉴定
将AtWOX蛋白序列与甘草全基因组数据进行Blast比对,共鉴定获得16个GuWOX蛋白序列,为进一步确定所获得的GuWOX是否属于WOX家族,使用EBL-EBI在线分析工具对所获得的GuWOX进行保守结构域分析,并结合SMART在线分析工具对其进行验证。如图1所示,将最终所得GuWOX蛋白序列分别命名为GuWOX1~GuWOX16,这16个GuWOX蛋白均具有一个HD,属于典型的WOX家族成员。

图1 GuWOX蛋白保守结构域
2.2 GuWOX基因家族系统进化树分析
为揭示GuWOX基因家族蛋白的进化关系,通过邻接法构建GuWOX、AtWOX和OsWOX蛋白的系统发育树。图2显示,GuWOX家族蛋白分为3个亚家族,为现代支、中间支和远古支,其中现代支包括GuWOX1~GuWOX9,中间支包括GuWOX10、GuWOX11、GuWOX15、GuWOX16,远古支包括GuWOX12~GuWOX14。GuWOX12~GuWOX14和AtWOX13、AtWOX14聚在同一分支,预测GuWOX12~GuWOX14调控植物生长发育,可能与AtWOX13、AtWOX14有相同的功能。

图2 GuWOX、AtWOX和OsWOX家族成员蛋白系统进化树
2.3 GuWOX蛋白的生物信息学分析
对16个GuWOX蛋白的基本理化性质进行分析(表2),其氨基酸残基数在168~452 aa之间,分子量为19.39~50.11 kD。理论等电点(pI)值在5.28~8.97之间,说明它们可能在不同的微环境中发挥功能。脂肪系数为50.83~68.56,蛋白不稳定系数在51.07~71.30左右,均大于40,为不稳定蛋白。总平均亲水性为-1.08~-0.51,均为负值。

表2 GuWOX蛋白的理化性质
通过对GuWOX蛋白进行二级结构和亚细胞定位的预测(表3),结果表明除GuWOX1和GuWOX2无规则卷曲的比例分别为45.11%和47.02%外,其余14个蛋白的无规则卷曲比例都大于50%,GuWOX蛋白以无规则卷曲为主要结构形式。亚细胞定位结果显示GuWOX蛋白均定位在细胞核上。

表3 GuWOX蛋白的二级结构预测
2.4 GuWOX基因家族启动子的顺式作用元件分析
利用PlantCARE分析GuWOX基因的启动子序列。结果显示(表4),GuWOX启动子中包含的元件按照功能主要分为5类,为应答逆境顺式调控元件、光响应元件、组织特异性元件、蛋白质结合位点和激素响应元件。其中,63%的GuWOX家族成员具有TC-rich repeats、LTR、GC-motif等3个应答逆境顺式调控元件。光响应元件,包括3-AF1bindingsite、AAAC-motif、GT1-motif,11个GuWOX家族成员均具有该元件。HD-Zip1元件仅存在于GuWOX14中,CAT-box元件存在于GuWOX1、GuWOX5、GuWOX7、GuWOX11、GuWOX13等5个成员中。此外,19%GuWOX家族成员具有IAA顺式作用元件TGA-element、25%的成员具有响应GA应答的GARE-motif作用元件,31%的成员具有响应水杨酸(SA)应答的TCA-element作用元件,94%的成员具有ABA顺式作用元件ABRE,因此GuWOX基因可能参与甘草的分生组织生长、对逆境胁迫的响应以及激素调节甘草的发育。

表4 GuWOX基因顺式作用元件分析
2.5 GuWOX基因家族在不同组织中的表达分析
组织特异性表达分析发现(图3),5个GuWOX在不同组织的表达量存在着一定的差异。其中,GuWOX1在侧根中的表达量显著高于其他基因(P<0.05),为2.29。在成熟叶中GuWOX1的表达量相较于其他基因最低,为0.45,并且,相较于其余6种组织,GuWOX1在侧根中的表达量最高。GuWOX15在茎中的表达显著高于其他基因(P<0.05),但其在不同组织间的表达无显著差异(P>0.05),同时,GuWOX15在幼叶、成熟叶、主根根尖、侧根根尖和侧根的表达均显著高于GuWOX12(P<0.05)。以上结果说明了GuWOX基因可能参与甘草的不同生长发育过程。

不同大写字母表示同一基因不同组织的表达差异显著(P<0.05)。不同小写字母表示同一组织不同基因的表达差异显著(P<0.05)
2.6 GuWOX基因在非生物胁迫下的表达分析
甘草叶中基因表达结果如图4所示,与对照相比,干旱处理3 h时GuWOX1、GuWOX6、GuWOX15均上调表达(P<0.05),GuWOX15还在干旱处理12 h时显著上调表达且表达量最高,为19.63。GuWOX12在3~24 h内的表达量持续上调。在盐处理中,GuWOX1、GuWOX6、GuWOX15的表达量随胁迫时间增加呈下调趋势。在无磷处理中,GuWOX1、GuWOX6、GuWOX15在3 h时显著上调(P<0.05),在6 h时显著下调(P<0.05)。激素ABA处理后GuWOX6、GuWOX12、GuWOX15在3和6 h时均显著上调(P<0.05)。GuWOX1的表达在3~12 h显著上调(P<0.05),在12~24 h显著下调(P<0.05)。激素GA3处理6 h时后,与对照相比,5个GuWOX基因均呈上调表达(P<0.05)。

不同大写字母表示同一处理不同时间下同一基因的表达差异显著(P<0.05),不同小写字母表示同一处理同一时间下不同基因的表达差异显著(P<0.05),下同
甘草根中基因表达结果如图5所示,与对照相比,干旱、盐和无磷处理6和12 h时GuWOX15显著上调(P<0.05)。GuWOX5在3种处理3和24 h时均上调表达(P<0.05),并且在3~12 h下调,12~24 h上调。ABA处理6 h时这5个基因均上调表达(P<0.05)。GuWOX1和GuWOX15在12~24 h均显著下降(P<0.05),GuWOX12的表达量在3~24 h先上升后下降(P<0.05)。GA3处理下,3 h时GuWOX12和GuWOX15显著上调(P<0.05),GuWOX5和GuWOX6分别在6和24 h时上调表达(P<0.05)。
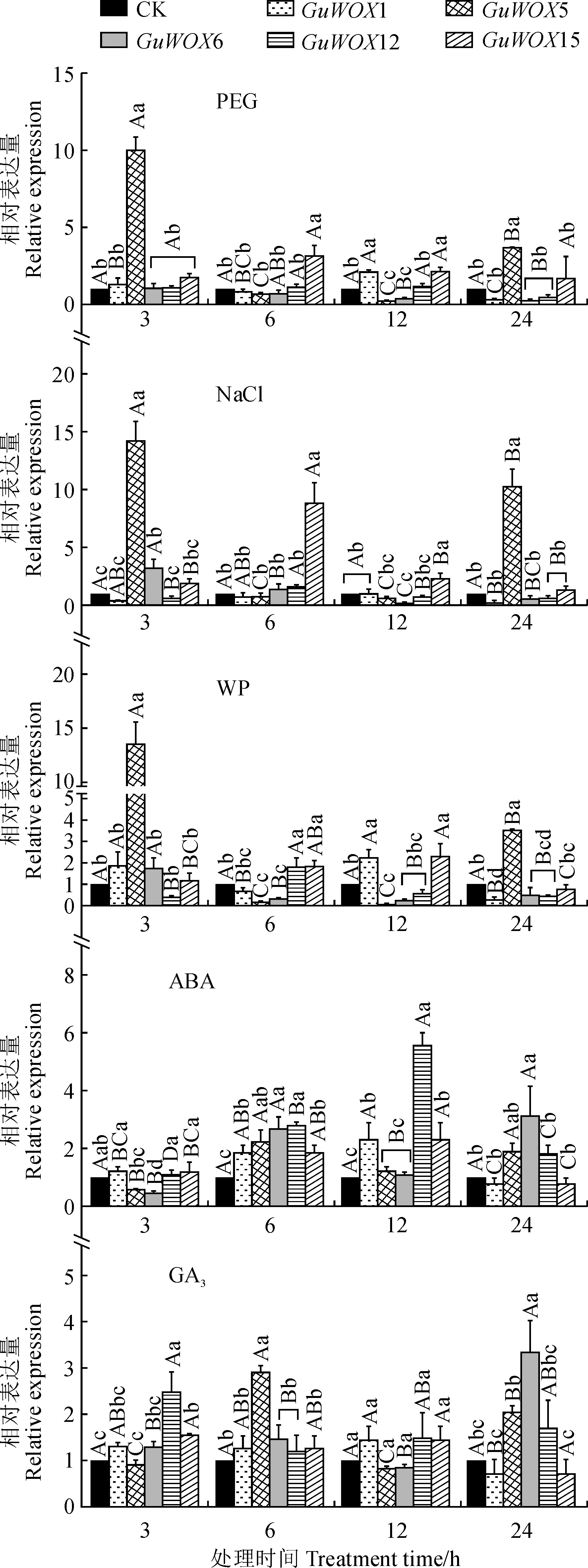
图5 不同处理下甘草根中GuWOX基因的表达水平
2.7 GuWOX基因的全长克隆
以甘草叶片cDNA为模板,经PCR扩增获得GuWOX1、GuWOX5、GuWOX6和GuWOX12的cDNA序列,其cDNA全长分别为557、707、716、578 bp,且分别编码184、237、237、191个氨基酸(图 6)。

M. DL3000;1. GuWOX1;2. GuWOX5;3. GuWOX6;4. GuWOX12
3 讨 论
WOX转录因子是植物特有的转录因子,参与植物生长发育调控和应答非生物胁迫[25]。本研究利用生物信息学的方法在甘草基因组中共鉴定出16个GuWOX基因家族成员,其均含有HD[26]。经过系统发育分析发现,GuWOX基因编码的蛋白被分为3个进化支,分别有3、4和9个成员分布于远古支、中间支和现代支中,这与在拟南芥中的研究一致[3],每一个进化支都包含了单子叶植物水稻OsWOX基因家族和双子叶植物甘草GuWOX、拟南芥AtWOX基因家族成员,推测WOX基因的分化早于单双子叶植物的分化。GuWOX家族蛋白均为亲水性不稳定蛋白质,相似的理化性质预示各个成员间可能具有某些相似的功能。GuWOX家族蛋白亚细胞定位均在细胞核上,说明GuWOX基因家族在细胞核中发挥作用,这与拟南芥中AtWUS、AtWOX3、AtWOX4、AtWOX6和水稻中OsWOX3、OsWOX9和OsWOX11的亚细胞定位结果一致[27-29]。
WOX基因对植物的生长发育、抗逆性、植物激素信号转导等起着重要的调控作用[13]。水稻中OsWOX11参与侧根原基萌生、不定根伸长和根表皮细胞分化为根毛,最终增加根系生物量,促进吸水,帮助抵御干旱胁迫[30]。干旱处理6和12 h时GuWOX15在甘草根中被诱导上调,推测GuWOX15可能通过调控根的发育以抵御干旱胁迫。蔡璐羽等[31]研究发现,低磷胁迫显著增加WOX5在大豆侧根尖和主根尖的表达。GuWOX1在侧根的表达量最高,并且在缺磷处理12 h时,在根中被上调表达,推测GuWOX1可能与其同源基因AtWOX5有相似的功能,在根尖分生组织发育中起作用,参与根的形成,在缺磷条件下增加根系表面积,提高对养分吸收。此外,GuWOX1在幼叶内有较高的表达,说明了GuWOX1可能在其他组织部位发挥作用。本研究结果中,甘草的叶和根中的WOX基因在胁迫条件下整体表达水平较高,说明GuWOX在甘草响应干旱、盐和缺磷胁迫中发挥积极作用。
有研究表明,WOX基因在调控植物生长发育过程受IAA、ABA和GA等激素的调节[15]。本实验中,在GuWOX启动子区域观察到大量激素响应元件,包括分别参与ABA、IAA、SA、GA反应中的顺式作用元件ABRE、TGA-element、TCA-element、GARE-motif,因此,WOX基因参与ABA、GA等信号转导途径。在拟南芥中,外源施加GA后,AtWOX14过表达会刺激GA3-氧化酶(GA3ox)合成代谢基因的表达并抑制GA2-氧化酶(GA2ox)分解代谢基因,促进生物活性GA的积累[32]。本研究中,与AtWOX14亲缘关系较近的GuWOX12在GA3处理下,3 h时在甘草根中被诱导上调,推测外源施加GA3可能通过增加植物体内GA含量,调节甘草生长发育。在ABA处理下,甘草根中5个GuWOX基因在处理6 h时均被诱导上调表达,此外,顺式作用元件分析表明这5个GuWOX基因均具有ABA响应元素。ABA在植物抵御干旱胁迫的机制中作为一种化学信号,通过诱导植物气孔关闭,减少蒸腾作用导致的水分散失,从而有助于植物保存水分[33-34]。GuWOX15应答干旱胁迫及外源ABA处理的表达模式相近,干旱和ABA处理12 h时均上调表达,这与桑树中BpWOX8被这两种处理诱导上调的结果一致[35]。因此,GuWOX基因家族可能通过介导植物激素调节途径,在植物生长、发育和抵御逆境胁迫中发挥作用。
本研究获得了16个GuWOX基因分为3个分支,荧光定量结果表明,GuWOX1在侧根中的表达量较高,GuWOX15在茎中的表达量较高。GuWOX1、GuWOX5、GuWOX6、GuWOX12和GuWOX15在非生物胁迫和激素处理的不同时间被诱导上调表达,表明了GuWOX参与甘草生长发育、逆境胁迫的应答以及植物激素调节,并且克隆得到GuWOX1、GuWOX5、GuWOX6、GuWOX12共4个基因,分别编码184、237、237、191个氨基酸。后续将对其功能及其调控机制进行研究,为甘草抗逆新品种选育提供参考。

