一株具有广谱抑菌活性的兵马俑芽孢杆菌HS-15的筛选及其抑菌活性研究
钟春英, 肖长生, 齐小琼, 董桃杏
(湖北第二师范学院化学与生命科学学院, 植物抗癌活性物质提纯与应用湖北省重点实验室, 武汉 430205)
微生物污染是食品腐败变质的主要原因,一方面会造成巨大的经济损失,另一方面,某些微生物产生的毒素会对人体健康产生威胁.为防止微生物的污染,在食品生产加工的过程中,通常会加入防腐剂.目前,我国食品工业中所用的防腐剂以化学防腐剂为主,如亚硝酸盐、山梨酸、苯甲酸及其盐类等.然而,过量使用化学防腐剂存在食物中毒、致癌等安全问题[1],因此,寻找天然的生物抑菌活性物质取代化学防腐剂引起了广泛的关注[2-3].
微生物分布范围广,代谢产物结构新颖,活性多样,是天然抑菌活性物质的重要来源[4].目前,被批准可作为食品防腐剂使用的微生物来源的抑菌活性物质有乳酸链球菌素(nisin)、乳酸片球菌素(pediocin)和carnocyclin A[5-6],在我国,真正被广泛应用的只有乳酸链球菌素[7].但乳酸链球菌素本身也有缺陷,它在中性和碱性条件下溶解度低且不稳定,仅对革兰氏阳性菌有抑菌活性,对革兰氏阴性菌、霉菌抑制效果不理想[8-10],因此,发掘理化性质好、广谱的抑菌活性物质以满足食品工业防腐的需求成为研究的热点.
目前,国内外学者就筛选广谱抑菌活性物质做了大量的研究,并从不同环境中分离到一些具有广谱抑菌作用的微生物.如刘一平等[11]从北冰洋海域沉积物中筛选到一株枯草芽孢杆菌,该菌对金黄色葡萄球菌、白色念珠菌、肺炎克雷伯氏菌、铜绿假单胞菌、鼠伤寒沙门氏菌、大肠杆菌均有一定的抑制作用;Yi等[12]从陕西杨凌当地家庭自酿浆水菜汁中分离到一株能产生细菌素的棒状乳杆菌XN8,其对具有多重耐药性的阪崎肠杆菌、沙门氏菌、金黄色葡萄球菌等具有抑制作用;Simmi等[13]从土壤中分离的绿脓杆菌JU-Ch-1对细菌和真菌都表现出抑制活性.然而,目前这些产抑菌活性物质微生物的筛选通常是将样品稀释涂平板获得大量的单菌落,再检测纯化的单菌落对指示菌是否有抑制作用;或者采用双层平板法,即下层培养基混有指示菌,稀释的样品悬液混入上层培养基中培养,然后挑取能对指示菌产生抑菌圈的菌落检测其抑菌谱[14].这些方法具有工作量大,效率低,难以得到具有广谱抑菌活性的菌株等缺点.
本实验以高浓度的土壤菌悬液涂布平板,筛选能产生透明抑菌圈的菌株,利用土壤中微生物种类多、数量大的特点,快速获得45株对其他多种杂菌产生抑制作用的菌株,并对其中一株活性优良的菌株HS-15进行分类鉴定,探究培养时间对抑菌活性的影响,检测抑菌活性物质的抑菌谱及理化性质.本研究丰富了产抑菌活性物质微生物的菌种资源库,为天然食品防腐剂的开发提供理论基础.
1 材料与方法
1.1 材料与试剂
1.1.1 土壤样品 采自湖北随州大洪山人迹稀少的密林,地理坐标为31°31′14″ N,112°57′30″ E,以便获得新型菌株.
1.1.2 指示菌 金黄色葡萄球菌CCTCC AB91093、枯草芽孢杆菌CCTCC AB90008、苏云金芽孢杆菌CCTCC AB92004、大肠杆菌CCTCC AB93154、铜绿假单胞菌CCTCC AB2016055、变形杆菌CCTCC AB91103,黑曲霉CCTCC AF91006,黄曲霉CCTCC AF93035,三孢布拉霉菌CCTCC AF96002均购于中国典型培养物保藏中心,由本实验室保存.
1.1.3 培养基 牛肉膏蛋白胨培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,蒸馏水1 000 mL,pH 7.2,用于细菌的培养及保存;
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL,自然pH,用于真菌的培养及对真菌抑菌活性的检测.
1.1.4 试剂 DNA凝胶回收试剂盒、细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司,2×PCR Mastermix、trans2k DNA marker购自北京全式金生物技术有限公司,木瓜蛋白酶、胰蛋白酶和蛋白酶K购自北京索莱宝科技有限公司,蛋白胨购于上海如吉生物科技发展有限公司,其它常规试剂购自国药集团.
1.2 方法
1.2.1 土壤样品的采集 选取有机质丰富的土壤,为避免环境因素的影响,去掉表面覆盖物,挖取深度为5~20 cm处微生物丰富的土壤,置于样品采集袋备用.选取多处采集点,共采集样品50份.
1.2.2 活性菌株的初筛 取1 g土壤加入99 mL灭菌水制成悬浊液,摇床震荡30 min充分混匀,静置10 min,取100 μL上清液涂布平板,28 ℃培养72 h,以土壤中含有的丰富的微生物为指示菌,挑取能拮抗其它微生物生长并产生抑菌圈的菌落,进行三次平板划线分离,将纯化得到的单菌落转接到新鲜的固体平板上培养后保存备用.
1.2.3 复筛 以金黄色葡萄球菌和大肠杆菌为指示菌,参照文献,用牛津杯法对初筛得到的菌株进行复筛[8].将分离出的菌株接种于牛肉膏蛋白胨液体培养基中,28 ℃振荡培养24 h,10 000 r · min-1离心10 min,用0.22 μm微孔滤膜对上清液进行过滤,得到无细胞发酵液.将指示菌稀释为107CFU · mL-1,取100 μL该指示菌液均匀涂布在平板上,再将灭菌的牛津杯置于平板,加入200 μL待测无细胞发酵液于牛津杯,4 ℃静置扩散5 h,37 ℃培养24 h,观察并测量抑菌圈直径.
1.2.4 菌株形态的鉴定 将菌株接种在牛肉膏蛋白胨固体培养基上,置于28 ℃培养24 h,观察菌落形态特征;挑取少许培养物进行革兰氏染色,显微镜下观察菌体形态.
1.2.5 16S rDNA基因序列分析和系统发育树的构建 用细菌基因组试剂盒提取待测菌株的DNA,以其为模板,用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)扩增出该DNA片段.PCR 反应体系(25 μL):27F (10 μmol · L-1) 0.5 μL,1492R (10 μmol · L-1)0.5 μL,DNA 模板 1 μL,2×PCR Mix 12.5 μL,dd H2O 10.5 μL.扩增条件为:94 ℃预变性5 min;94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1.5 min,35个循环;72 ℃补平10 min.用1%的琼脂糖凝胶电泳检测PCR扩增产物,DNA凝胶回收试剂盒纯化目的条带,纯化产物交由上海生工进行测序.
将测序所得的16S rDNA序列在NCBI中的 GenBank数据库中进行BLAST分析,根据比对结果,选取有代表性菌株的16S rDNA序列,利用 Clustal W进行比对,通过MEGA软件中的NJ(neighbor joining, NJ)法构建系统进化树.
1.2.6 菌株产抑菌活性物质的发酵过程 将活化的待测菌株转接至液体培养基中,放入恒温振荡器,28 ℃、180 r · min-1培养,每隔2 h取一次样,测菌液波长为600 nm的吸光值,绘制菌株的生长曲线;以金黄色葡萄球菌为指示菌,牛津杯法检测不同培养时间无菌发酵液的抑菌活性.
1.2.7 抑菌活性物质的初步鉴定
1) 发酵液中有机酸碱抑菌作用的排除.测定待测无细胞发酵液的pH值,与发酵前培养基的pH作比较,判断抑菌活性是否由发酵过程中产生的有机酸或碱引起.
2) 抑菌活性物质分子量的初步确定.取5 mL无细胞发酵液加入透析袋透析,用PEG进行浓缩,浓缩液中加入PBS调至体积为5 mL,以金黄色葡萄球菌为指示菌,牛津杯法检测其抑菌活性.
3) 抑菌活性物质的蛋白质酶稳定性检测.分别取15 mg · mL-1的木瓜蛋白酶、胰蛋白酶和蛋白酶K 100 μL,加入400 μL无细胞发酵液中,37 ℃温育2 h,用无酶处理的无细胞发酵液为对照,以金黄色葡萄球菌为指示菌,用牛津杯法测其抑菌活性.
1.2.8 抑菌活性物质对温度和酸碱的耐受性 将无细胞发酵液分别置于20 ℃、40 ℃、60 ℃、80 ℃、100 ℃处理30 min,再静置至室温,以金黄色葡萄球菌为指示菌,用牛津杯法检测处理后发酵液的抑菌活性.
将无细胞发酵液的pH值分别调节为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,4 ℃处理2 h,再调回初始pH值,以未处理组为对照,以金黄色葡萄球菌为指示菌,用牛津杯法检测处理后发酵液的抑菌活性.
1.2.9 抑菌谱的检测 参照文献,采用点植法检测筛选的菌株对细菌的抑制作用[15].取107CFU · mL-1的指示菌100 μL,均匀涂布在牛肉膏蛋白胨平板上,用灭菌牙签蘸取活化的待测菌,点接在涂布有指示菌的平板上,每个平板上点接3次,接种点之间彼此间隔均匀.37 ℃培养24 h至抑菌圈不再增大,观察并分别测量抑菌圈和点接的待测菌株外缘直径,用抑菌圈直径减去点接的待测菌株外缘直径表示该菌的抑菌圈大小.
参照文献,用平板对峙法检测筛选的菌株对真菌的抑制作用[16].用灭菌打孔器挖取直径6 mm生长旺盛的真菌菌块,将其放置于PDA平板中央,在距离菌块2.5 cm处点接活化后的待测菌株,以不接种待测菌株的平板作为对照,置于28 ℃培养箱培养3~5 d,观察待测菌株对真菌生长的抑制作用.
1.2.10 数据分析 实验中每组数据均进行3次重复,结果用平均值±标准偏差表示,数据采用SPSS 22.0软件进行方差分析,以p<0.05为显著水平.
2 结果与分析
2.1 菌株的筛选
利用高浓度土壤悬液涂平板法,得到45株产明显抑菌圈的菌株,根据菌落及菌体形态特征观察,初步鉴定其中39株为细菌,6株为放线菌,图1展示了部分有抑菌活性的菌株.本实验采用土壤悬液静置后的上清液直接涂平板法分离菌种,由于土壤悬液中微生物的种类和数量较多,涂布后土壤中的多种混合菌体会长满平板,故产生明显抑菌圈的菌株具有较高的产广谱抑菌活性物质的潜力.
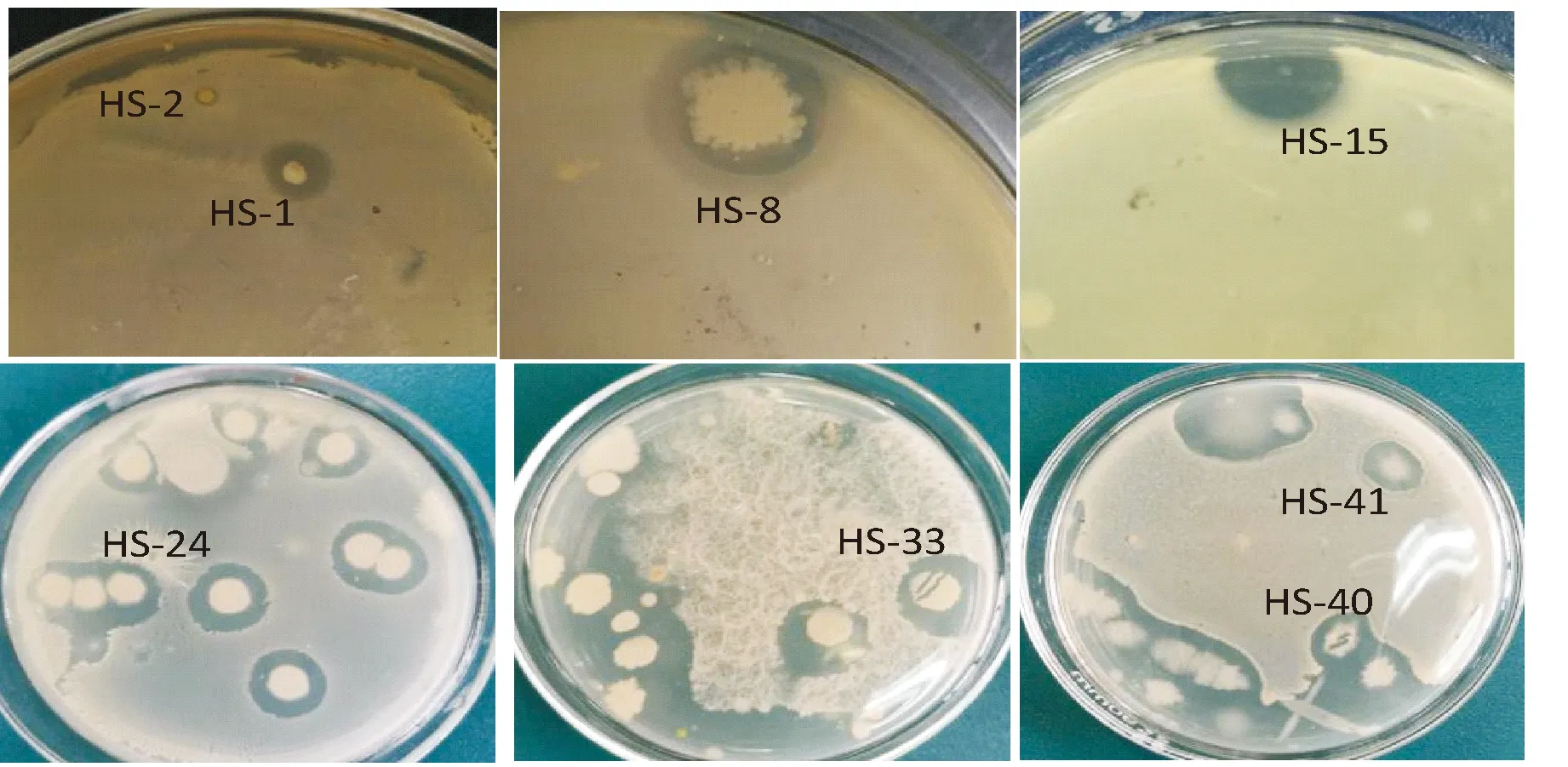
图1 有抑菌活性的部分菌株Fig.1 Several strains with inhibitory activity
以金黄色葡萄球菌和大肠杆菌为指示菌,牛津杯法对上述有明显抑菌圈的菌株进行复筛,其中38株菌的无细胞发酵液对金黄色葡萄球菌和大肠杆菌有不同程度的抑菌活性,7株菌仅对金黄色葡萄球菌有抑菌活性,其中编号为HS-15的菌株抑菌效果较好,以其为对象进行后续的研究.
2.2 菌株的鉴定
2.2.1 菌株HS-15的形态特征 菌株HS-15平板划线长出来的单菌落形态特征如图2A所示:圆形、边缘不规整,乳白色、质地润泽、不透明.24 h培养物革兰氏染色如图2B所示:菌体为杆状,以链状排列,呈深紫色,为革兰氏阳性菌.部分菌体已出现芽孢,芽孢形状为椭圆形.

图2 菌落形态(A)和细胞形态(B)Fig.2 Morphology of colony (A) and cell morphology (B)
2.2.2 16S rDNA序列相似性和系统发育分析 以菌株HS-15的总DNA为模板,PCR扩增出16S rDNA的片段,长度约为1 400 bp,将测序结果输入Genebank进行BLAST比对,获得相关的相似序列, Clustal W对齐后,利用MEGA 7.0软件计算序列相似性,构建菌株HS-15的系统发育进化树,结果如图3所示.由图可知,HS-15与Bacillusbingmayongensis的亲缘关系最近.结合HS-15的菌落和菌体特征及系统发育分析结果,初步将其鉴定为兵马俑芽孢杆菌.

图3 菌株HS -15的16s rDNA系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequence of strain HS-15
2.3 菌株HS-15产抑菌活性物质的发酵过程
测定不同培养时间菌株HS-15的A600,以金黄色葡萄球菌为指示剂,牛津杯法检测不同培养时间HS-15无菌发酵液的抑菌活性,并测量抑菌圈的大小,菌株HS-15产抑菌活性物质的发酵过程如图所示.由图4可知,菌株HS-15培养4 h进入对数生长期,菌体快速生长,至14 h进入稳定生长期.在对数生长期,随着菌体的大量繁殖,产生的抑菌活性物质逐渐增多,菌体生长8 h的无细胞发酵液可以检测到对金黄色葡萄球菌的抑菌活性.随着发酵的进行,发酵液中抑菌活性物质的浓度逐渐增加,培养20 h时菌株HS-15无细胞发酵液的抑菌活性最强,对金黄色葡萄球菌的抑菌圈为18.2 mm,随后,抑菌活性在最高水平维持一段时间;28 h之后,抑菌圈的直径开始减小,推测在此阶段,稳定生长期的部分菌体细胞裂解,释放的蛋白酶将部分抑菌活性物质降解,故发酵液中抑菌物质的量减少,抑菌活性开始降低.
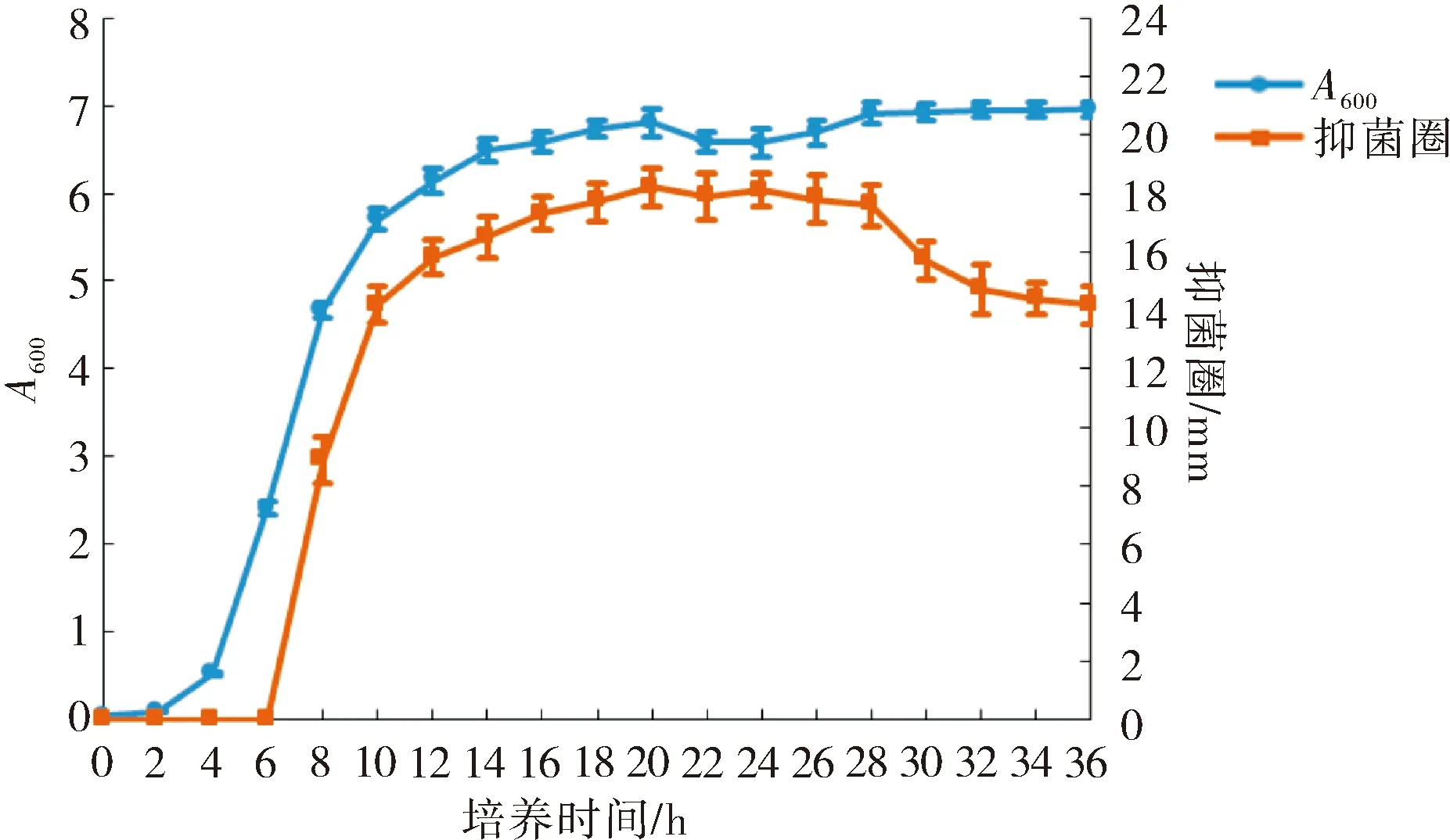
图4 菌株HS-15的生长及抑菌物质生成曲线Fig.4 Growth curves of HS-15 strain and production of antimicrobial substances
2.4 抑菌活性物质的初步鉴定
菌株HS-15培养20 h后,发酵液pH为7.0,与发酵前培养基pH(7.2~7.4)没有明显的区别,故可排除抑菌活性是由发酵过程中产生的有机酸或碱引起的.
20 h的无细胞发酵上清液经透析袋、蛋白酶处理后,对金黄色葡萄球菌的抑菌活性如表1所示.由表1可知,经透析袋处理后,抑菌活性没有变化,表明抑菌活性物质不能通过透析袋.

表1 不同处理对发酵液抑菌活性的影响
用木瓜蛋白酶2 h处理后,无细胞发酵液对金黄色葡萄球菌的抑菌活性有所降低,抑菌圈直径由17.8 mm降低至12.5 mm,但仍有一定的抑菌活性,表明木瓜蛋白酶能部分降解抑菌活性物质;而胰蛋白酶和蛋白酶K处理后,几乎没有抑菌圈形成,表明抑菌活性物质能被胰蛋白酶和蛋白酶K完全降解.
综合以上实验结果,将抑菌活性物质初步鉴定为蛋白质类物质.
2.5 抑菌活性物质的稳定性
2.5.1 抑菌活性物质对温度的耐受性 将无细胞发酵上清液用不同的温度分别处理30 min,检测处理后发酵液对金黄色葡萄球菌的抑菌活性,结果如图5所示.低温处理对活性物质的抑菌活性没有影响.当温度超过60 ℃时,随着温度的升高,抑菌活性有所下降.当处理温度为80 ℃时,抑菌圈直径大小由17.3 mm降为13.5 mm;处理温度为100 ℃时,抑菌圈降至12.3 mm,仍保持部分抑菌活性,表明菌株HS-15产生的抑菌物质具有一定的热稳定性.
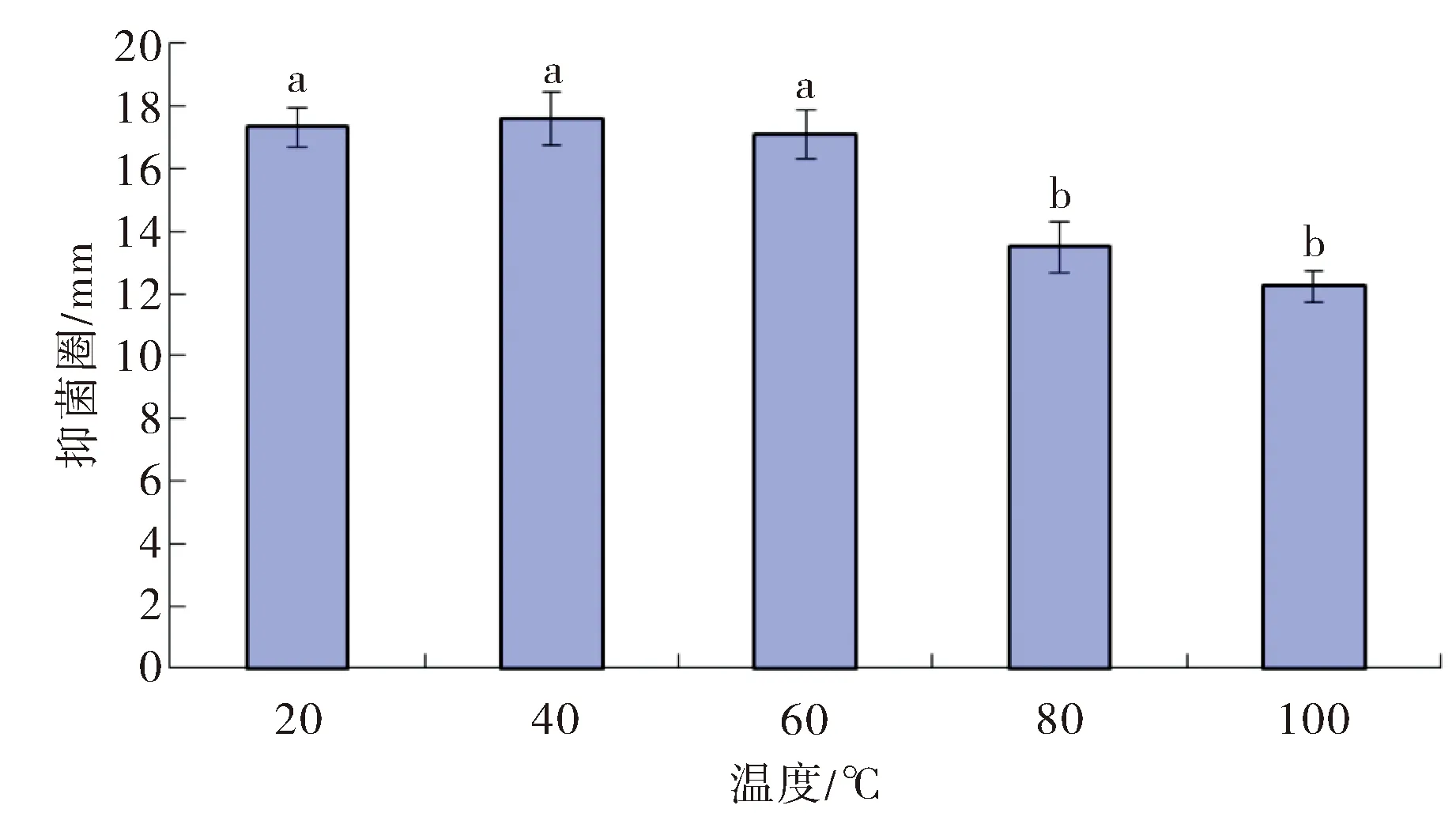
图5 温度对活性物质抑菌活性的影响Fig.5 The effect of temperature on antimicrobia activity of the active compound
2.5.2 抑菌活性物质对酸碱的耐受性 将无细胞发酵上清液的pH值调节到3.0~11.0的不同值,处理2 h后,再调回起始pH值,测定处理液对金黄色葡萄球菌的抑菌活性,结果如图6所示.当pH为5~9时,无细胞发酵液的抑菌活性变化不大;经过pH为3.0的偏酸溶液和pH为11.0的偏碱溶液处理,抑菌活性有所下降,抑菌圈直径由对照样品的17.6 mm分别降至为11.6 mm、12.5 mm,但仍然有明显的抑菌活性,表明抑菌活性物质对酸碱有一定的耐受性.
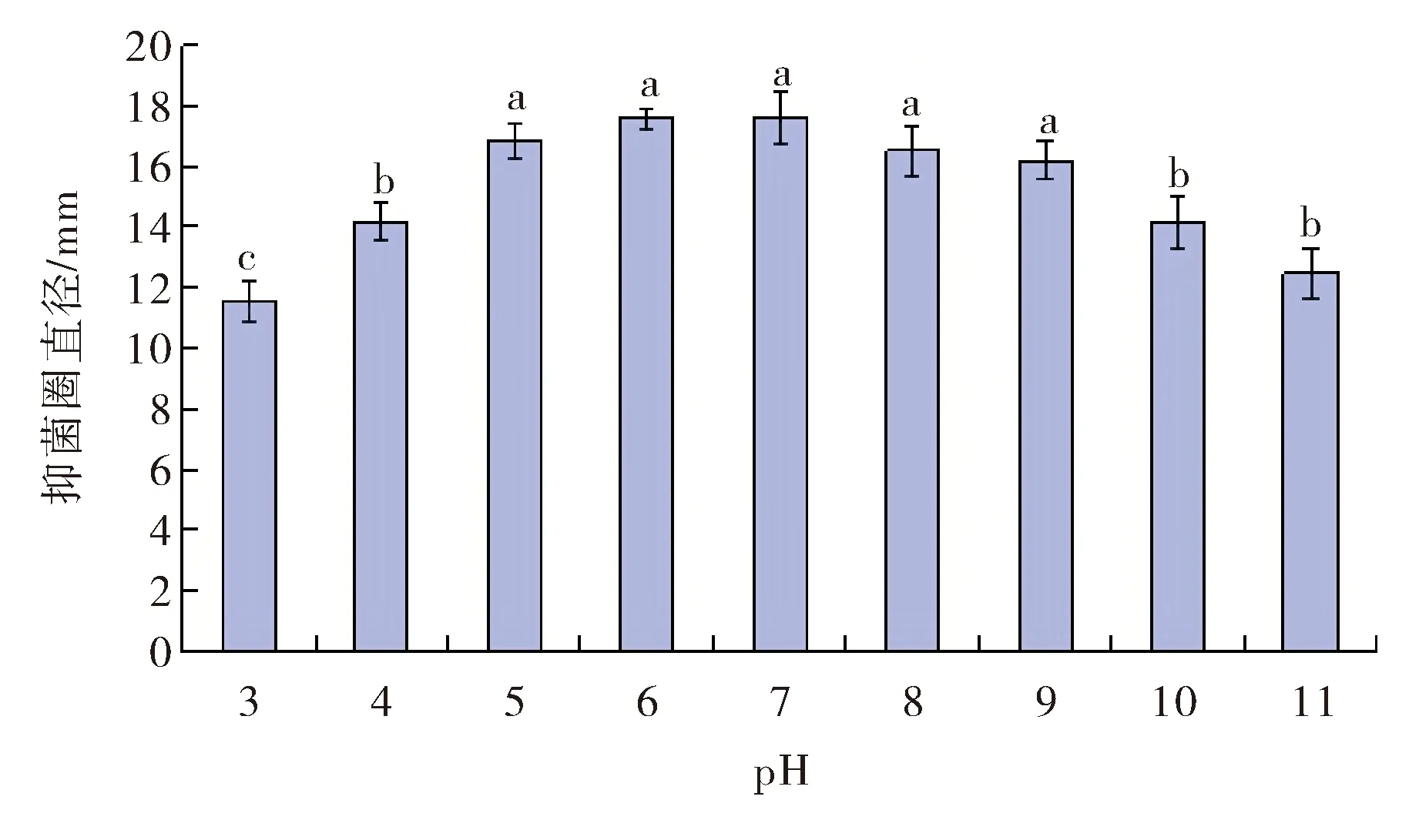
图6 pH对活性物质抑菌活性的影响Fig.6 The effect of pH on antimicrobia activity of the active compound
2.6 菌株HS-15抑菌活性物质的抑菌谱
采用点植法和平板对峙法分别检测菌株HS-15对细菌和真菌的抑菌活性,测量HS-15菌落和抑菌圈外缘的直径,用抑菌圈外缘的直径减去HS-15菌落外缘的直径表示HS-15菌落抑菌圈的大小.用抑菌圈的大小指征抑菌活性的强弱,当抑菌圈直径>9.0 mm时,表示抑菌能力较强[11].结果如表2所示,HS-15对金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌等革兰氏阳性菌,大肠杆菌、铜绿假单胞菌、变形杆菌等革兰氏阴性菌,黑曲霉、黄曲霉、三孢布拉霉菌等真菌都有明显的抑制作用,表明菌株HS-15具有广谱抑菌活性.其中,对革兰氏阳性菌和真菌的抑制作用强于革兰氏阴性菌.

表2 菌株HS-15的抑菌谱
3 讨论
芽孢杆菌在自然界中广泛存在,因其在生长的后期能形成芽孢,具有抗逆性强,易保藏等特点,且绝大多数具有良好的安全性,是作为生防菌或微生物生态制剂的理想菌种[17-18].目前研究已经发现芽孢杆菌属中的许多菌种,如枯草芽孢杆菌、蜡状芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌等均能产生抑菌活性物质,且这些抑菌活性物质普遍具有抑菌谱广、耐酸碱、热稳定性好等优点[19-22],这些都为开发天然防腐剂提供了良好的条件,具有良好的应用前景.兵马俑芽孢杆菌是2014年我国福建省农科院刘波团队首次从秦始皇兵马俑土壤中分离出来的芽孢杆菌属新种[23],而对兵马俑芽孢杆菌的功能目前还没有相关报道,本研究首次发现兵马俑芽孢杆菌能产生抑菌活性物质,丰富了抗菌微生物资源库,有望发掘新型抑菌活性物质.
本研究从土壤中分离到一株具有抑菌活性的兵马俑芽孢杆菌HS-15,抑菌谱检测表明,该菌对革兰氏阳性菌、革兰氏阴性菌和霉菌都有较强的抑制作用,表明其具有广谱抑菌活性.经透析带处理,抑菌活性不变,但胰蛋白酶和蛋白酶K处理后,抑菌活性完全丧失,推测抑菌物质可能为蛋白质.HS-15的抑菌物质对胰蛋白酶敏感,有利于其经食物进入人体后,被体内的蛋白酶降解,不会给机体带来危害.同时,本实验表明,该抑菌物质对木瓜蛋白酶有一定的抗性,可能与不同蛋白酶降解位点不同有关,抑菌物质氨基酸组成的特异性导致其对不同蛋白酶敏感性不同.据报道,芽孢杆菌产生的抑菌蛋白物质主要分为两类:一是由核糖体合成途径合成的具有抗菌活性的蛋白类抑菌物质,具有分子量小、耐热性好、两亲性等特点,包括具有抗菌活性的大分子蛋白、翻译后修饰小肽和非修饰小肽三种.另一类是通过非核糖体合成途径合成的多肽或脂肽,通过多肽合成酶系催化形成肽键并延伸肽链[24-25].此外,芽孢杆菌抑菌物质还有细胞壁降解酶类、其它抗菌蛋白及挥发性抗菌活性物质[14].菌株HS-15产生的抑菌物质具体属于哪一类活性物质还不清楚,后期将对抑菌成分进行分离提纯,分析其组成结构、作用机理及使用安全性,为天然防腐剂的开发应用提供基础和依据.

