结直肠癌死亡患者的肿瘤转移部位、发生率及预后
周家铭,邬小凤,吴远辉,陈晓琼,谭淑云,李拓阳,石雪彬,黄美近
(1.中山大学附属第六医院结直肠肛门外科,广东广州 510655;2.广东省结直肠盆底疾病研究重点实验室,广东广州 510655;3.中山大学附属第六医院病案管理科,广东广州 510655)
结直肠癌(colorectal cancer,CRC)是全球最常见的肿瘤之一,发病率在男女性中均位居前五位[1-2]。随着治疗技术的发展,虽然近20 年来5 年生存率逐渐上升,但死亡率仍高于其他肿瘤。2018年结直肠癌的中国世标死亡率为7.76/10 万,而美国世标死亡率为14.3/10 万[3]。除了局部病灶附近的淋巴结转移外,CRC最常见的转移方式为通过血行转移到肝、肺,以及肿瘤直接突破肠壁播散引起的腹腔种植转移[4-7]。除此此外,临床上也发现卵巢、肾上腺、输尿管等器官也是CRC 好发的转移部位,但所占比例较少[8]。肿瘤转移是引起肠癌患者死亡的主要因素。在因肠癌死亡的病例中,除了原发肿瘤引起的梗阻和出血以外,大部分患者的死亡均与转移瘤在其他器官引起的各种器官功能障碍或衰竭有关。约15%~45%的CRC 患者出现肝转移[9-10],约25%出现肺部转移[11-12],约15%出现腹膜转移[13],其余部位的转移风险则在10%以下[14]。但以上数据均以总体发病人群为基数,并在一定有限的随访时间作为观察终点。但是在实际临床工作中,我们亦发现某些患者从发病至死亡,一直没有发现肝、肺或腹膜转移的发生。目前尚无文献基于长期随访并以死亡作为观察终点,总结CRC 转移部位、模式以及相关生存数据。因此,我们统计了中山大学附属第六医院2013~2019 年间的373 例CRC死亡病例,并对其终末期器官转移的情况作出分析。
1 材料与方法
1.1 病例资料
本研究收集中山大学附属第六医院2013 年1月1 日至2019 年12 月31 日,诊断为“结直肠癌”(ICD-10 编码为C18.0-C21.8)并且以“死亡”作为病案最终状态的相关病例。收集资料包括性别、年龄、首诊时间、切除原发肿瘤手术日期、死亡日期、原发肿瘤部位、血清肿瘤标记物最大值、器官转移部位、器官转移出现时间、主要死亡原因等。本研究为回顾性非干预性研究,并已在首次入院时取得患者书面知情同意使用相关病例及随访资料。本研究方案遵从《赫尔辛基宣言》,并已通过中山大学附属第六医院医学伦理委员会审批。
1.2 死因判断
本研究中对死因分为肿瘤相关性死亡及非肿瘤相关性死亡。肿瘤相关性死亡指由于原发灶或转移灶的对身体器官造成损伤,并持续一段时间,引起器官相应衰竭的病理生理过程,最终导致死亡。例如原发肿瘤引起的消化道出血或梗阻、肝脏转移引起的肝衰竭、肺转移引起的肺部感染、腹膜转移引起的肠梗阻、脑转移引起的脑疝等。非肿瘤相关性死亡指由于手术并发症、其他非肿瘤相关基础病引起的死亡。例如围手术期由手术引起的出血、吻合口瘘,麻醉或术后DVT 引起的窒息、心肺脑血管事件以及糖尿病引起的酮症酸中毒等。死因由专科医师结合患者治疗记录以及死亡讨论进行判断。
1.3 转移部位判断
根据患者最后1 次CT、B 超、MRI、PET 及相关病理检查,对患者死亡前的器官转移情况进行判定。对于肝、肺、淋巴结、骨等实体器官,如辅助检查发现肉眼可见转移灶,则考虑为存在该器官的转移。对于腹膜、胸膜等膜性结构,如CT、PET 等可发现转移灶,判断为存在转移灶;如未发现肉眼可见转移灶,但具有恶性胸腹水、反复多节点肠梗阻等情况,判断为存在转移灶。
1.4 随访及统计学方法
本研究中以患者首次确诊时间作为研究起点,死亡日期作为研究终点。采用IBM SPSS 21.0 统计学软件进行数据分析。计数资料以相对数表示,组间比较采用χ2检验、Fisher′s确切概率法或多组one-way ANOVA 法;计量资料比较采用非配对t检验或秩和检验,双侧检验α=0.05;影响因素分析采用逐步Cox 比例风险回归分析;采用Graphpad 5.0 软件,根据Kaplan-Meier 法绘制结直肠癌根治性切除术后患者的生存曲线,OS 比较采用Logrank检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象一般情况资料
本研究共纳入373 例可查证完整死亡记录的患者,其中男性222 人(59.5%),女性151 人(40.5%)。死亡年龄主要分布于61 岁以上(63.9%)。发病至死亡病程在36 个月内占80.2%。结肠癌占63.8%,直肠癌占35.4%,其余约0.8%。240例切除原发肿瘤,占64.3%。共334例患者因肿瘤相关性疾病死亡,占89.5%。39 例患者因非肿瘤相关性疾病死亡(围手术期感染及出血死亡10 例,麻醉事件5 例,心血管事件死亡17 例,脑血管事件4例,自缢2例,糖尿病酮症酸中毒1例,表1)。

表1 373例患者一般情况及肿瘤相关资料Table 1 Demographic,clinical and pathological characteristics of 373 patients
2.2 转移部位情况
本研究中共334 例肿瘤相关性死亡患者具有CT、MRI、PET 或B 超等可客观评估肿瘤情况时间比例为3 个月内295 例(88.3%);3~6 个月内25 例(6.6%);6~12 个月内7 例(2.4%);超过12 个月7 例(2.4%)。共发现肝转移172例,无肝转移159例,无法判断3 例。肺转移135 例,无肺转移195 例,无法判断4 例。腹膜转移186 例(合并腹壁转移3 例),无腹膜转移145 例,无法判断3 例。其他部位转移包括:腹膜后纵隔及其他部位淋巴结转移35 例,骨转移34 例,肾上腺转移25 例,卵巢转移13 例,脾转移10例,膀胱转移6例,脑转移7例,子宫转移6例,胰腺转移2 例,胆管转移1 例,肌肉转移4例(表2)。
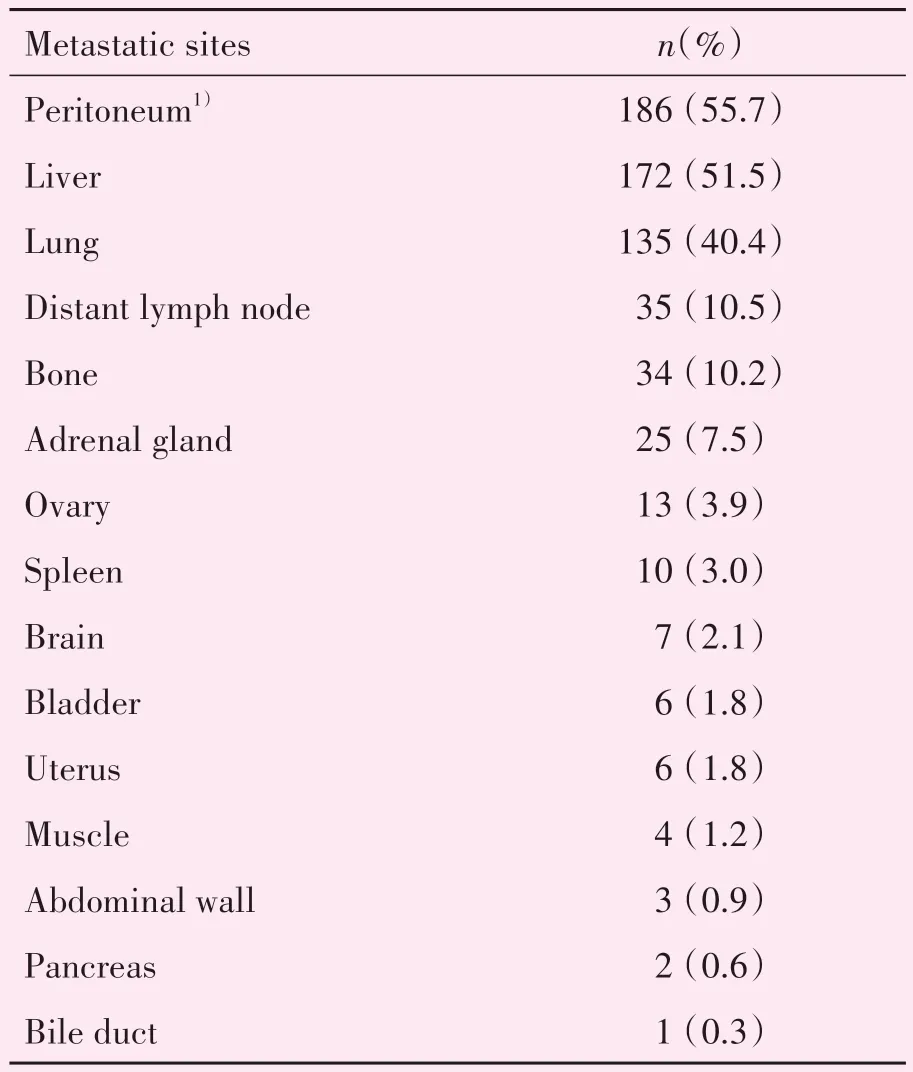
表2 334例肿瘤性死亡CRC患者转移部位情况Table 2 Metastatic sites in 334 CRC patients with tumor related death
2.3 肝、肺、腹膜转移的模式、差异及预后
肝、肺及腹膜是结直肠癌最常见的转移部位。本研究病例中,单一器官转移为肝27 例、肺21 例、腹膜转移63 例(表3)。合并肝肺转移35 例(10.5%)、合并肝腹膜转移44例(13.2%)、合并肺腹膜转移13例(3.9%;表4)。合并肝肺腹膜三器官均有转移的66 例(19.8%),死亡前未发现肝肺腹膜任意部位转移62例(表5)。

表3 单独肝、肺、腹膜转移之间的差异Table 3 Differences between liver,lung and peritoneal metastasis alone
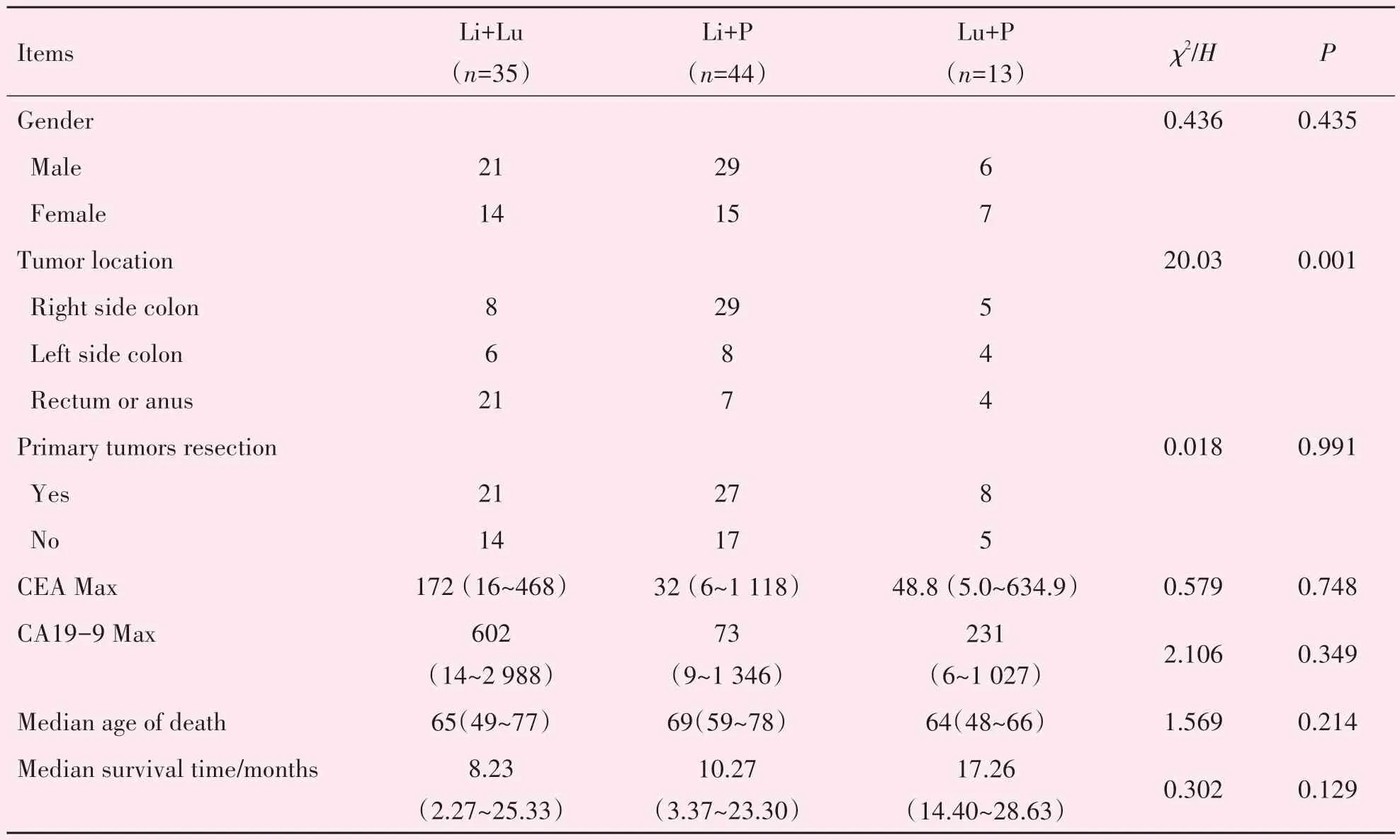
表4 肝+肺,肝+腹膜或肺+腹膜转移之间的差异Table 4 Difference between liver+lung,liver+peritoneum or lung+peritoneum metastasis

表5 合并肝肺腹膜转移与无肝肺腹膜转移之间的差异Table 5 Difference between combined hepatopulmonary peritoneal metastasis and non hepatopulmonary peritoneal metastasis
单一器官转移的病例在CEA 和CA199 最高值无明显差异,但在中位存活时间(P<0.001)以及中位死亡年龄(P=0.02)上存在差异。腹膜转移的中位年龄(60岁)明显低于其它两者(肝转移69岁,肺转移68 岁)。肺转移的中位存活时间(30 个月)明显长于其他两者(肝转移9 个月,腹膜转移13 个月)。合并任意两个器官转移的病例在原发肿瘤部位上存在差异(P<0.001),肝合并肺转移好发于直肠肛管肿瘤(21/35,60%),肝合并腹膜转移好发于右半结肠肿瘤(29/44,66%)。合并肝肺腹膜均有转移的患者在原发肿瘤部位(P<0.001),切除原发灶比例(P=0.01),CEA 最高值(P<0.001)和CA199最高值(P<0.001)上,与无肝肺腹膜转移者存在差异。
在生存分析中,单纯肺转移患者生存明显优于单纯肝转移或单纯腹膜转移(P<0.01,图1A)。合并任意2 个器官转移的病例生存无明显差异(P=0.44,图1B)。出现3 个部位转移患者生存明显差于2 个部位以及1 个部位出现转移的患者(P<0.01,图1C)。
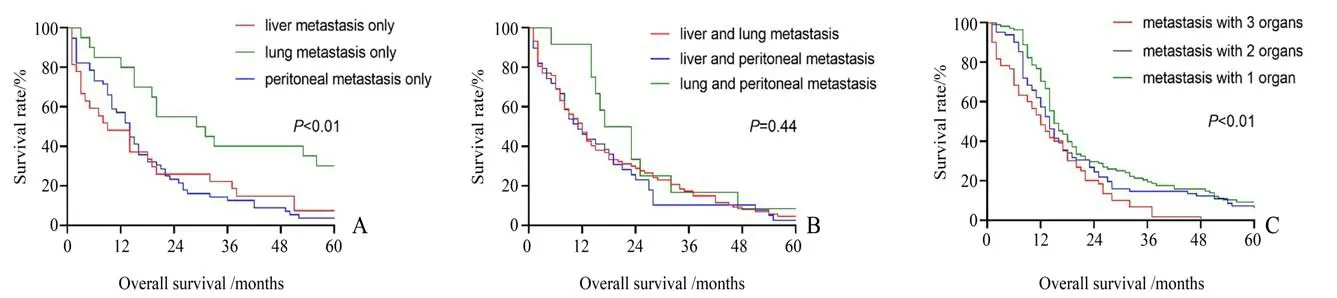
图1 不同转移模式患者的生存曲线比较Fig.1 Comparison of survival curves of patients with different metastasis modes
2.4 切除原发灶对转移的影响
本研究中共218 人进行手术切除原发灶,116人未切除原发灶。切除原发灶患者中肝转移率,占46.8%(102/218)。未切除原发灶患者中肝转移率60.3%(70/116)),有统计学差异。但是否切除原发灶与是否出现肺转移或腹膜转移,无明显相关(见表6)。COX 回归分析中亦发现,转移部位模式与预后明显相关(P<0.01),见表7。5 年生存率分析中,肝转移差于无肝转移者(P=0.04,),肺转移差于无肺转移者(P<0.01),但腹膜转移与无腹膜转移者无明显差异(P=0.35,图2)。
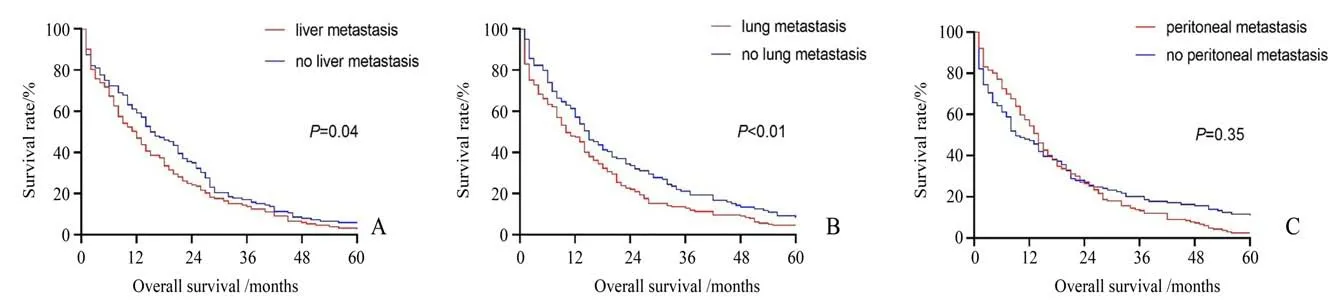
图2 肝、肺和腹膜转移对患者生存曲线的影响Fig.2 Effect of liver,lung and peritoneal metastasis on survival curve of patients

表6 切除原发灶与肝肺腹膜转移的关系Table 6 Relationship between resection of primary tumor and hepatopulmonary peritoneal metastasis

表7 结直肠癌死亡患者5年生存多变量Cox回归分析结果Table 7 Multivariate Cox regression analysis of 5-year survival in patients with colorectal cancer(N=334)
3 讨论
结直肠癌常见的转移部位为肝、肺以及腹膜。多个大样本报道结直肠癌的累积转移率为肝脏40%~50%,肺10%~20%,腹膜4%[5,14-15]。以上研究均以肠癌发病人群作为研究对象,观察随访时间有限,而且并未以肠癌死亡作为研究终点。Hugen等[16]通过1 679 例尸检报告回顾报导CRC 转移率分别为肝转移71%,肺转移38%,腹膜转移20%。Welch通过143例尸检报导CRC的转移数据分别为肝转移60%,肺转移43%,腹膜转移32%[17]。但以上数据是在尸体解剖的基础上作出的横断面结果,但并未包含生存数据。根据我们的搜索结果,本研究是第一个基于长期随访并以死亡作为观察终点,总结CRC 转移部位、模式以及相关生存数据的研究,并且填补了既往研究的空白。
在334 例肿瘤相关性死亡的病例资料中,肝、肺及腹膜转移仍是CRC 最常见的转移部位,但其比例高于既往报道。我们分别发现肝转移172 例(51.5%),肺转移135 例(40.4%)和腹膜转移186 例(55.7%)。我们也观察到其他器官部位的转移率为腹膜后-纵隔淋巴结转移10.5%,骨转移10.2%,肾上腺转移7.5%,卵巢转移3.9%,脾转移3%,膀胱转移1.8%,脑转移2.1%,子宫转移1.8%以及不足1%的胰腺、腹壁、胆管、肌肉转移。由于判断转移部位的检查均在患者死亡前进行,并且存在假阴性的情况,所以实际转移的部位和概率,必然会高于以上数据。另外,我们也观察到39 例非肿瘤相关性死亡,占总体患者的10.5%。这提示我们在结直肠癌综合治疗的过程中,除了关注肿瘤发展情况,亦要警惕麻醉及围手术期事件、心脑血管事件以及患者自缢事件的发生。
本研究以死亡患者作为研究对象观察CRC 的转移部位及模式。数据发现不同患者的转移模式存在较大差异。334名患者中有肝肺腹膜任意1个器官转移者111例,任意2个器官转移者92例,3个器官具有转移者66 例。这提示我们结直肠癌的转移部位及模式存在多样化,与肿瘤侵袭性存在着密切的关系。更重要的是,数据指出在肿瘤发展的过程中有159(47.6%)人未出现肝转移,195(58.4%)人未出现肺转移,145(43.4%)人未出现腹膜转移。这提示着不同患者器官微环境的差异也可能影响着转移的发生。Hugen 等[16]认为不同的转移模式由原发肿瘤特征、肿瘤负荷以及转移靶器官的免疫环境互相作用所导致。而我们的数据亦印证了这一观点。因此研究终末期仍未出现转移的某一特定器官转移的免疫环境特征,对预防以及治疗肿瘤转移具有重要的意义。
我们的数据亦发现转移部位以及模式影响着CRC 患者的生存。在肝肺腹膜单一部位转移的患者中,肺转移的生存曲线明显优于肝或腹膜转移(P<0.01)。而在多器官转移中,合并肝肺腹膜转移的患者生存曲线明显差于任意2个或1个器官部位转移的患者(P<0.01)。Shida[18]的研究指出,4期结直肠癌患者生存时间与转移部位器官的模式及数量有关。因此对于发现单纯肺转移,或者仅2 个器官部位出现转移的结直肠癌晚期患者,通过积极治疗避免或减少其他器官部位的转移,可延长患者的带瘤存活时间。
我们进一步分析发现,在24 个月生存率上,肝转移对比无肝转移患者为24.1%vs.34.8%(P<0.01),肺转移对比无肺转移患者为22%vs.33.6%(P<0.01)。然而,有无腹膜转移病人的24 个月生存率差异无统计学意义(腹膜转移对比无腹膜转移患者为26.3%vs.27.1%(P=0.87)。目前认为肝肺转移主要由通过门脉系统转移到肝及肺的脱落肿瘤细胞产生,而腹膜转移则由突破肠壁浆膜的肿瘤细胞直接播散种植于腹腔形成[19]。本研究数据亦提示切除原发灶的患者肝转移发生率更低(P=0.02),因此我们认为肝转移和原发肿瘤的负荷量相关。Huh 等[20]研究指出即使不切除肝转移瘤,单纯切除原发灶亦可改善4 期结直肠癌患者的生存。这提示我们通过积极的手术治疗或适当延长静脉化疗时间将有可能减少肝肺的转移,可能有助于改善患者的生存。本研究是可检索到的首个以死亡病例作为研究对象,总结结直肠癌终末期转移部位及模式特点的研究,并通过有效的随访数据,对各个器官转移对生存期的影响进行分析,为结直肠癌的研究补充了新的数据,为晚期患者的治疗策略提供了新的思路。本研究亦有一定的不足之处,例如无法获取在我院治疗但其他医院死亡的患者资料,数据来源为单中心,未进行尸体解剖及病理检查进一步验证转移等。但相信随着越来越多人关注并研究肿瘤患者死亡前转移模式及部位,将会有更多的方法使肿瘤病人获益。
综上所述,并非所有死亡结直肠癌患者都会出现肝肺腹膜同时转移。不同患者的转移部位及模式存在差异,并与生存相关。

