秸秆附着微生物对土壤养分、小麦根际细菌多样性及产量的影响
徐佳敏,王帅丽,穆心愿,赵 霞,唐保军,夏来坤,赵亚丽,刘天学
(1. 河南农业大学农学院,河南 郑州 450046;2. 河南省农业科学院粮食作物研究所/河南省玉米绿色精准生产国际联合实验室,河南 郑州 450002)
秸秆是重要的生物质资源,含有丰富的有机质及植物生长所需的氮、磷、钾及微量元素[1]。我国是农业大国,农作物秸秆资源量巨大[2]。2013—2017年我国粮食主要生产区小麦、水稻和玉米秸秆年均产量分别达到1.7 亿、2.3 亿、3.9 亿t,秸秆中的氮养分资源量分别达到108 万、209 万、356 万t[3]。秸秆直接还田能够改善土壤微生态环境、增强土壤酶活性[4],提高土壤养分含量、培肥地力[5-6],促进植株生长、增加作物产量[7-8]。但不科学的秸秆还田措施会影响作物的出苗率,造成秸秆腐熟耗氮与麦苗争氮形成弱苗,加重作物各种病虫害的发生,影响作物的产量和品质[9-10]。因此,积极探究秸秆腐解相关影响机制,为实现秸秆资源的全量无害化还田及秸秆还田技术的优化提供理论基础,对于实现秸秆资源的绿色、健康高效利用及农业可持续发展意义重大。
秸秆还田作为秸秆资源最直接有效的利用方式,目前在农业生产实践中已被广泛应用。长期定位秸秆还田试验的研究结果显示,秸秆还田可以提高土壤有机碳和养分元素含量[11]、降低土壤容重和改善土壤结构[12-13]。有研究表明,农作物秸秆直接还田可以显著改变土壤细菌群落[14],增加微生物数量[15]。赵亚丽等[16]的研究表明,秸秆还田有益于土壤微生物数量、酶活性和作物产量的提高。杨竣皓等[17]定量分析了全国范围内秸秆还田对3 种粮食作物的产量效应后发现,与秸秆不还田相比,秸秆还田后明显提高了3种作物的粮食产量,而且随着还田时间的延长,秸秆还田引发的增产效果会不断增加[18]。另外,秸秆还田还可通过增加小麦有效穗数、穗粒数和千粒质量,提高小麦产量[19]。秸秆还田作为直接的秸秆利用方式,其还田效果与还田方式、耕作方式、秸秆类型、土壤类型、腐解状况、环境状况等多种因素有关。虽然秸秆还田在提高土壤养分、增加作物产量方面发挥重要作用,但在实际生产应用中也存在一些问题,例如由于不合理的还田方式、不科学的还田量等引起还田后秸秆腐解慢、利用率低、产生有害物质、引起病虫草害等问题[20-22]。植物生长环境中存在各种微生物,附着在植物的表面和内部,被称为植物微生物组/群[23-24]。有研究发现,植物内部有相当丰富的微生物群落定殖,主要包括真菌和细菌[25-27]。研究表明,这些生长在植物表面或内部的微生物在植物生长和抗病中起着重要作用[24,28],但这些微生物随秸秆还田后对土壤、作物及微生物的具体影响尚不明确。目前,在农业生产中秸秆还田技术已得到广泛应用,国内外关于秸秆还田的研究主要集中在秸秆还田对土壤理化性质、土壤微生物多样性及下茬农作物生长发育和产量形成的影响,而秸秆还田过程中携带的微生物(以下简称秸秆附着的微生物)与土壤理化性状及作物生长发育之间关系研究的报道还较少,秸秆附着的微生物是否影响秸秆还田的效果有待进一步探讨。因此,通过设置秸秆灭菌还田与直接还田处理来探究秸秆附着的微生物对土壤养分、冬小麦生长状况及根际微生物多样性的影响,为实现秸秆还田技术的优化以及后续秸秆腐解相关影响机制的研究提供理论依据。
1 材料和方法
1.1 试验地概况
试验于2017—2018 年在河南省农业科学院河南现代农业研究开发基地(河南省原阳县,东经113°42′、北纬35°01′,海拔63.40 m)的自动遮雨棚内进行。试验所在地为温带大陆性季风气候,当地种植制度以冬小麦—夏玉米一年两熟制为主。试验土壤类型为潮土,0~20 cm 耕层土壤含有机质14.46 g/kg、碱解氮42.00 mg/kg、有效磷34.10 mg/kg、速效钾252.55 mg/kg。
1.2 试验设计
采用盆栽法进行试验,设置秸秆不还田(SR0)、秸秆灭菌还田(SRD)和秸秆直接还田(SR)3 个处理。每个处理设置10 盆,共计30 盆。盆规格:直径30 cm、高40 cm。土壤取自大田0~20 cm 耕层,土壤容重按1.30 g/cm3计算,每盆体积是28 260 cm3,每盆干土质量为36.74 kg,盆上口横截面面积为706.5 cm2。玉米秸秆来自取土地块,于玉米收获后割取距地表30 cm 以上植株部位,不与土壤接触,立即带回实验室,在无菌环境下切割成2~5 cm 段备用。秸秆灭菌处理采用高温高压蒸汽灭菌法,利用高压蒸汽灭菌锅灭菌(121 ℃,30 min)3 次,连续灭菌3 d。秸秆还田量按7 500 kg/hm2(干质量)计算,每盆秸秆用量为50 g(干质量)。模拟田间情况,将玉米秸秆与盆内0~20 cm 耕层土壤混匀。每盆加氮肥(NH4NO3)、磷肥(KH2PO4)、钾肥(KCl)各1 g 作底肥施入。供试小麦品种为郑麦7698,每盆播种20粒。根据土壤墒情,用无菌水浇灌,试验各处理其他栽培管理措施同一般大田管理方式。于2017 年10月20日播种,2018年5月30日收获。
1.3 测定项目与方法
1.3.1 土壤样品采集与分析 于2017 年试验处理前取3 份基础土样,于2018 年5 月12 日每个处理随机选3 盆,取5~15 cm 土层土样。将各处理各取样点的土壤分别充分混合均匀,室内自然风干,进行土壤养分测定。其中,土壤有机质含量采用重铬酸钾外加热法测定;土壤碱解氮含量采用碱解扩散法测定;土壤有效磷含量采用碳酸氢钠浸提—钼锑抗比色法测定;土壤速效钾含量采用火焰光度法测定[29]。
1.3.2 植株指标测定 于2018 年5 月30 日小麦成熟期,每个处理选取3盆,测定并记录株高、分蘖数、单株干物质量(于烘箱中105 ℃杀青30 min 后,80 ℃烘干至恒质量)、有效穗数、穗粒数、千粒质量、产量。
1.3.3 根际土壤微生物多样性测定 于2018 年5月12 日,每个处理选取3 盆,小心拔除小麦植株,挖取根系,抖落根际土,装入10 mL 离心管中,立即投入液氮中带回实验室,放入-80 ℃超低温冰箱内保存,用于微生物多样性测定。根际土壤样品总DNA 提取、PCR 扩增及序列测定均委托北京百迈客生物科技有限公司完成。具体操作:每个土壤样品取0.5 g,依照PowerSoil®DNA Isolation kit 试剂盒说明书进行土壤微生物基因组DNA 提取。以提取的DNA为扩增模板,使用细菌16S rRNA基因(V3+V4)区域引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增。PCR 反应体系为50 μL,PCR 反应条件:95 ℃预变性5 min;95 ℃变性60 s,50 ℃退火60 s,72 ℃延伸60 s,15 个循环;72 ℃终止延伸7 min。获得扩增产物后进行琼脂糖凝胶电泳检测、纯化,然后对测序文库进行定量和均一化。对构建好的文库首先进行文库质检,质检合格后使用Illumina Hiseq 2500高通量测序平台(北京百迈客生物科技有限公司)测序。
1.4 数据处理
首先使用Trimmomatic(version 0.33)对原始数据进行质检过滤,然后使用Cutadapt(version 1.9.1)进行引物序列的识别与去除,其后使用FLASH(version 1.2.7)对双端reads 进行拼接并去除嵌合体(UCHIME,version 4.2),最终得到高质量序列用于后续分析。应用Qiime软件在97%相似水平下对得到的高质量序列进行OTU(Operational taxonomic units)聚类和注释,然后对不同处理根际土壤细菌群落结构及多样性进行分析。从每个样本测序得到的所有序列中随机抽样,统计这些序列所代表的OTU 数,用抽到的序列数与其对应的物种数目来构建每个样本的稀释曲线,用于检验测序数据量是否足够反映样品中的物种多样性以及物种的丰富度。根据样本的OTU 丰度表,使用Mothur 软件对α 多样性指数进行计算,分别在门、纲分类水平下分析微生物群落结构及物种丰度差异。最后应用R(vegan)软件绘制 PCoA(Principal coordinate analysis)图,在属的水平上对各处理土壤细菌群落的多样性基于Bray-Gurtis 距离的非限制性进行主坐标(PCoA)分析;绘制RDA(Redundancy analysis)图,在门的水平上对各处理土壤细菌群落与环境因子进行冗余分析(RDA分析)。采用Excel 2010对试验数据进行整理统计;用SPSS 25.0软件进行方差分析(ANOVA)和处理间差异显著性检验(Duncan’s);用Excel 2010和SigmaPlot 14软件绘图。
2 结果与分析
2.1 秸秆不同还田处理对土壤养分含量的影响
如图1 所示,秸秆灭菌或直接还田均提高了土壤有机质和碱解氮含量,但增加幅度有差异;秸秆直接还田可显著提高土壤有效磷和速效钾含量,而秸秆灭菌还田却降低了土壤有效磷和速效钾含量。与SR0相比,SRD和SR处理的土壤有机质含量分别提高了7.29%和12.41%,碱解氮含量分别显著增加9.46%和12.13%(图1A、B),且SRD 与SR 处理间差异均不显著。与SR0相比,SR 处理土壤有效磷和速效钾含量分别显著提高9.50%和12.82%,SRD 处理则分别降低14.40%和5.13%(图1C、D),且SRD 与SR处理间差异均显著。

图1 秸秆不同还田处理对土壤有机质、碱解氮、有效磷和速效钾含量的影响Fig.1 Effect of different straw returning treatments on soil organic matter,alkaline nitrogen,available phosphorus and available potassium contents
2.2 秸秆不同还田处理对冬小麦产量形成的影响
2.2.1 秸秆不同还田处理冬小麦株高、分蘖数和单株干物质量 如图2 所示,秸秆灭菌或直接还田均提高了小麦株高、分蘖数和单株干物质量,且秸秆直接还田处理的增加幅度高于秸秆灭菌还田处理。与SR0 处理相比,SRD 处理的小麦株高、分蘖数和单株干物质量分别提高18.72%、28.21%和52.81%;SR处理的小麦株高、分蘖数和单株干物质量则分别显著提高36.60%、46.79%和141.57%。
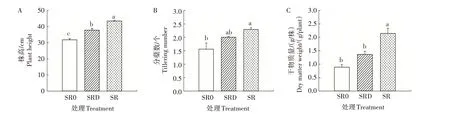
图2 秸秆不同还田处理对小麦成熟期株高、分蘖数和单株干物质量的影响Fig.2 Effect of different straw returning treatments on plant height,tillering number and dry matter accumulation per plant of wheat at maturity stage
2.2.2 秸秆不同还田处理冬小麦产量及产量构成因素 如表1 所示,秸秆灭菌或直接还田均提高了小麦产量及产量构成要素,且秸秆直接还田处理的有效穗数和产量增加幅度高于秸秆灭菌还田处理,而每穗粒数和千粒质量增加幅度则低于秸秆灭菌还田处理。与SR0 相比,SRD 处理的小麦有效穗数、每穗粒数、千粒质量和产量分别增加28.25%、42.88%、3.45%和91.80%;SR处理的小麦有效穗数、每穗粒数、千粒质量和产量分别增加46.76%、37.35%、0.03%和102.01%。
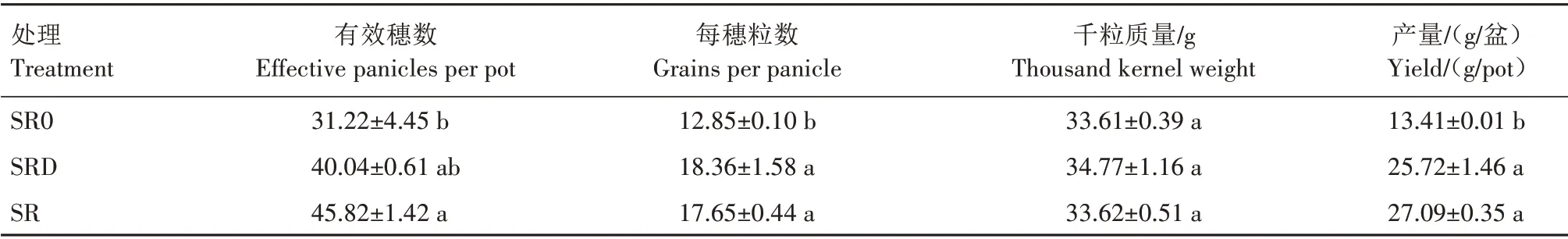
表1 秸秆不同还田处理对小麦产量及产量构成因素的影响Tab.1 Effect of different straw returning treatments on wheat yield and yield components
2.3 秸秆不同还田处理对小麦根际微生物多样性的影响
2.3.1 秸秆不同还田处理根际土壤样本细菌OTU稀释曲线分析 如图3 所示,9 个样本测序共获得

图3 97%相似水平下秸秆不同还田处理的稀释性曲线Fig.3 Rarefaction curves of soil samples with different straw returning treatments on the condition of 97%similarity
451 351 条有效序列,平均50 150 条。3 个处理样本平均覆盖率均高于99%,随着样品序列的逐渐增加,各个样本根际微生物细菌种类的稀释曲线趋于平缓。说明该测序深度达到饱和阶段,测序数据量基本覆盖样本中的所有物种,可以反映样本中的物种丰度。
2.3.2 秸秆不同还田处理根际土壤细菌α多样性分析 根据测序分析结果得到的物种注释信息,应用Alpha 多样性分析反映秸秆不同还田处理冬小麦根际土壤微生物群落丰富度(Chao 指数、Ace 指数)和多样性(Shannon指数)。如表2所示,各样品测序覆盖率均在99%以上,在97%相似水平下,SR0、SRD、SR 处理所含细菌OTU 数分别为1 718、1 763、1 783个,处理间差异不显著。其中,SR 处理OTU 数最多,说明SR 处理的小麦根际土壤微生物类群最丰富。SR 和SRD 处理的Ace、Chao、Shannon 指数均大于对照SR0处理,总体趋势为SR>SRD>SR0,且不同处理间差异不显著。由此表明,SR处理的小麦根际土壤微生物群落多样性和丰富度最高,SR0 处理的土壤微生物群落多样性和丰富度最低。秸秆不同还田处理均增加了小麦根际土壤细菌群落多样性,但增加幅度与秸秆是否带菌还田有关。
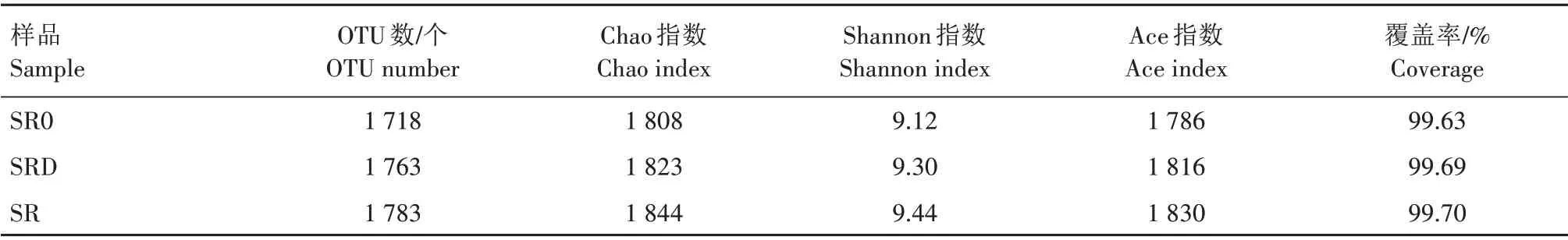
表2 秸秆不同还田处理土壤细菌丰富度和多样性指数分析Tab.2 Analysis of soil bacterial richness and diversity index under different straw treatments
2.3.3 秸秆不同还田处理根际土壤细菌群落结构分析 所有处理共检测到细菌类群1 878 个OTU,隶属于23 门81 纲128 目223 科373 属。其中,在门水平上相对丰度位于前十的土壤细菌群落组成如图4 所示。3 个处理土壤样品细菌菌群在门的层次下,所含物种种类相似。变形菌门(Proteobacteria)、酸 杆 菌 门(Acidobacteria) 、放 线 菌 门(Actinobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)是小麦根际土壤细菌的优势菌门,占所有细菌群落总数的90%以上。3个处理细菌相对丰度最高的均为变形菌门,在SR、SRD 和SR0 处理中的相对丰度分别为36.09%、35.90%和40.60%。与SR0 处理相比,SR 和SRD 处理中酸杆菌门、拟杆菌门、芽单胞菌门、绿弯菌门相对丰度均增加,而放线菌门的相对丰度则分别下降22.95%、17.96%。此外,与SR 相比,SRD 处理中变形菌门、酸杆菌门、芽单胞菌门的相对丰度分别下降0.53%、17.51%、8.50%。以上结果表明,秸秆不同处理还田后,根际土壤中各个优势菌门的相对丰度均出现不同程度的变化。

图4 秸秆不同还田处理在门水平的细菌群落相对丰度Fig.4 Relative abundance of soil bacterial communities on phylum level of different straw returning treatments
所有处理检测到的细菌分属于81个纲,在纲水平上相对丰度位于前十的土壤细菌群落组成见图5。α-变形菌纲(Alphaproteobacteria)、Subgroup_6、放线 菌 纲(Actinobacteria)、γ - 变 形 菌 纲(Gammaproteobacteria) 、 鞘 脂 杆 菌 纲(Sphingobacteriia)是小麦根际土壤细菌的优势菌纲。3 个处理中α-变形菌纲相对丰度最高,在SR、SRD 和SR0 中分别为16.95%、16.61%、21.73%。与SR0 处理相比,SR 和SRD 处理的Subgroup_6 细菌相对丰度分别增加41.07%、14.00%,放线菌纲细菌相对丰度分别下降了39.22%、32.44%。与SR 处理相比,SRD 处理的γ-变形菌纲、鞘脂杆菌纲分别增加13.96%、25.61%。此外,SRD 处理中隶属于变形菌门的β-变形菌纲(Betaproteobacteria)和δ-变形菌纲(Dehaproteobacteria)的细菌相对丰度均低于SR处理。
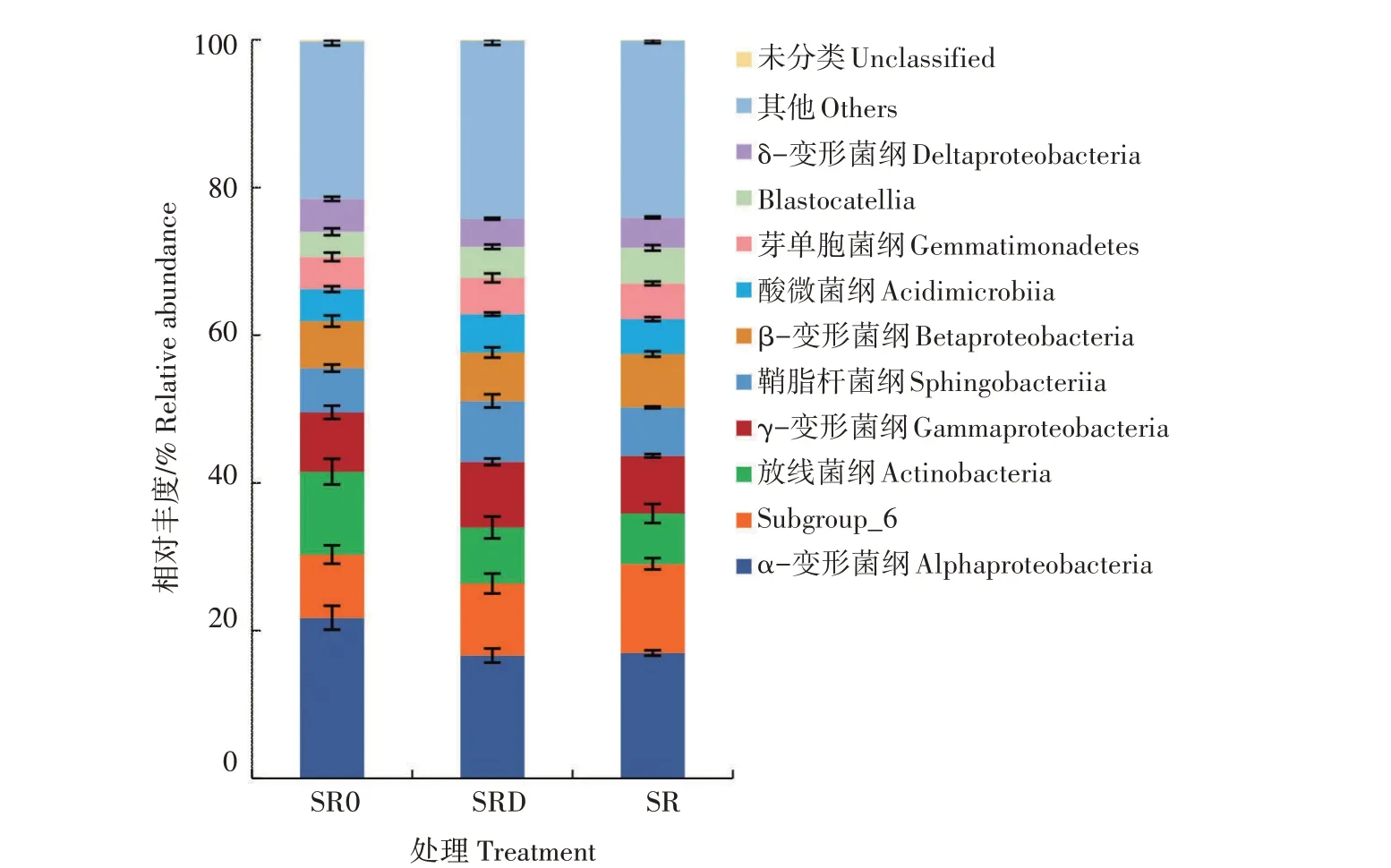
图5 秸秆不同还田处理在纲水平的细菌群落相对丰度Fig.5 Relative abundance of soil bacterial communities on class level of different straw returning treatments
2.3.4 秸秆不同还田处理根际土壤细菌群落组成的PCoA 分析 如图6 所示,PCoA 分析结果表明,主成分1和主成分2分别占47.11%和14.27%。3个处理的9 个小麦根际土壤样本细菌群落可以分为3组(SR0、SRD 和SR),说明3 个处理的根际细菌群落组成存在差异。SRD 与SR、SR0 处理在第2 轴上明显分开,说明秸秆灭菌还田对根际微生物群落组成会产生一定影响;SR、SRD处理与SR0处理在第1主轴上明显分开,说明秸秆还田对根际微生物群落组成具有重要影响。

图6 秸秆不同还田处理土壤样品细菌群落PCoA分析Fig.6 Principal coordinate analysis of bacteried community in soil samples of different straw returning treatments
2.3.5 秸秆不同还田处理根际土壤细菌群落组成与环境因子的RDA 分析 利用土壤理化性质与根际土壤丰度前十的细菌门进行RDA 分析,前2 个排序轴共解释42.79%细菌群落变化(图7)。图中箭头分别代表不同环境因子、微生物物种,物种与环境因子之间箭头的夹角表示物种与环境因子间的相关性。通过角度的大小可以判断不同指标间的正负相关性(锐角表示正相关、钝角表示负相关、直角表示无相关性)。RDA 分析结果表明,碱解氮(AN)含量与土壤有机质(SOM)、速效钾(AK)含量呈正相关;变形菌门丰度与SOM、AN 含量呈负相关,与有效磷(AP)含量呈正相关;酸杆菌门、硝化螺旋菌门(Nitrospirae)、芽单胞菌门的丰度与SOM、AN、AP、AK 含量均呈正相关;放线菌门和单糖菌门(Saccharibacteria)与SOM、AN、AP、AK含量均呈负相关;拟杆菌门和疣微菌门(Verrucomicrobia)与AP、AK 含量呈负相关;绿弯菌门和浮霉菌门(Planctomycetes)与SOM、AN 含量呈正相关,与AP、AK 含量呈负相关。上述结果表明,SOM、AN、AP 和AK 是影响细菌群落变化的关键土壤环境因子。环境因子的箭头与原点的连线长度代表着某个环境因子对样本群落结构组成影响程度的大小,连线越长,说明该环境因子对样本的群落结构组成影响程度越大。从箭头的长度来看,环境因子AN 和SOM 对样本的群落结构组成影响较大。

图7 秸秆不同还田处理土壤环境因子与细菌门水平的RDA分析Fig.7 Redundancy analysis of soil environmental factors and bacterial phylum level of different straw returning treatments
3 结论与讨论
秸秆作为植物有机残体,含有丰富的有机质和作物生长所需要的大量元素和微量元素。秸秆还田后养分转化是指在微生物的作用下进行矿质化和腐殖质化。本研究发现,秸秆直接还田后土壤中有机质、碱解氮、有效磷和速效钾的含量均显著提高,说明农作物秸秆还田能够有效增加土壤养分含量,这与前人研究结果一致[30-33]。秸秆灭菌还田后土壤中有效磷和速效钾的含量显著低于秸秆直接还田处理,可能是由于秸秆预处理方式影响了秸秆腐解状况,进而造成部分养分元素延迟释放所致,这与张珺穜等[34]的研究结果相似。另外,还田秸秆的腐解状况受土壤理化性状及自身结构组成等多种因素的影响[35],并且秸秆的腐解与秸秆上附着及秸秆内部的微生物也有关系[36]。因此,秸秆灭菌后还田对秸秆腐解过程及养分元素释放的影响还有待进一步研究。
大量研究表明,与秸秆不还田相比,秸秆还田显著提高了农作物产量[17]。秸秆还田能够改善土壤理化性质,提升土壤基础肥力,为下茬作物产量的增加奠定基础[37]。本研究结果表明,秸秆还田显著提高小麦的株高,无论秸秆灭菌与否,其还田后小麦的分蘖数、单株干物质量、小麦产量及产量构成因素明显增加,这与前人研究结果一致[38-39]。另外,SRD 处理的增产效应低于SR 处理,可能是由于秸秆灭菌还田影响了秸秆腐解,延迟个别元素的释放从而导致土壤肥力不足,进而影响下茬作物的生长发育。
土壤微生物作为衡量土壤肥力的重要指标,其对土壤的生态功能具有重要的维持作用[40],同时也是评价土壤质量和生产力水平的重要指标[41]。农田秸秆直接还田后对土壤微生物群落会产生一定的影响,秸秆还田能够显著改变土壤细菌群落[14]。本研究结果表明,秸秆不同还田处理小麦根际土壤微生物多样性和丰富度均有所增加,与胡蓉等[42]的研究结果相似。在门水平下,3 个处理根际土壤样品细菌菌群所含物种相似。其中,变形菌门、酸杆菌门、放线菌门、拟杆菌门、芽单胞菌门、绿弯菌门是供试根际土壤细菌的优势菌门,并且变形菌门的相对丰度最高,这与前人研究结果相似[43-44]。在纲分类水平下,α-变形菌纲物种数量最多,其次为Subgroup_6,这与前人研究结果一致[45]。其中,Subgroup_6、β-变形菌纲、Blastocatellia 的细菌相对丰度在秸秆还田后明显增加,这可能是由于秸秆中含有丰富的有机物,还田后给土壤中的微生物提供了充足的碳源和能源,促进了土壤菌群的增殖,从而提高了土壤微生物数量[15,46]。SR 处理中α-变形菌纲、Subgroup_6、β变形菌纲、Blastocatellia、δ-变形菌纲的细菌相对丰度均高于SRD,可能是由于灭菌引起了秸秆内部或表面微生物的变化,最终引起了土壤细菌群落的不同响应。PCoA 分析表明,秸秆还田是引起根际微生物群落变化的重要影响因素,与CHEN 等[14]的研究结果相似。本研究RDA 分析结果表明,土壤有机质、碱解氮是引起小麦根际土壤微生物群落变化的主要土壤环境因素。
综上所述,秸秆还田对土壤养分含量、冬小麦生长及产量形成和小麦根际土壤细菌群落多样性的影响与秸秆附着的微生物有关。秸秆还田可提高土壤有机质和碱解氮含量,其中,秸秆直接还田的提高幅度高于秸秆灭菌还田;秸秆直接还田处理提高了土壤有效磷和速效钾含量,而秸秆灭菌还田处理的土壤有效磷和速效钾含量则呈降低趋势。秸秆还田增加了小麦根际土壤细菌群落丰富度和多样性,改变了细菌群落结构。其中,秸秆直接还田的细菌群落丰富度和多样性最高。秸秆还田促进了冬小麦生长发育,提高了小麦株高、分蘖数、单株干物质量、产量及产量构成因素。其中,以秸秆直接还田处理增加幅度最高。秸秆附着的微生物参与了秸秆还田后土壤养分循环,影响冬小麦根际微生物群落组成,进而影响冬小麦生长发育及产量形成。因此,农作物秸秆直接还田仍然是目前最有效、环保的还田方式。

