小熊猫粪便中纤维素降解菌株的筛选、基因改造及生物合成聚羟基丁酸酯条件的优化
刘童童,卢晨曦,原楚妍,陈 怡,吴 弘
(1.天津师范大学 生命科学学院,天津300387;2.天津师范大学 天津市动植物抗性重点实验室,天津 300387)
纤维素是一种廉价且分布广泛的多糖物质,是世界上最丰富的可再生资源.纤维素分解菌可高效、安全、无污染地将纤维素转化为葡萄糖、乙醇等产品,既可以解决环境污染,也可以缓解能源危机及浪费等问题[1].细菌纤维素分解菌的发掘及基因组学研究是高效利用纤维素的关键环节,在已研究的众多菌株筛选来源中,食草动物由于食性与纤维素的关系密切,其消化道和粪便等都成为筛选纤维素降解细菌的重要菌种来源[2-4].虽然通过不同途径获得了一些可以降解纤维素的菌株,但很多菌株的酶活低、环境适应性差,因此,分离和筛选可工业化生产的菌株仍然是纤维素分解利用的重要研究方向.纤维素降解菌的高值化利用也是纤维素研究领域的一个热点课题,其中,利用纤维素降解菌生产聚羟基丁酸酯(PHB)是新的研究方向.PHB可以在微生物体内积累,具有与传统塑料相似的力学性质,还具有独特的生物降解性,有助于解决“白色污染”问题[5].在微生物体内,共有3个酶参与PHB合成:β-酮基硫解酶(PhaA)、依赖I-DPH的乙酰乙酰辅酶A还原酶(PhaB)和PHA合成酶(PhaC)[6].研究人员将罗氏真养菌(Ralstonia eutropha)中PHB代谢途径的3个基因phaA、phaB、phaC克隆出来,将其整合到1个质粒上并提高质粒稳定性,构建能够以葡萄糖为底物合成PHB的重组菌[7].葡萄糖价格偏高,如果发掘出能够以纤维素为底物的菌株合成PHB,将有助于提高菌株的高值化开发,促进可降解塑料的推广.
小熊猫(Ailurus fulgens)以富含纤维素的竹子为食物,体内存在有助于消化纤维素的微生物,因此可以作为筛选纤维素降解菌的研究对象,从其粪便中发掘产纤维素酶的菌株[8].本研究从小熊猫粪便中筛选出能够高效分解纤维素的菌株,结合形态学观察、生理生化特征和16S rDNA序列分析方法,对菌株进行鉴定.以来自罗氏真养菌(Ralstonia eutropha)的基因为模板,将PHB合成途径中的基因phaA、phaB和phaC转入到菌株中,得到重组菌株.以玉米秸秆为碳源进行重组菌株合成PHB的发酵实验,用响应面分析确定重组菌株生物合成PHB的最优条件,包括温度、培养起始pH值、摇床转速等.本研究一方面拓展了已有的可分解纤维素的菌种资源库;另一方面,能够为利用廉价碳源生物合成PHB提供实验基础.
1 材料与方法
1.1 材料
实验样品来源于天津市动物园,对小熊猫饮食及健康状况进行筛选后,获得新鲜的小熊猫粪便.
1.2 主要仪器与试剂
仪器:GC-2014C型气象色谱仪,日本岛津公司;Hitachi HF5000型透射电镜,日本日立公司.
试剂:DNA聚合酶,美国NEB公司;蛋白胨、葡萄糖、琼脂粉等,中国医药集团有限公司;3HB标准品,北京蓝晶微生物科技有限公司.引物和测序工作由华大基因完成.
1.3 实验方法
1.3.1 富集培养
选取小熊猫粪便样品的中间部分,称取10 g,将其放入含有90 mL无菌水的锥形瓶中,连续摇动20 min,摇晃充分以制备菌悬液,随后进行平板筛选以获得单一菌落.
1.3.2 菌株筛选
将富集培养的单一菌液涂布在羧甲基纤维素钠(CMC-Na)初筛培养基上,待菌落生长至适宜大小后,用1%的刚果红染色20 min,用浓度为1 mol/L的NaCI溶液彻底冲洗去染料,观察透明圈是否有变化.选取培养基上较完整的菌落进行测量,记录透明圈直径D和菌落直径d,计算比值D/d.对实验样本进行横向比较,筛选比值较大的实验对象[9].
1.3.3 纤维素酶(CMCase)活力测定(DNS法)
菌株接种入发酵产酶培养基中培养,取样,留上清液作为粗酶液.以1 mg/mL葡萄糖标准溶液作为底物,测定OD540值,绘制标准曲线,具体原理参考文献[9-10].
1.3.4 滤纸分解实验
取多条大小相同的滤纸条于锥形瓶中,将菌液滴加到以滤纸条为唯一碳源的液体培养基中(菌液应没过滤纸条,使之充分分解),空白对照组为不接种菌株的培养液.摇床连续培养后记录,确定滤纸分解情况[10].
1.3.5 菌株的鉴定
细菌在含有CMC-Na的培养基中生长一段时间后,观察并记录菌落的形状、大小、透明度、颜色、质地等.采用革兰氏染色法,借助显微镜观察细菌的大小、结构,记录其形态和染色特征.菌株的生理生化性质描述参考《伯杰细菌鉴定手册》[11].挑取单菌落进行培养后,以细菌基因组DNA为模板,采用细菌通用引物进行基因扩增:上游引物16S(F)为5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物16S(R)为5′-GGTTACCTTGTTACGACTT-3′.扩增后进行序列分析[10,12].
1.3.6 PHB合成途径构建及检测
以来自罗氏真养菌的基因为模板,将PHB合成途径中的基因phaA、phaB和phaC构建在表达质粒pBBR1-mcs1中,得到重组质粒3hb.随后将该重组质粒转入到筛选出来的菌株中,合成了一条从碳源到PHB的代谢途径.
以玉米秸秆为碳源进行菌株合成PHB的发酵实验.在不同发酵阶段取样,测定发酵液的干重和其中PHB的含量.取菌液,离心富集后用去离子水反复洗涤以得到较干净的菌体,采用气相色谱法(GC)分析菌体中的PHB含量.以3HB标准品为标样,先将标准品和待测品一起进行酯化,随后进行气相色谱分析,采用内标法准确计算出菌体中PHB的质量分数(%)[13].利用透射电镜观察PHB颗粒在菌株中的分布情况.首先在菌液中加入戊二醛固定细菌,然后进行预处理,制备切片,镀膜进行观察.
1.3.7 响应面曲线分析
基于Box-Behnken Design(BBD)原理进行实验设计,影响细菌生长的因素包括培养温度(A)、初始pH值(B)和摇床转速(C),将其设置为高、中、低3个水平(1,0,-1).通过Design Expert 8.0进行拟合,再利用方差分析和显著性分析确定优化模型在本实验中的可靠性.比较计算得出理论最优产量,进一步验证培养条件优化的准确性[14].
2 结果与分析
2.1 菌株的筛选与鉴定
利用刚果红染色法从小熊猫粪便中初筛得到5株菌.首先测定透明圈直径,随后以CMCase酶活为指标进行复筛.绘制得到的葡萄糖标准曲线方程:y=0.669 5 x+0.020 5(R2=0.999 8),其中x为葡萄糖的质量,y为540 nm处的OD值.利用该方法测定初筛得到的5株菌,其透明圈直径、CMCase酶活等如表1所示.
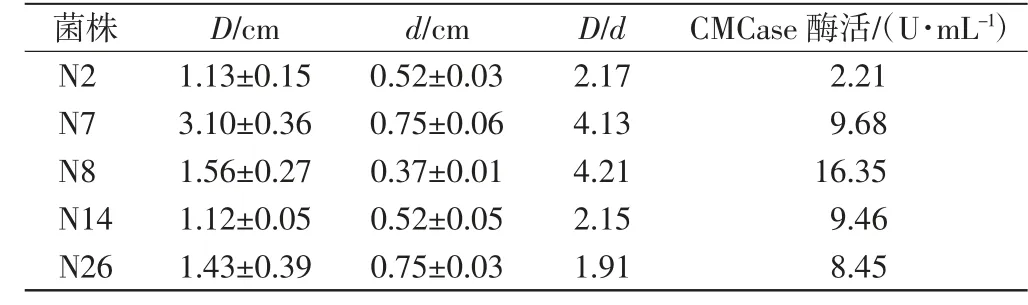
表1 筛选菌株的D/d值与CMCase酶活Tab.1 D/d values and CMCase enzyme activity ofscreened strains
由表1可知,N8菌株的D/d值为4.21,测定的CMCase酶活为16.35 U/mL,远大于其他菌株的酶活性,表现出较高的产纤维素酶的能力.
N8菌株的菌落形态特征如图1(a)所示,在培养基上,N8菌株的菌落扁平,呈不透明状,颜色为灰白色无光泽,表面粗糙不光滑,边缘不规则,质地为蜡状.对N8菌株进行生理生化检测,结果显示:革兰氏染色、芽孢染色、V-P实验均为阳性;硫化氢、甲基红、吲哚实验结果均为阴性;待测菌株可利用葡萄糖、淀粉和羧甲基纤维素钠,不能利用蔗糖.对N8菌株进行DNA提取,利用16S rDNA进行PCR扩增后得到1.5 kb的片段,如图1(b)所示.对PCR结果进行测序后,在NCBI进行BLAST比对,利用MEGA7.0进行多重序列比对并构建系统发育树.结合N8菌株形态特征、生理生化特征以及16S rDNA分子鉴定结果发现,N8菌株近缘物种为枯草芽孢杆菌(Bacillus subtilis),相似度高达99%,因此初步认定筛选出的是一株芽孢杆菌,命名为Bacillus subtilis-N8.
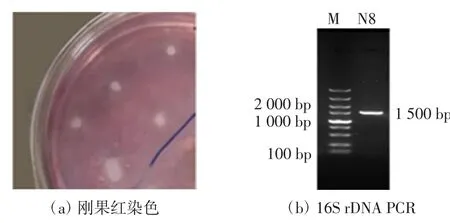
图1 N8菌株的刚果红染色和16S rDNA PCRFig.1 Results of Congo red staining and 16S rDNA of Strain N8
对初筛得到的5株菌进行滤纸条降解实验,结果显示,5株菌中N8菌株对滤纸条的降解效果最好.在实验开始后的第8天,滤纸条出现结构崩解现象,培养基从澄清状态变得稍显浑浊.在实验开始后的第12天,培养基中滤纸条边缘溃烂,滤纸条由一整片分解为3块面积不等的碎片,结构明显崩解,培养基中出现滤纸条崩解后的碎屑,培养基浑浊情况加剧.在实验开始的第15天,滤纸条完全降解为碎屑状态,培养基状态较滤纸条崩解的初期出现絮状物质.实验结束时,培养基颜色变深,浑浊程度继续加剧,滤纸条彻底降解完毕,全部为碎屑状态,无明显块状.
2.2 构建可合成PHB的重组菌株
配制以葡萄糖、大麦秸秆、玉米秸秆等为单一碳源的产酶发酵基础培养基,培养后通过测定CMCase酶活来检测利用效率,结果如图2所示.由图2可以看出,以玉米秸秆为单一碳源的发酵培养基产酶活力最高,且价格低廉,可作为N8菌株的最佳碳源.
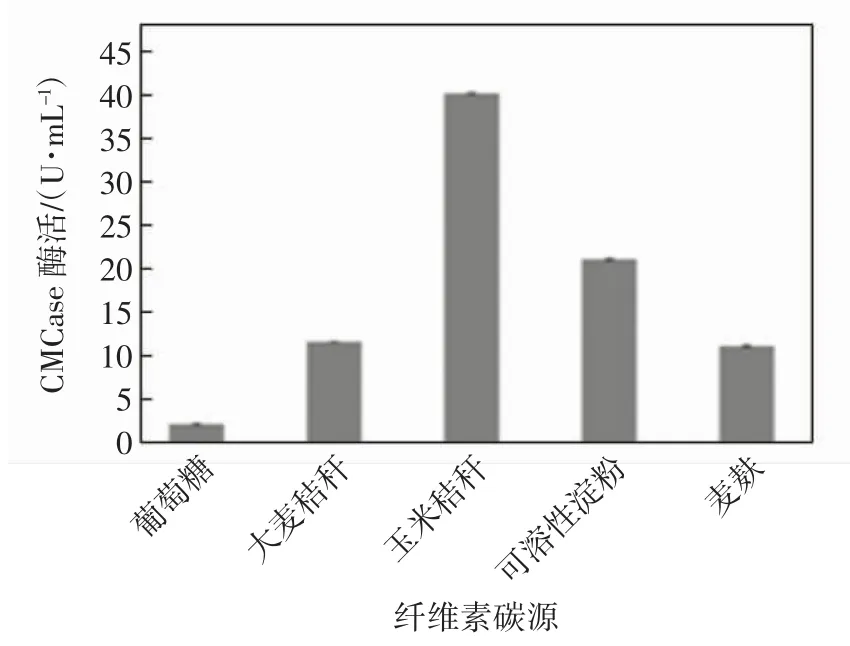
图2 不同碳源下N8菌株产纤维素酶的活性Fig.2 CMCase activity produced by strain N8 using different carbon sources
构建可合成PHB的重组质粒3hb,随后将该质粒转入到N8菌株中,得到重组菌株Bacillus subtilis-N8(3hb),培养后,接种到发酵罐中进行扩大培养,以玉米秸秆为碳源,观测菌体内PHB的积累情况.结果发现,培养一段时间后,重组菌株体内开始积累PHB,如图3所示.

图3 重组菌株Bacillus subtilis-N8(3hb)中PHB的合成Fig.3 Synthesis of PHB in recombination strain Bacillus subtilis-N8(3hb)
2.3 PHB的合成及响应面法优化培养条件
选取菌株Bacillus subtilis-N8(3hb)发酵条件中的温度、培养起始pH值、摇床转速3个因素作为响应面法的研究对象,设计各因素水平如表2所示.用软件Design Expert 8.0进行设计,以PHB产量作为实验的衡量指标,17组实验的结果如表3所示.

表2 BBD实验设计因素水平表Tab.2 BBD experimental design factor level
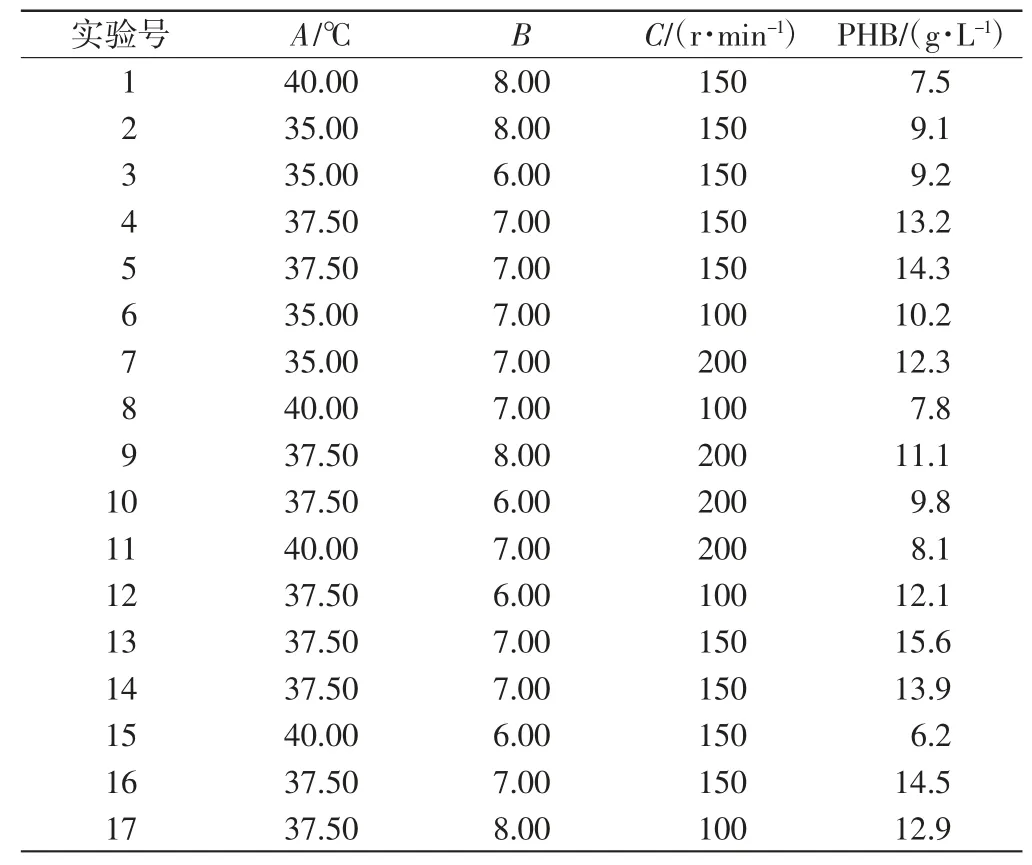
表3 BBD实验设计及实验结果Tab.3 BBD experimental design and experimental results
根据实验结果,用软件Design Expert 8.0进行分析,得出回归线方程:
PHB产量(g/L)=14.30-1.40A+0.41B-0.21C+0.35AB-0.45AC+0.12BC-4.09A2-2.21B2-0.61C2
2.3.1 方差分析
进一步通过方差分析来确定模型拟合度是否显著以及单一因素和每2个因素间的相互作用是否显著,结果如表4所示.在分析过程中,P<0.05表示相关性具有统计学意义.根据BBD实验结果进行分析,实验所得回归拟合度P值为0.002 9,小于0.05,该模型回归显著性好,说明重组菌中PHB的产量与设置的实验因素之间存在明显的回归关系.失拟值P值为0.195 7,大于0.05,说明模型的失拟不显著.此外,该模型的实验系数为0.929 2,表明回归方程求得的PHB产量预测值的可信度为92.92%.对P值的分析表明,温度因素对PHB产量影响显著,培养起始pH值和摇床转速对PHB产量的影响不显著.而相互作用分析发现:AB、AC、BC相互作用不显著;A2、B2二次项作用显著,C2二次项作用不显著.
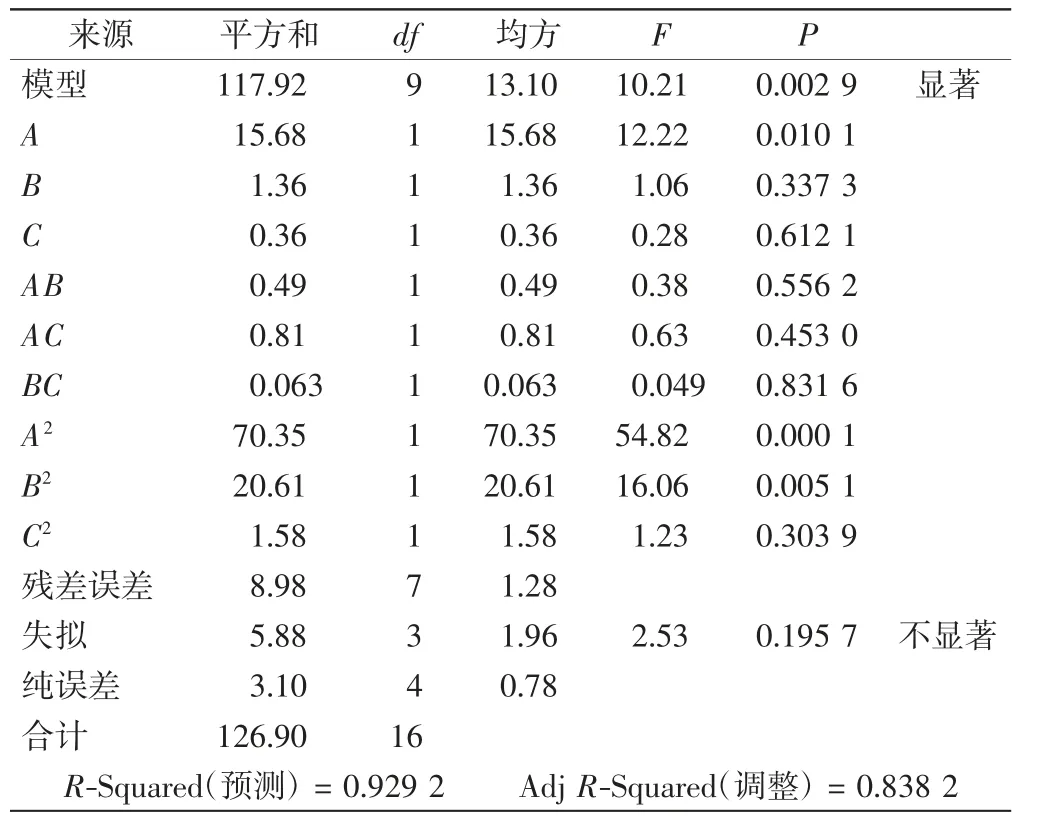
表4 BBD实验结果分析Tab.4 Analysis of BBD experimental results
2.3.2 响应面3D图与平面等高线
利用Design-Expert,以2个因素间的交互作用绘制出响应面图和等高线图,响应面曲面上凸,说明有最大响应值以及最适的变量;等高线为椭圆形,说明2个因素的交互作用显著.温度与培养起始pH值的交互作用响应面图和等高线图如图4所示.从图4可以看出,当摇床转速固定不变,温度在35.0~37.5℃区间、培养起始pH值在6~7区间时,PHB产量随二者的升高而升高,呈正相关.当温度在37.5~40.0℃区间、培养起始pH值在7~8区间时,PHB产量随二者的升高而降低,呈负相关.
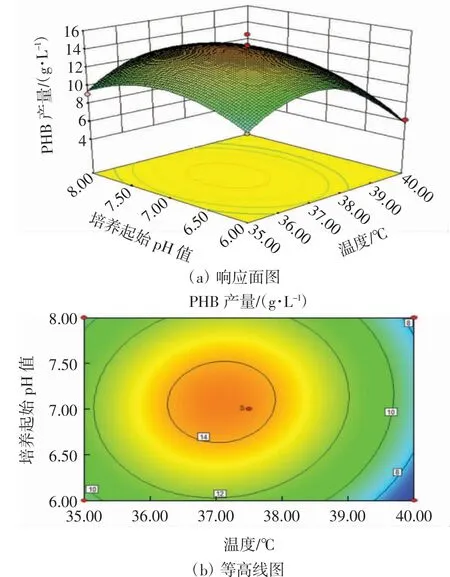
图4 温度与培养起始pH值的交互作用响应面图和等高线图Fig.4 Response surface and contour map of the interaction between temperature and initial pH
温度与摇床转速的交互作用响应面图和等高线图如图5所示.
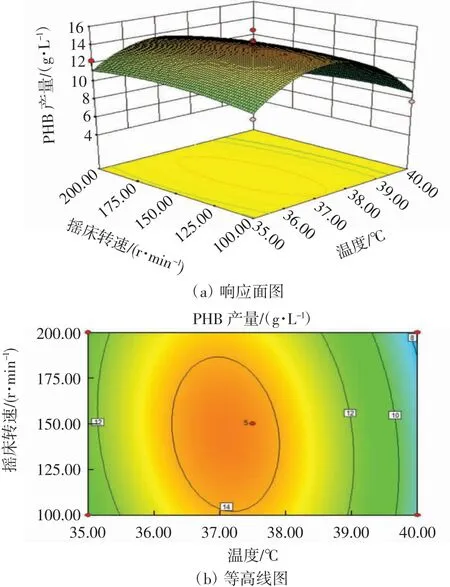
图5 温度与摇床转速的交互作用响应面图和等高线图Fig.5 Response surface and contour map of the interaction between temperature and shaking speed
从图5可以看出,当培养起始pH值固定不变,温度在35.0~37.5℃区间、摇床转速在100~150 r/min区间时,PHB产量随二者的升高而升高,呈正相关.当温度在37.5~40.0℃区间、摇床转速在150~200 r/min区间时,PHB产量随二者的升高而降低,呈负相关.
摇床转速与培养起始pH值的交互作用响应面图和等高线图如图6所示.
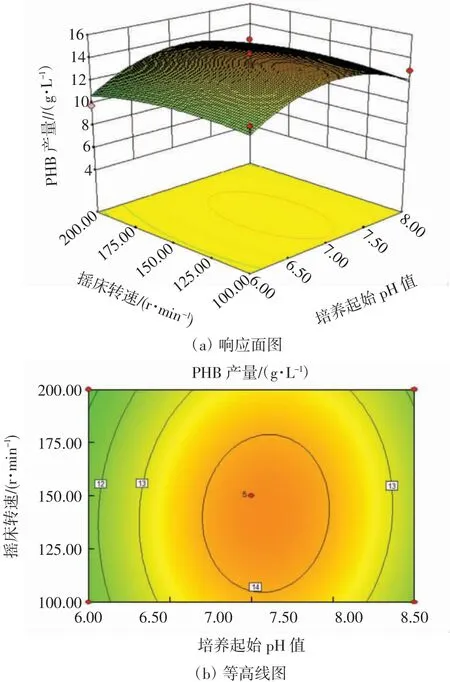
图6 培养起始pH值与摇床转速的交互作用响应面图和等高线图Fig.6 Response surface and contour map of the interaction between the initial pH and shaking speed
从图6可以看出,当温度固定不变,摇床转速在100~150 r/min区间、培养起始pH值在6~7区间时,PHB产量随二者的升高而升高,呈正相关.当摇床转速在150~200 r/min区间、培养起始pH值在7~8区间时,PHB产量随二者的升高而降低,呈负相关.
对响应面模型进行求导分析,结果显示,温度为37.09℃、培养起始pH值为7.08、摇床转速为144.72 r/min的情况下,PHB的产量最高,预计达到14.44 g/L.为了检验响应面法的可行性,用得到的最优条件对菌株Bacillus subtilis-N8(3hb)进行液体发酵验证,最终PHB产量为15.98 g/L,与预测值14.44 g/L较为接近,说明此响应面模型可信.因此,通过响应面法对重组菌株Bacillus subtilis-N8(3hb)进行发酵条件优化是可行的.
3 讨论与结论
本研究采用刚果红染色法从小熊猫的粪便中筛选出具有纤维素降解能力的菌株,根据染色形成的透明圈大小初步判断细菌降解纤维素的能力,复筛时测定纤维素酶活力并进行滤纸分解实验,最后结合形态学观察、生理生化特征和16S rDNA序列测定,发现该菌株与Bacillus subtilis相似度高达99%,因此确认菌株为Bacillus subtilis-N8.以来自罗氏真养菌的基因为模板,将PHB合成途径中的基因phaA、phaB和phaC转入到N8菌株中,得到可以合成聚羟基丁酸酯(PHB)的重组菌株Bacillus subtilis-N8(3hb).有研究证明微生物以半纤维素水解物为碳源可以生产PHB.如Yu等[15]利用蔗渣水解液生产PHB,其产量可占干细胞质量的57%.Dietrich等[16]利用半纤维素水解物和木质纤维素降解产物作为碳源进行PHB生产,最高产量为5.72 g/L.半纤维素水解物常常会带有抑制细胞生长的物质,因此需要进行脱毒处理或高接种量来克服抑制作用,以维持细菌生长.本研究筛选出的能够利用玉米秸秆为碳源生产PHB的菌株,因无需对纤维素水解液进行脱毒处理,可大大降低PHB的合成成本.
为了进一步探索重组菌株Bacillus subtilis-N8(3hb)的最适发酵条件,利用响应面法,选取温度、培养起始pH值和摇床转速3个因素作为研究对象,优化发酵条件,结果显示在温度37.09℃、培养起始pH值为7.08、摇床转速为144.72 r/min的培养条件下,菌株具有最高的PHB产量(15.98 g/L),远超过Dietrich等[16]的研究中PHB的产量.本研究发现的新菌株为纤维素的开发和利用提供了良好的菌种资源,也为利用纤维素等廉价碳源合成高附加值的PHB材料提供了新途径.

