黄土高原生物结皮形成过程中土壤胞外酶活性及其化学计量变化特征
姚宏佳, 王宝荣, 安韶山,2, 杨娥女, 黄懿梅
(1.西北农林科技大学水土保持研究所,黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西 杨凌 712100;2.中国科学院水利部水土保持研究所,黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西 杨凌 712100;3.中国科学院大学,北京 100049;4.西北农林科技大学资源与环境学院,农业部西北植物营养与农业环境重点实验室,陕西杨凌712100)
生物土壤结皮(Biological Soil Crusts,BSCs)是细菌、真菌、藻类、地衣、苔藓与土壤颗粒形成的有机复合体[1],其覆盖全球1.79×107km2的面积,占全球地表面积的12.2%[2]。BSCs可以增强土壤团聚性和稳定性,改善土壤通气和孔隙度,促进维管植物定植以及提高微生物群落的相对丰度,在荒漠生态系统中扮演了重要的生态作用[3]。BSCs 通过表层的微生物光合固碳过程改善土壤质量,在全球土壤碳循环过程中起重要作用[4]。随着BSCs的发育,土壤底物的复杂程度增加,增加了酶促底物供给,促进了土壤酶活性。近年来,BSCs与土壤酶活性的密切关系引起了广泛关注。BSCs 的形成导致植物源大分子物质增加,土壤微生物释放出胞外酶来降解难分解的植物大分子,降解后的小分子被微生物再次利用,并参与土壤C、N、P循环[5]。
土壤胞外酶主要来源于土壤中动植物、微生物活动及其残体的分解释放,可以将高分子有机化合物降解为可同化的分子,在调控土壤有机质(Soil Organic Matter,SOM)降解和养分循环过程中发挥着重要作用[6]。而土壤酶化学计量是指生态系统中参与营养元素C、N、P循环的土壤酶活性的比值,包括“C-获取酶”(如半纤维素酶、纤维素酶和葡萄糖苷酶)、“N-获取酶”(如脲酶、几丁质酶和肽酶)和“P-获取酶”(如磷酸酶)[7],其中最常见的参与C、N、P循环相关胞外酶包括β-1,4-葡萄糖苷酶、β-1,4-N-乙酰基氨基葡萄糖苷酶、亮氨酸氨基多肽酶和磷酸酶。土壤酶生态化学计量反映了微生物的生长代谢和营养需求与环境养分有效性之间的生物地球化学平衡[8-9],其为理解土壤中养分限制、循环和平衡的过程提供了理论参考[10]。吴秀芝等[11]研究得出荒漠草地沙漠化过程中,土壤胞外酶的活性逐渐变弱,BG:AP和NAG:AP基本表现为增加趋势。目前对土壤胞外酶活性的研究主要集中在森林和草地[12-13],而BSCs的形成对土壤胞外酶活性及其化学计量的影响知之甚少。在BSCs发育过程中,土壤性状与微生物群落存在耦合作用和协同变化,由于BSCs 处于地气界面,微生物更容易受到扰动,因此研究胞外酶活性更需要注意土壤微生物的内稳性的探索[14]。
近年来,BSCs成为黄土高原退耕后普遍存在的地表覆被物[15],包括藻类、地衣、藓类以及混生为主的各种不同类型[16]。BSCs 广泛分布于干旱半干旱地区的草原、森林/草原和森林,在草原的覆盖度比例可达60%~70%[17],在提高土壤稳定性、增强土壤抗侵蚀能力、改善土壤养分等方面发挥着重要作用[3,18-19]。目前关于BSCs的类型和演替对土壤养分的影响已有大量报道,但关于黄土高原BSCs发育如何通过调控土壤胞外酶活性和土壤理化性质,从而对土壤酶化学计量特征产生影响仍需要深入研究。因此,本研究通过调查黄土高原BSCs不同发育序列的土壤胞外酶活性的变化,研究BSCs的形成过程对土壤胞外酶其化学计量特征的影响,探明BSCs在沙区资源生态关系中的效用,深入理解荒漠生态系统养分循环过程。
1 材料与方法
1.1 研究区概况
研究区六道沟小流域地处黄土高原北部,位于陕西省神木县以西14 km 处(110°21′~110°23′E,38°46′~38°51′N)[16](图1)。该小流域面积约为6.89 km2,气候属中温带半干旱类型,冬季和春季干旱多风,海拔为1094.0~1273.9 m,年均温度为8.4 ℃。年降雨量为408.5 mm[15],多年平均降雨量为437.4 mm,年际变化较大,暴雨集中在夏秋季6—9 月,此期间降雨量在全年降雨量占比70%~80%,年潜在蒸发量大于1000 mm[20]。该区域在实行多年退耕还林还草工程后,生物土壤结皮广泛分布。六道沟小流域的生物土壤结皮主要包括藻结皮、混生结皮和藓结皮,结皮盖度大多介于60%~70%。这些生物土壤结皮主要分布于梁峁坡或梁峁顶上,占流域面积的60.7%[17]。

图1 采样点地理位置示意图Fig.1 Location of sampling sites
1.2 土壤样品采集
在神木县六道沟小流域选取不同发育阶段的生物土壤结皮,主要为裸沙地(CK),全藻结皮(以蓝藻为优势群落,A),藻-藓混生结皮(藓结皮数量<20%,AM),藓-藻混生结皮(藻结皮数量<20%,MA),全藓结皮(以土生对齿藓为优势种,M)5 个阶段的土壤作为研究对象(表1)。在每个结皮发育阶段选择了5个具有代表性的样地(坡向、坡位一致且坡度相差不大,每个样地的大小为40 m×40 m,且任何2个样地之间的距离超过100 m),在每个样地中,采用“S”形随机采样策略,选择12~15 个小的采样点。将每个样地的12~15个采样点的土壤样品混合消除误差,获得大约2 kg 的代表性样品。样品采集于2018年8月,共采集了95个代表性样品(5个结皮发育阶段×5 个野外重复×4 个土层),包括生物土壤结皮层(BSCs 层)和结皮层下的0~2 cm,2~10 cm 和10~20 cm 4 个层次的土壤样品。BSCs 层指的是生物土壤结皮层,它由隐花植物和相关的土壤微生物的复合体组成,与表面土壤颗粒胶着。测量的全藻结皮、藻-藓混生结皮、藓-藻混生结皮、全藓结皮的生物结皮层厚度,分别约为7.2±2.2 mm、9.6±1.9 mm、11.1±1.9 mm和10.9±1.8 mm。在仔细彻底地清除土壤中的苔藓组织和残留物后,将收集的样品放入装有冰袋的泡沫箱,并在24 h 内移至4 ℃的冰箱中。土壤样品被分成两部分:一部分在一周内立即分析胞外酶活性,另一部分风干后过0.15 mm 筛用于土壤理化性质分析。

表1 样地基本信息Tab.1 General information of the investigated sites
1.3 土壤样品测定
土壤有机碳(SOC)含量采用重铬酸钾-外加热容量法测定;土壤全氮(TN)H2SO4-混合加速剂催化消煮,凯氏定氮仪KDY-9380测定;土壤全磷(TP)采用H2SO4-HClO4消化-钼蓝比色法测定[21]。
土壤胞外酶活性使用多功能酶标仪(瑞士Tecan Infinite M200 PRO 型)通过96 微孔板荧光法测定[12]。测定原理是利用荧光物质(4-甲基伞形酮,MUB;7-氨基-4-甲基香豆素,7-amino-4-methylcoumarin)的共扼物质作为测定底物(表2),接种土壤悬浊液至96孔微孔板中,测定具有代表性酶活性[7],包括1 种参与碳循环的酶(β-1,4-葡萄糖苷酶,BG)、2 种参与氮循环的酶(亮氨酸氨基多肽酶,LAP;β-1,4-乙酰基氨基葡萄糖苷酶,NAG)和1种参与磷循环的酶(碱性磷酸酶,AP)。以每小时每克土壤样品所得底物的摩尔数(nmol·g-1·h-1)表示土壤胞外酶活性的大小[11]。

表2 土壤胞外酶和对应的底物Tab.2 Soil extracellular enzymes andcorresponding substrates
土壤酶活性计算公式如下:

式中:Ab为每小时每克土壤样品的胞外酶活性(nmol·g-1·h-1);F为校正后的样品荧光值;V为土壤悬浊液的总体积;V1为微孔板每孔中加入的土壤悬浊液的体积;t为暗培养时间;m为干土样的质量;f为多功能酶标仪读取土壤样品微孔的荧光值;fb为空白微孔的荧光值;q为淬火系数;fs为阴性对照微孔的荧光值;e为荧光释放系数;fr为参考标准微孔的荧光值;Cs为参考标准微孔的浓度;V2为加入参考标准物的体积;fq为淬火标准微孔的荧光值。
1.4 数据处理
采用Microsoft Excel 2010来整理和计算试验数据,土壤化学计量和土壤酶化学计量采用质量比的方式分层次计算。在分析土壤C、N、P 含量及其获取酶之间的线性关系之前对数据进行ln转化,使用SPSS 25.0进行统计分析,通过Origin 2018和R 3.5.1进行作图。对土壤C、N、P 含量及其化学计量和土壤胞外酶活性及其化学计量采用单因素方差分析(One-way ANOVA)进行显著性检验(α=0.05),通过一般线性模型(GLM)研究生物土壤结皮形成、土层深度及其交互作用的影响。利用R 3.5.1 软件分析土壤C、N、P 含量及其化学计量和土壤胞外酶活性及其化学计量之间的关系,并实现土壤C、N、P含量及其化学计量和土壤胞外酶活性对土壤酶化学计量的冗余(RDA)分析。利用SMATR 2.0软件中的标准化主轴(SMA)估计,探明了参与C、N、P循环的胞外酶活性之间的比例关系变化。C-获取酶、N-获取酶、P-获取酶活性三者之间的化学计量关系采用对数-对数尺度进行分析,模型为logy=a+b(logx)。其中x和y为参与C、N、P 循环的胞外酶活性,b为斜率,a为截距。当该模型的斜率(b)与1无显著差异时(P<0.01),将其关系描述为等容关系[22]。
2 结果与分析
2.1 不同发育阶段土壤C、N、P含量变化特征
在BSCs 的不同发育阶段中,土壤有机碳(SOC)、全氮(TN)、全磷(TP)的含量均随着土层的加深而逐渐递减(表3,P<0.05)。不同发育阶段之间的SOC、TN、TP含量存在差异(P<0.05),SOC含量依次为:藓-藻混生结皮(MA)>全藓结皮(M)>藻-藓混生结皮(AM)>全藻结皮(A)。A、AM、MA、M 这4个发育序列中0~20 cm 土层的SOC、TN、TP 含量均与裸沙地之间差异显著(P<0.05)。

表3 不同发育阶段土壤C、N、P含量变化特征(平均值±标准偏差)Tab.3 Variation characteristics of C,N and P contents at different formation stages(mean±SD)
2.2 不同发育阶段土壤胞外酶活性变化特征及其与土壤C、N、P之间的关系
A、AM、MA、M这4个发育阶段的β-1,4-葡萄糖苷酶(BG)、β-1,4-N-乙酰基氨基葡萄糖苷酶(NAG)、亮氨酸氨基多肽酶(LAP)和碱性磷酸酶(AP)活性均在生物土壤结皮层表现为最高(表4,P<0.05)。生物土壤结皮层的BG、NAG和AP活性在不同发育阶段之间存在显著差异(P<0.05),NAG 活性依次为:MA >M >AM >A。A、AM、MA、M这4个发育阶段的LAP 活性对比CK 均显著增加(P<0.05),AP活性在藓-藻混生结皮阶段和全藓结皮阶段与裸沙地有显著差异(P<0.05),在藻-藓混生结皮阶段和全藻结皮阶段差异不显著,BG 和NAG 活性在2~20 cm土层随着BSCs发育变化不显著。

表4 不同发育阶段土壤胞外酶活性变化特征(平均值±标准偏差)Tab.4 Variation characteristics of soil extracellular enzyme activities at different formation stages(mean±SD)
线性回归分析表明,参与碳、氮、磷循环相关胞外酶活性分别与土壤C、N、P 含量呈极显著的正相关关系(P<0.001)(图2)。土壤胞外酶活性与土壤C、N、P 含量的标准化主轴分析结果表明,在藻-藓混生结皮阶段AP与(NAG+LAP)活性之间的斜率大于1,且呈现显著水平(P<0.001),在其他生物土壤结皮发育阶段的斜率均与1 无显著差异,具有良好的约束关系(表5)。同时,土壤有机碳、全磷含量与BG、AP活性之间的斜率均显著大于1(P<0.001)。
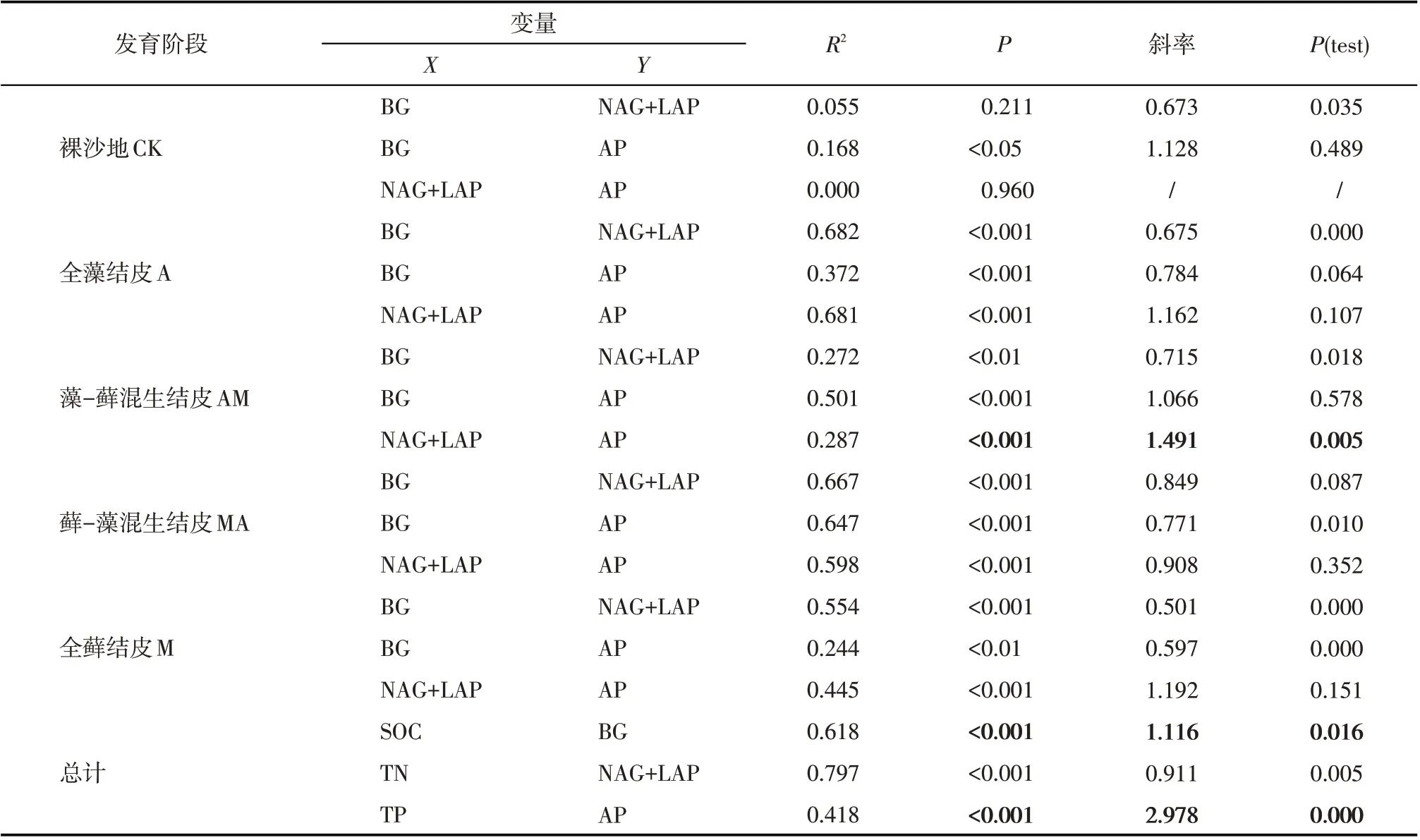
表5 土壤胞外酶活性与土壤C、N、P含量的标准化主轴分析Tab.5 Standardized major axis analysis between extracellular enzyme activities of soils involved in the C,N,and P cycles and soil C,N,and P contents

图2 土壤C、N、P含量与参与C、N、P循环相关胞外酶活性的线性回归分析Fig.2 Linear regression analysis between C,N and P contents and C-,N-and P-acquisition enzyme activities
2.3 不同发育阶段土壤化学计量与酶化学计量变化特征
生物土壤结皮层C:P、N:P 随发育序列变化逐渐增加,均表现为:A<AM<MA<M(图3)。4 个不同发育序列之间土壤C:N 变化不显著,与CK 均具有显著差异(P<0.05)。相较裸沙地0~2 cm土层,生物土壤结皮各发育阶段0~2 cm土壤C:N显著降低,分别降低了37.9%、43.5%、48.0%和44.3%。

图3 土壤化学计量与酶化学计量在不同发育阶段的变化特征(平均值±标准偏差)Fig.3 Variation characteristics of soil stoichiometry and enzyme stoichiometry at different formation stages(mean±SD)
4个不同发育序列的土壤酶C:N相比裸沙地均具有显著差异(P<0.05)(表6),其中在0~2 cm土层,分别降低了55.2%、56.7%、67.9%和76.9%。土壤酶C:P和酶N:P在全藻结皮阶段出现最大值,在藓-藻混生结皮阶段出现最小值。
2.4 土壤C、N、P 含量及其化学计量和土壤胞外酶活性及其化学计量之间的关系
土壤C、N、P 含量及其化学计量比和土壤胞外酶活性及其化学计量比的相关性分析表明,土壤C、N、P 之间均表现出极显著的正相关(P<0.01,表7)。土壤C、N、P 含量与土壤C:P、N:P 及各胞外酶活性之间也存在着极显著的正相关关系(P<0.01),且C、N、P 含量与土壤C:N 之间的相关系数分别为0.074、-0.053、-0.167(P<0.05)。土壤BG:(NAG+LAP)与土壤C:N 呈极显著正相关(P<0.01),土壤BG:AP与BG呈现出显著正相关,但与AP表现为极显著负相关(P<0.01)。

表7 土壤C、N、P及其化学计量和土壤胞外酶活性及其化学计量之间的相关性Tab.7 Correlation between C,N,P and their stoichiometry and soil extracellular enzyme activity and their stoichiometry
以土壤酶化学计量为响应变量,以土壤C、N、P含量及其化学计量和土壤胞外酶活性为解释变量作冗余(RDA)分析,通过RDA 进一步说明BSCs 的发育和土层深度对土壤酶化学计量的影响(图4)。在生物土壤结皮层,RDA结果显示土壤BG:AP与土壤C、N、P、BG 和NAG 有很显著的正相关性(P<0.01),第一轴和第二轴的特征值分别为88.17%和11.17%。BG:(NAG+LAP)与(NAG+LAP)和LAP 呈显著负相关,这与相关性分析结果一致。

图4 土壤酶化学计量与土壤C、N、P和土壤胞外酶活性的关系Fig.4 Relationship between soil enzyme stoichiometry and soil C,N,P and soil extracellular enzyme activities
3 讨论
3.1 生物土壤结皮形成对土壤C、N、P 含量以及胞外酶活性的影响
生物土壤结皮层的形成过程反映了干旱半干旱生态系统土壤性质的转变和区域生态环境的健康状况。在干旱和半干旱地区,BSCs覆盖在沙地表面,促进了细颗粒的积累,对沙地土壤养分的改良起着至关重要的作用[23]。本研究结果表明,BSCs的形成对土壤C、N、P 含量均具有极显著影响(表6),这与李云飞等[24]研究结果相似。这可能和不同发育阶段BSCs的类型不同有关,随着BSCs的发育,藓结皮逐渐占据优势地位(表1)。藓结皮的表面孔隙较为粗糙,这种结构特性可以更好地捕获有机质,使得结皮层下的养分不断聚集,藓结皮的生物量、微生物组成和固碳能力显著高于藻结皮[25]。曾全超等[26]研究得出在黄土高原延河流域不同植被带的C、N、P含量均为表层高于下层,并且随土层加深而降低,这与本研究结果趋势一致。本研究发现,4个发育序列BSCs的生物土壤结皮层SOC、TN、TP含量均显著高于下层土壤,且不同发育序列间差异显著(表3),其中SOC 与TN 的变化具有一致性,均随着土层的加深而减小,且在结皮层下各土层中分布较为均匀。原因可能是:(1)BSCs 对下层土壤的影响在土层深度上有局限性;(2)研究区内降水量较少对淋溶作用有影响;(3)矿质风化速率降低,土壤存储能力较弱[27]。TP 含量随土层加深而减小的趋势较缓,可能主要与土壤母质有关,土壤母质相对稳定,土壤全磷含量对土层深度变化的响应较弱[25]。
土壤胞外酶是微生物释放出降解复杂大分子的蛋白质,在生态系统中参与养分循环并具有重要作用,作为沙区土壤恢复的重要生物指标,其活性强弱可以指征土壤中养分转化能力的大小[13]。Zhao等[28]研究表明,不同的结皮形成阶段会影响固氮酶的活性,这与本研究生物土壤结皮的发育对土壤胞外酶活性具有极显著影响相似(表6),随着生物土壤结皮的发育,土壤胞外酶的活性显著增加。主要是由于生物土壤结皮层相对丰富的养分含量为酶促反应提供较多的底物,从而提高了酶活性,发育等级越高的生物土壤结皮,其结皮层的酶活性越高。有研究表明,在生态系统中由酶催化的土壤有机质转化和降解过程更多的可能性是由微生物功能基因的丰度驱动的[29]。Miralles 等[30]得出生物结皮土壤胞外酶的活性要高于没有结皮发育的裸露土壤,这可能是由于生物土壤结皮层通过利用其深色色素吸收太阳辐射来缓和土壤气候的波动,从而提高了土壤酶的活性[31]。发育后期藓结皮的土壤胞外酶活性高于发育前期的藻结皮,这表明随着结皮形成的进行,土壤结皮层下的微生物活性不断累积。与藻结皮相比,藓结皮可能更具有提高C和N循环的能力,可以更好地改善碳和氮的输入和交换[32]。本研究得出土壤胞外酶活性随土层加深而降低(表4),这和Maxwell等[33]参与P循环相关酶活性随深度的增加而降低的规律一致。生物土壤结皮层的土壤胞外酶活性最高,在结皮下层土壤中,不同发育序列的4种胞外酶活性均大于裸沙地。这主要缘于生物土壤结皮产生的分泌物和残体等被微生物不断分解形成腐殖质,促进了养分在结皮层的积累,从而使结皮层养分含量显著高于下层土壤。相应地,其为土壤微生物提供底物,使微生物适宜生境的能力增强,这会促进结皮层酶活性的提高[19]。

表6 阶段、土层及其交互作用对土壤生态化学计量和土壤胞外酶及其化学计量特征的影响Tab.6 Effects of stage,soil layer and their interaction on soil ecological stoichiometry and soil extracellular enzymes and their stoichiometric characteristics
3.2 生物土壤结皮形成对土壤化学计量和土壤胞外酶化学计量的影响
土壤生态化学计量能够有效地说明养分限制类型和土壤质量状况,是反映C、N、P循环以及土壤养分平衡的重要参数[27]。本研究结果表明生物土壤结皮的发育对土壤生态化学计量有极显著影响(表6),这与Liu等[34]化学计量比随植被演替阶段变化的研究结果类似。在生物土壤结皮的发育过程中,植被对土壤养分的归还处于动态变化,且土壤理化性质和微生物活性均会在发育过程中发生显著改变。土壤C:N 是体现土壤有机质分解速率的指标,比值越高表明土壤有机质的分解矿化速率越慢。在本研究中,4 个发育序列生物土壤结皮层的C:N 平均值分别为14.0、16.3、14.5、15.2(图3a),均明显高于全国平均值(11.9),表明研究区土壤相对于全国土壤平均水平土壤碳源、有机质分解和矿化速率均较低。随着生物土壤结皮的发育,土壤有机质的分解速率逐步减弱,增加了土壤有机质的积累[35]。除结皮层外,0~2 cm、2~10 cm 和10~20 cm 土层的C:N 无显著差异,这说明土壤中C 和N 的含量在外部环境的影响下趋于一致,在养分积累和消耗的过程中C 和N 作为主要成分,其比值相对稳定[36]。土壤N:P一般可用于预测养分限制的类型,本研究生物土壤结皮层N:P明显高于结皮下层,这说明研究区结皮下层土壤氮元素供应相对较弱,并有可能成为植被生长的限制元素[11]。土壤C:P可以用于表征土壤P的有效性,通常C:P越低,越利于微生物对有机质的分解,进而提高土壤P的含量,反映土壤P的有效性[37]。本研究区结皮层的土壤C:P高于结皮下层土壤,这说明结皮层土壤中有机质的分解速率弱于下层土壤。
土壤酶化学计量作为表征土壤中养分供应状况和土壤微生物活动的重要指标,揭示了土壤中微生物营养需求与环境养分有效性之间的平衡关系[38]。当C、N 或P 中某一元素在土壤中变得有限时,微生物可能就会释放该元素的获取酶,以应对土壤基质和养分供应的变化[39]。本研究中,BG:(NAG+LAP)和BG:AP 随着生物土壤结皮的发育下降,这与Wang 等[40]的研究中酶C:N 和C:P 在前22 a 植被演替中下降有相似的规律,这表明研究区微生物对N和P 相对于C 的需求更大,藻结皮阶段土壤微生物N、P 功能的发挥相对较差。除生物土壤结皮层外,BG:(NAG+LAP)和BG:AP 的降低与土层深度的增加有关,这说明随着土层的加深,微生物对参与C、N、P循环相关胞外酶的释放减少,且减少释放C-获取酶的幅度最大[39]。尽管土壤胞外酶化学计量比受到生物结皮形成的显著影响,但微生物调控释放参与C、N循环相关胞外酶等比例增加(即两者表现为等容关系),呈稳态模式(表5)。在生物土壤结皮形成过程中,微生物内稳性在调控养分资源的获取中扮演重要作用,在环境相对受限的区域,酶化学计量比在外界的条件变化下保持稳态,可以更好地应对养分缺乏,保持土壤养分动态平衡[41]。本研究得出在全藻结皮、藻-藓混生结皮以及全藓结皮阶段土壤P-获取酶与N-获取酶之间的斜率均大于1,且在藻-藓混生结皮阶段呈显著水平,说明微生物对P-获取酶的释放速率相对N-获取酶较快。同时,土壤有机碳、全磷含量与参与C、P循环的胞外酶活性之间的斜率均显著大于1,呈现非等容模型,反映了土壤胞外酶活性对土壤养分的依赖。
3.3 土壤C、N、P-胞外酶活性-酶化学计量特征的相关性分析
在植被与土壤协同进化过程中,调控C、N、P循环的土壤胞外酶活性会受到相应的土壤养分状况影响,由于不同发育阶段生物土壤结皮固定C、N的能力不同,对应胞外酶活性就不同,进而使化学计量学特征发生分异[42]。土壤养分含量通过微生物间接调控土壤胞外酶的分泌,使得土壤养分与酶活性之间具有一定的相关关系。本研究中,土壤C、N、P 含量与其获取酶化学计量的相关性分析显示,SOC、TN、TP 与C-、N-、P-获取酶[BG、(NAG+LAP)、AP]呈显著正相关,表明土壤微生物活动受到SOC、TN、TP 含量的调控,其含量越高,土壤C-、N-、P-获取酶活性越高,这反映了SOC、TN、TP 是土壤酶生产和分泌的能量来源。本研究发现土壤N:P、C:P分别与土壤(NAG+LAP):AP、BG:AP无显著相关关系,表明土壤胞外酶活性对生物土壤结皮发育过程中土壤养分变化的响应机理不同[43]。综上所述,面对土壤C:N:P生态化学计量的分异,土壤胞外酶会调整自身C:N:P 生态化学计量进行适应。本研究表明生物土壤结皮和土层深度均与土壤胞外酶活性及其化学计量显著相关(表6),生物土壤结皮的发育和土层深度对土壤胞外酶活性的影响呈交互作用。说明胞外酶活性及其化学计量是由养分有效性介导的,生物土壤结皮不同发育阶段的营养供给影响微生物的繁殖和生长,进而决定酶的分泌[44]。
4 结论
(1)随着生物土壤结皮的发育,参与C、N、P 循环的土壤胞外酶活性均有明显增强,全藓结皮阶段的土壤胞外酶活性显著高于全藻结皮。反映出生物土壤结皮的形成丰富了土壤微生物的种类和数量,从而提高了土壤胞外酶的活性。而在相同生物土壤结皮发育阶段,土壤胞外酶活性随土层加深而减弱。
(2)标准化主轴估计分析得出土壤有机碳、全磷含量与C-获取酶、P-获取酶活性之间的斜率均显著大于1,呈现非等容模型,表明土壤胞外酶及其化学计量对土壤养分的依赖,反映了土壤胞外酶及其化学计量与土壤养分循环的密切关系。
(3)各生物土壤结皮发育阶段土壤N-获取酶、P-获取酶相对于C-获取酶的斜率呈现等容关系,表明胞外酶化学计量比在外界的条件变化下保持稳态,微生物内稳性在调控养分资源的获取中扮演重要作用。

