不同培养基培养的人脐带间充质干细胞生物学特性对比
王 越
(沈阳工学院生命工程学院,辽宁抚顺 113112)
间充质干细胞是一种多潜能种子细胞[1]。相关研究显示,间充质干细胞具有较好的增殖能力,具有向神经元样细胞、星形胶质细胞等多种细胞分化的能力,因其在组织工程和细胞替代治疗的临床研究而备受关注。间充质干细胞类型较多,常见的间充质干细胞来源于骨髓[2],但骨髓细胞含量相对较低,分离、纯化、培养过程中均存在一定的困难,且随着人体年龄的增长,骨髓间充质干细胞含量和增殖能力会下降。新生儿出生后废弃的脐带组织中含有脐带间充质干细胞(Umbilical cord mesenchymal stem cells,UC-MSCs),具有强大的自我更新能力和向脂肪细胞、骨细胞、神经细胞、肝细胞及肌细胞分化的潜能。因其来源丰富,易于获取,且获取无创伤加之免疫原性低下,增殖能力强,无伦理性争议等优势,成为组织修复和器官重建理想的种子细胞来源,广泛应用于再生医学中[3]。
近年来分离、培养脐带间充质干细胞取得阶段性进展,且脐带间充质干细胞的研究相对较多[4],如何采取积极有效的措施获得快速、高效的脐带间充质干细胞具有重要的意义。目前,对于脐带干细胞培养方法主要有组织贴块法和胰酶消化法,体外培养脐带间充质干细胞时选择何种培养体系存在一定的争议。
本研究比较了不同品牌培养基对原代人脐带间充质干细胞培养结果的影响,以期优化人脐带间充质干细胞的体外培养体系。
1 材料与方法
1.1 材料
健康足月剖宫产新生儿脐带2 份,20~30 cm/份,由某三甲医院提供。
1.2 试剂
生理盐水,阿拉丁试剂(上海)有限公司;无血清培养基1(Takara)、无血清培养基2(Lonza)、无血清培养基3(国产)、胰蛋白酶、台盼蓝、细胞冻存液(默塞尔生物医学科技发展有限公司)。
1.3 仪器
离心机、荧光倒置显微镜、细胞计数仪、生化培养箱、水浴锅等。
1.4 方法
1.4.1 脐带获取 选取足月妊娠剖宫产健康胎儿脐带2 根,由某三甲医院提供,将其放置在脐带保存液中,保存时间不超过8 h,冷链运输至实验室。
1.4.2 人脐带间充质干细胞的分离和培养 取足月剖宫产脐带20~30 cm,无菌条件下放入盛有生理盐水的广口瓶中,4 ℃冰箱保存。超净台紫外线照射30 min 后,取出脐带,使用75%乙醇浸泡,并用生理盐水反复冲洗后去除脐带外膜及脐动静脉,用眼科剪将脐带剪碎至约1 mm×1 mm×1 mm 的小块。随后剥取华通氏胶均匀接种至100 mm 培养皿中,加入6 mL 培养基,放入37 ℃、5% CO2培养箱培养。其中,Takara、Lonza、国产3 种培养基培养原代UCMSCs 的培养皿数量、组织接种数量、重量均一致。倒置显微镜下观察细胞形态,3 d 进行半量换液,5 d后进行全量换液,之后每隔3 d 进行全量换液。当观察到细胞融合生长80%以上,进行传代操作。
2 结果与分析
2.1 不同培养基对人脐带间充质干细胞形态的影响
脐带经组织切块处理后,用3 种不同品牌的完全培养基(Takara、Lonza、国产)进行培养。使用Ta⁃kara 和Lonza 完全培养基培养的1 号样本组织块在第8 天能观察到有细胞爬出,散落分布在组织块周围或形成小范围克隆,如图1T、图1L 所示。2 d 后70%~80%细胞融合,细胞呈平行或旋涡排列。

图1 1 号样本人脐带间充质干细胞形态学观察结果
使用国产完全培养基培养的1 号样本组织块在第10 天后观察到有极少量间充质干细胞爬出,排列不规则且伴有其他杂细胞,且在换液2 d 后细胞生长缓慢,显微镜下未观察到明显增长。
使用Takara 和Lonza 完全培养基培养的2 号样本组织块在第9 天能观察到有间充质干细胞爬出,形态与1 号样本中使用Takara、Lonza 完全培养基培养的间充质干细胞相似。使用国产完全培养基培养的2 号样本组织块在2 周内未观察到有间充质干细胞爬出,于第15 天弃掉(图2)。

图2 2 号样本人脐带间充质干细胞形态学观察结果
2.2 不同培养基对人脐带间充质干细胞数量、活率的影响
1 号样本在使用Takara 培养基第15 天后传至P2 代,细胞总数为5.8×107个,细胞活率为98%,在冻存21 d 后进行复苏,单支冻存管复苏后的细胞总数为6.57×106个,细胞活率为90%;在使用Lonza 培养基后第17 天后传至P2 代,细胞总数为4.5×107个,细胞活率为93%,在冻存21 d 后进行复苏,单支冻存管复苏后的细胞总数为6.27×106个,细胞活率为99%。
2 号样本在使用Takara 培养基后第13 天后传至P2 代,细胞总数为2.5×107个,细胞活率为98%,在冻存21 d 后进行复苏,单支冻存管复苏后的细胞总数为1.08×107个,细胞活率为89%;在使用Lonza 培养基第14 天后传至P2 代,细胞总数为2.0×107个,细胞活率为95%,在冻存21 d 后进行复苏,单支冻存管复苏后的细胞总数为6.36×106个,细胞活率为95%。结合2 个样本的细胞总数、复苏后的细胞得率进行分析,使用Takara 培养基培养的UC-MSCs 在细胞爬出时间以及细胞数的数据上优于使用Lonza 培养基培养的UC-MSCs(图3),使用Lonza 培养基,虽细胞爬出时间以及细胞数不及Takara,但冻存复苏后的细胞活率高于Takara(图4)。
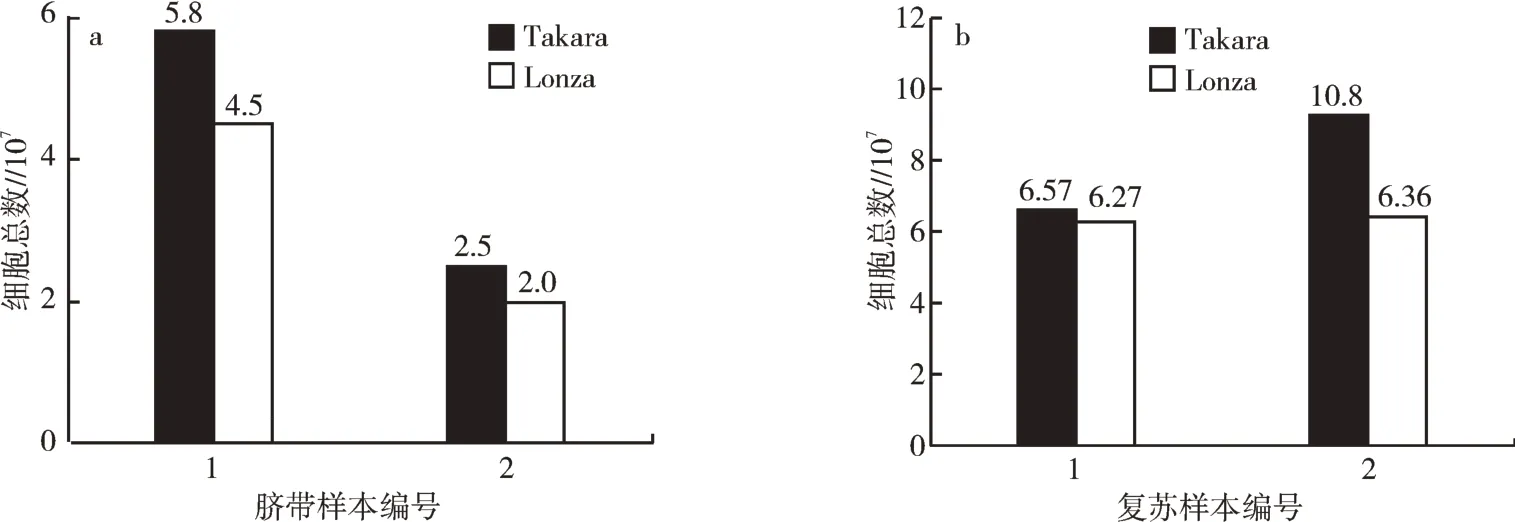
图3 不同培养基培养至P2 代的UC-MSCs 细胞总数(a)及复苏冻存的P2 代的UC-MSCs 细胞总数(b)

图4 不同培养基培养至P2 代的UC-MSCs 细胞活率(a)及样本复苏冻存的P2 代的UC-MSCs 细胞冻存复苏后细胞活率(b)
3 讨论
脐带间充质干细胞在不同的增殖分化阶段,对营养液的需求有所差异,培养基中营养物质的种类和浓度的差异均会对脐带间充质干细胞的生长、形态产生一定的影响[5-7]。因此选择合适的培养基是获得较为优质的脐带间充质干细胞的前提条件。本研究在处理样本的过程中使用不同品牌的培养基对脐带间充质干细胞进行原代培养,对比UC-MSCs 细胞的形态学、细胞总数、复苏后的细胞数、细胞活率等指标,使用Takara 培养基培养的UC-MSCs,在细胞爬出时间及细胞数上优于Lonza 培养基,使用Lonza 培养基培养的UC-MSCs,在冻存复苏的细胞活率上优于Takara 培养基。使用某国产培养基培养UC-MSCs,增殖停止。

