比较金属活动性强弱的新方法
李德前 郭 焘
江苏省徐州市西苑中学(221002) 江苏省徐州市撷秀初级中学(221006)
在中学化学教学中,对金属活动性强弱的判断依据存在一定误区。我们借助常规实验用品设计出比较金属活动性强弱的科学方法,取得了显著的实验教学成效。
1 问题的提出
中学化学教学界有学者认为:金属单质与酸溶液发生反应的剧烈程度可以说明金属的活动性强弱[1],即反应速率越快则金属的活动性就越强,反应速率越慢则金属的活动性就越弱。不仅如此,上述观点还反映在一些中考试题中,如:
中考题1(2020·四川乐山):同学们参加实验基本操作考查,在验证镁、锌、铜3种金属的活动性顺序时设计了以下4种方案,其中能达到实验目的的是( )
A.将镁片、锌片分别放入硝酸铜溶液中
B.将锌片、铜片分别放入硝酸镁溶液中
C.将镁片分别放入硝酸锌溶液、硝酸铜溶液中
D.将镁片、锌片、铜片分别放入稀盐酸中
参考答案:D。
中考题2(2020·山东青岛):化学兴趣小组为验证镁、铁、铜、银4种金属的活动性顺序,他们设计了图1所示的4个实验(几种金属片均已打磨,其形状大小相同,且实验①②③所用盐酸的浓度和体积均相同)。
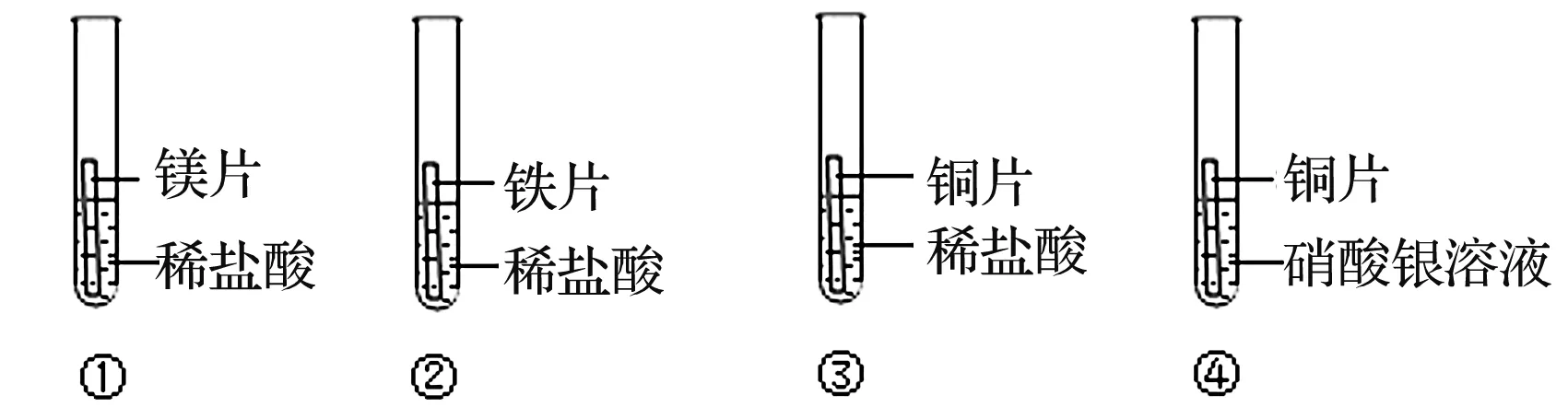
图1 中考题中验证镁、铁、铜、银金属活动性顺序的实验装置
下列分析错误的是( )
A.对比实验①②中反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析4个实验现象,能判断出镁、铁、铜、银的金属活动性顺序
参考答案:B。
其实,金属单质与酸溶液(盐酸、稀硫酸)发生置换反应(生成氢气)的速率,与金属的活动性不存在必然联系。因为金属活动性强弱是根据金属在水溶液中形成水合阳离子的标准电极电势大小来定量衡量的[2],它仅仅从热力学角度指出了金属在水溶液里失去电子的难易,而反应速率是从动力学角度表明反应的快慢。
2 实验的设计
在初中化学教学中,如何简便而直观地比较不同金属的活动性强弱呢?查阅文献发现,根据“金属与酸溶液反应前后溶液温度的变化”作为金属活动性强弱的判断依据是可取的[3-4],苏州的徐敏、郑丽娟老师就此设计出图2所示的装置探究几种金属的活动性顺序[5],两位老师的实验方案表现出很好的创造性。但是,由于涉及的反应体系是完全封闭的玻璃容器,且没有压强缓冲设置,这样实验过程中极可能发生冲塞事故;另外,不少学校也没有配备温度传感器。
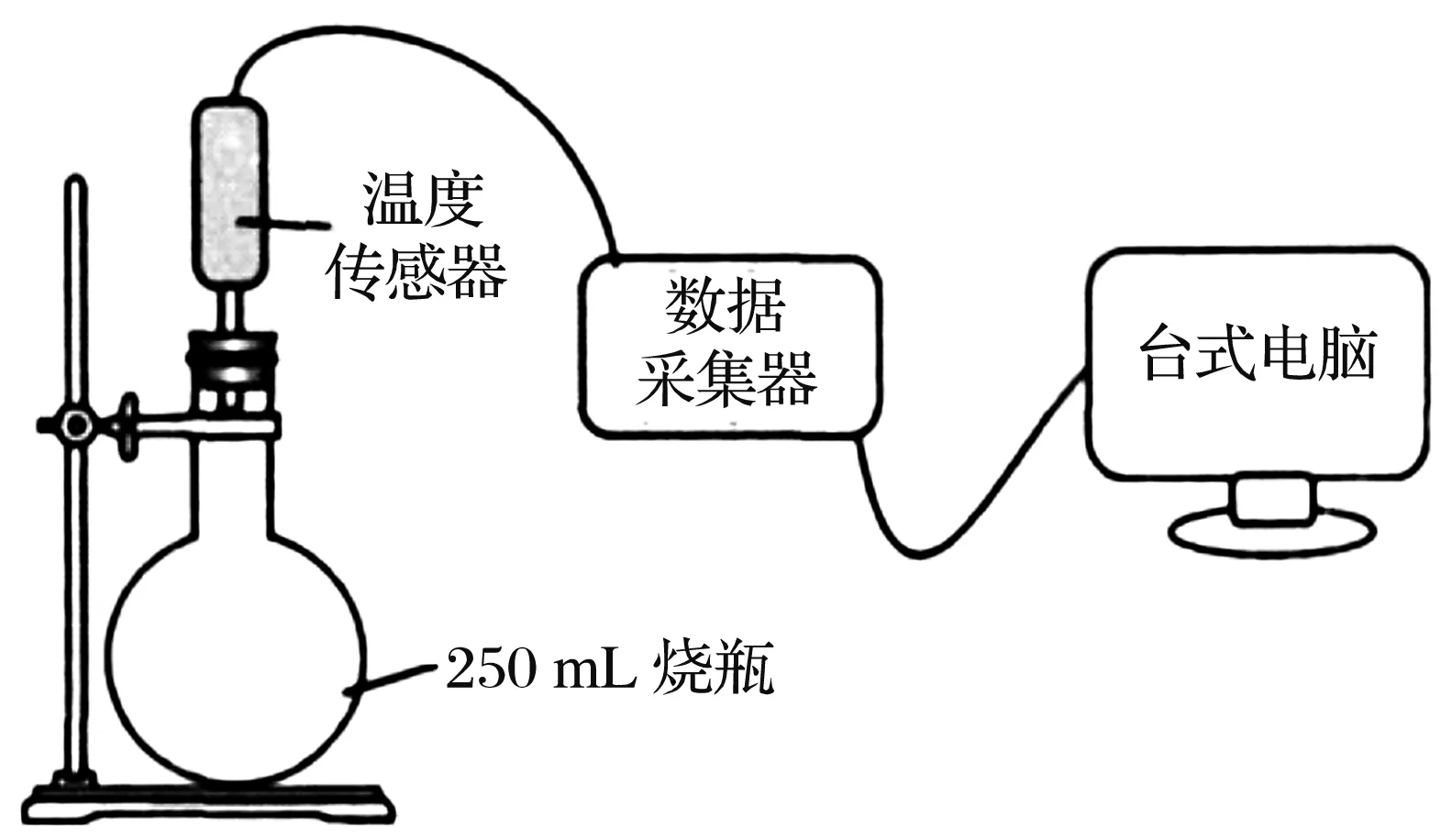
图2 文献中探究镁、铝、锌、铁、铜5种金属活动性强弱的实验装置
鉴于此,我们利用实验创新的“替换思维”对实验装置进一步优化,采用常规的实验用品设计并进行实验。
2.1 实验用品
15 mm×150 mm有孔试管(含配套的单孔橡皮塞),150 mL广口瓶(含配套的双孔橡皮塞),煤油温度计,长颈漏斗,镊子,砂纸等;镁、铝、锌、铁4种金属片(长度均为10 cm、宽度均为4 mm,均除去了氧化膜),2 mol/L 稀盐酸,自来水等。
2.2 实验装置
新设计的实验装置如图3所示。
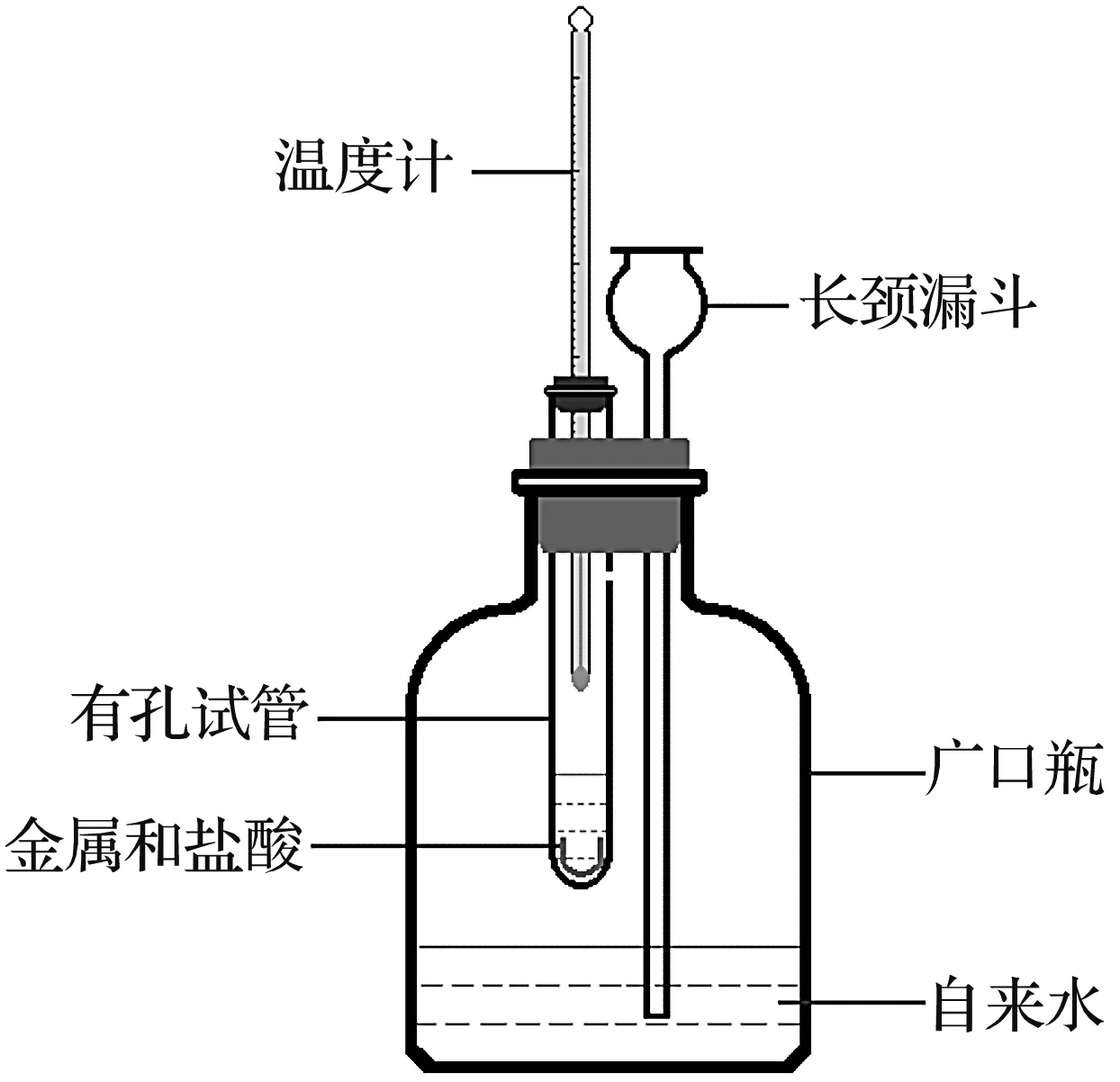
图3 新设计的探究镁、铝、锌、铁4种金属活动性顺序的实验装置
2.3 实验过程
(1)准备1支15 mm×150 mm的有孔试管,取1个与之配套的单孔橡皮塞(孔径要与温度计的外径相匹配);准备1个150 mL的广口瓶,取1个与之配套的双孔橡皮塞(两个孔的孔径要分别与小试管的直径、长颈漏斗的管径相匹配)。
(2)按图3所示,连好整个实验装置;然后向长颈漏斗里注入适量的自来水,如果长颈漏斗中的水很难流下去(或水面不下降),就说明装置不漏气。
(3)拔掉试管口上的单孔橡皮塞,先向试管中注入10 mL 2 mol/L的稀盐酸,再将长约10 cm、宽约4 mm的镁片(约0.27 g)弯曲成U型投入稀盐酸中,立即塞紧橡皮塞,注意读取反应前的起始温度和反应后的最高温度。反应过程中,可以观察到溶液中剧烈冒气泡,最终金属镁有剩余。
(4)再将外形相同、大小相同的铝片(约0.61 g)、锌片(约1.01 g)、铁片(约1.85 g)弯曲成U型,分别投入10 mL 2 mol/L的稀盐酸中,注意读取反应前的起始温度及反应后的最高温度(即重复前述操作)。反应过程中容易观察到,金属铝表面快速冒气泡、金属锌表面较快冒气泡、金属铁表面缓慢冒气泡,最终金属铝、锌、铁均有剩余。
(5)上述实验所得数据见表1。
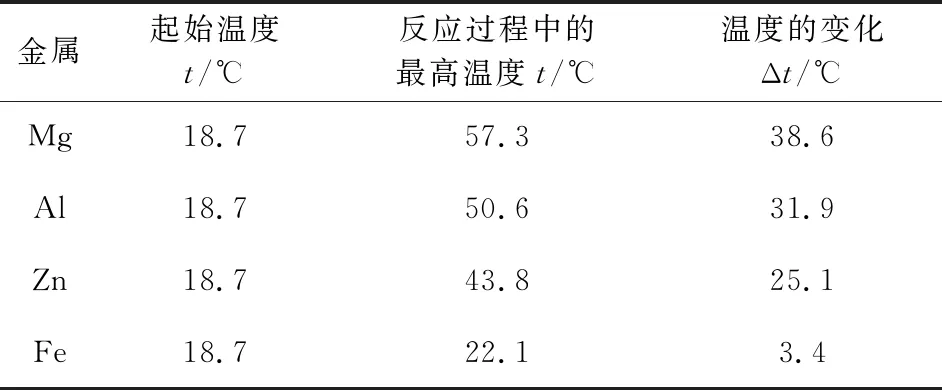
表1 镁片、铝片、锌片、铁片分别与稀盐酸反应的温度变化情况
分析表1中的实验数据可知,等质量且均过量的不同金属分别与等体积等浓度的稀盐酸反应时,金属镁与稀盐酸反应的温度变化最大,金属铁与稀盐酸反应的温度变化最小,金属锌与稀盐酸反应的温度变化大于铁、小于铝,所以镁、铝、锌、铁4种金属与盐酸反应放出的热量逐次减少。据此,可以确定这4种金属的活动性由强到弱的顺序是镁、铝、锌、铁。
2.4 实验优点
(1)实验设计科学简约、通俗易懂,有助于学生明晰金属活动性顺序的内涵。
(2)把小试管作为反应室,反应产生的热量集中,测出的温度数值接近真实值,因而实验的误差小。
(3)广口瓶、长颈漏斗和水组成了实验体系内的压强缓冲装置,即便是金属镁、铝与盐酸剧烈反应也不会发生冲塞现象,确保了实验安全和装置稳定。
(4)实验现象比较直观,而且融入定量思维,有利于培养学生分析数据、处理数据的能力,发展学生的理性思维和证据推理意识。
(5)使用常规仪器,实验的成本低,但实验效果明显,因此该实验创新方案具有一定的推广价值,尤其是对办学条件相对薄弱的学校而言,不失为优秀的实验教学资源。
3 结语
利用上述实验装置探究常见金属的活动性顺序,学生可以非常直观地感知实验现象并得出正确的实验结论,从而使复杂的问题简单化、抽象的问题形象化、模糊的问题明确化,有利于培养学生的科学态度,发展教师的专业素养,提升实验教学的有效性。

