铜藻在紫外胁迫下的抗氧化应激响应
李凌雪, 严 芳, 2, 吴红艳, 2, 臧纱纱, 2, 姜晓彤, 李宝齐, 吕峥峥, 徐智广, 2
铜藻在紫外胁迫下的抗氧化应激响应
李凌雪1, 严 芳1, 2, 吴红艳1, 2, 臧纱纱1, 2, 姜晓彤1, 李宝齐1, 吕峥峥1, 徐智广1, 2
(1.鲁东大学 生命科学学院, 山东 烟台 264025; 2.鲁东大学 山东省高等学校海洋生物技术重点实验室, 山东 烟台 264025)
紫外辐射增强常导致藻类体内活性氧成分的产生, 从而损伤藻类光合器官, 引起藻类光抑制。马尾藻()金潮近些年在世界多地频繁暴发, 金潮暴发时, 漂浮于海面的藻体接受更多的紫外辐射, 但金潮藻应对这种紫外胁迫的生理学机制尚不明确。本研究以中国金潮种——铜藻()为研究对象, 在实验室条件下, 以太阳模拟器提供光源, 设置P(光合有效辐射, Photosynthetically active radiation, PAR, 400~700 nm, 200 W/m2)、PA (PAR+UVA (紫外线A, Ultraviolet A), 320~700 nm)和PAB (PAR+UVA+UVB (紫外线B, Ultraviolet B), 280~700 nm), 探讨了紫外辐射下铜藻的光合活性变化和抗氧化应激响应。结果显示, 3种光辐射处理下, 藻体光合活性均受到抑制, 最大光化学量子产量(Fv/Fm)都随辐射时间延长而逐渐降低, 降低幅度为PAB>PA>P。后继的240 min低光P(PAR, 2.0 W/m2)恢复过程中, 藻体Fv/Fm均逐渐恢复。相应地, 光辐射处理后, 藻体内的活性氧成分O2–和H2O2及膜脂过氧化产物MDA含量均显著升高, 且O2–和MDA在PAB处理中升高幅度更大。同时, 这种高水平的O2–、H2O2和MDA含量一直延续至低光恢复过程。光辐射处理后, 抗氧化酶超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)、过氧化物酶(Peroxidase, POD)的活性和抗氧化物抗坏血酸(Ascorbic acid, AsA)的含量均显著增加, 低光恢复后, 抗氧化酶CAT和POD活性降低, 而SOD和抗氧化物AsA始终保持较高水平, 最终使得总抗氧化能力(Ttotal antioxidant capacity, T-AOC)在辐射处理和低光恢复阶段一直保持较高水平。在光辐射处理和低光恢复整个过程中, 紫外辐射(UVA和UVB)的存在, 显著提高了铜藻的抗氧化酶、抗氧化剂含量及总抗氧化能力, 且PAB处理中具有更高的值。本研究首次对金潮藻在紫外胁迫下的抗氧化应激响应做了较系统全面的探究, 为铜藻适应漂浮生活生理机制的揭示提供了重要的数据支持。
铜藻(); 紫外辐射; 光合活性; 氧化应激响应
铜藻隶属于褐藻门(Phaeophyta)、圆子纲(Cyclospreae)、墨角藻目(Fucales)、马尾藻科(Sargassaceae)、马尾藻属(), 是近岸海藻场的重要组成部分。幼苗时期水深分布范围在1.3~5.5 m, 而成藻时期水深分布范围为1.3~4.6 m[1]。铜藻因生长快速, 能营造巨大海藻场为其他生物提供栖息、避敌和繁殖的场所[2]。此外, 铜藻在快速生长的同时能从周边海水中吸收大量N、P等营养盐, 这对于净化水质具有良好的作用[3]。另一方面, 因铜藻具有高适应性和生长快速的特点, 经常成为外来入侵种[4], 影响当地海区生态系统[5-6]。尤其是近些年以漂浮种群出现的铜藻金潮在北太平洋的多次暴发, 更引起国际社会各界的广泛关注和高度重视[7]。
金潮是由处于漂浮状态的马尾藻暴发性快速生长而出现的生物量大规模聚集于海水表面的海洋生态现象[8]。近些年世界多地相继暴发马尾藻金潮, 且发现频次和分布面积均呈大幅上升的态势, 在一定程度上破坏了周边地区的海产养殖业、旅游业和生态环境[9-11]。2016 年底在中国黄海暴发的铜藻()金潮, 面积达46 km2, 大量漂浮铜藻的堆积、缠绕导致江苏省南通和盐城海域的紫菜养殖筏架大面积垮塌, 造成5亿元人民币的直接经济损失[12]。北方春季海水表面日平均光强在400~800 μmol photons m–2·s–1范围内[13], 而2017年春季中国东海暴发金潮时, 海水表面光强较往年增加了10%左右[14]。金潮暴发时, 定生水下的马尾藻漂浮于海面, 由于缺少了海水水层对紫外辐射(Ultraviolet radiation, UVR)的消减作用, 其接受的紫外辐射将显著增强[15], 马尾藻如何应对这种紫外胁迫以保持自身的快速生长, 其生理机制尚不明确。
在长期进化过程中, 藻类具备了多种光保护途径来抵御光抑制对自身光系统的损伤[16], 降低UVR带来的负面效应, 如加速光吸收物质的合成、过剩光能的热消耗[17]、加速活性氧的清除[18]、光反应中心蛋白的加速合成[19]、基因的损伤修复[20]等。其中, 抗氧化系统在应对环境胁迫对海藻造成的损伤中发挥重要作用。当到达地面的紫外辐射逐渐增强时, 易引起藻类活性氧(reactive oxygen species, ROS)代谢失调, 超氧阴离子(O2–)和过氧化氢(H2O2)被认为是ROS中最为重要的组成部分[21], 能够致使膜脂发生过氧化作用, 最终引起膜结构损伤, 而膜脂过氧化产物丙二醛(malondialdehyde, MDA)常作为细胞膜过氧化损伤的标志物[22]。为适应环境的变化, 藻类经过长期进化, 在氧化应激响应中形成了抗氧化系统来清除过氧化作用产生的ROS, 保护机体免受损伤。ROS的清除主要通过抗氧化酶和抗氧化物实现。抗氧化酶主要包含: 超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)等; 抗氧化物主要有: 抗坏血酸(ascorbic acid, AsA)、还原型谷胱甘肽(glutathione, GSH)等。此外, 总抗氧化能力(ttotal antioxidant capacity, T-AOC)可以直观地反映出植物体对环境的抗逆性, 因此用来表示整个抗氧化系统的抗氧化能力[23]。已有报道研究了不同环境因子对不同藻类抗氧化系统的影响, 如温度升高可引起海带()配子体MDA上升[24], 导致龙须菜()体内AsA等抗氧化物含量升高, 同时引起多种抗氧化酶性的改变[25]。金属锌离子浓度升高可使条斑紫菜(Ueda)MDA含量升高, 而海洋酸化条件下MDA含量降低[15]。光照强度、温度升高导致肠浒苔()的SOD活性和MDA含量上升, POD 活性无显著变化[26]。关于紫外辐射对大型海藻抗氧化系统影响的研究目前仍比较缺乏。
本研究选择铜藻为研究对象, 探讨了不同紫外辐射处理条件下铜藻的光合活性响应以及体内活性氧、抗氧化酶和抗氧化物的变化情况, 目的是揭示铜藻在紫外胁迫下的抗氧化应激响应, 为金潮种漂浮藻体适应光变化机制的进一步研究提供数据和理论参考。
1 材料和方法
1.1 实验材料
铜藻于2020年12月22日从山东省荣成市俚岛湾(37°15′ N, 122°35′ E)漂浮种群采集, 采集时海面表层水温为 5 ℃, 采集之后将其放于低温箱(5 ℃)于2 h内运回实验室。在实验室内用过滤、灭菌自然海水暂养24 h。由于此时漂浮铜藻生长及生理活动缓慢[27], 为了避免低温效应影响本研究氧化应激结果, 作者选择在其适宜温度18 ℃(北方春季海水表面温度范围)下开展本研究; 暂养光照强度设置为20 W/m2(光合有效辐射, Photosynthetically active radiation, PAR), 光周期为L∶D =12 h∶12 h, 不间断充气。
1.2 紫外辐射处理和低光恢复
选择健康并且个体大小一致的暂养铜藻用于实验, 称量总鲜质量(fresh weight, FW)为1.0 g的铜藻叶状体分枝, 培养在装有500 mL自然海水的石英管(能够透过UVR)中, 石英管置于水浴槽内控温, 通过低温恒温槽(YRDC-0506, 中国)将水浴温度控制在18℃。利用全波长太阳模拟器(Sol 1200, Hönle GmbH, 德国)提供培养光辐射, 参照铜藻金潮暴发时的海水表面光强, 设置PAR(photosynthesis active radiation, 400~700 nm)强度为200 W/m2。辐射强度采用辐射计(Solar Light, PMA2100, 美国)测定。在石英管上覆盖不同型号的滤光片获得不同的光辐射处理, 如下所述。
1.2.1 P处理
用ZJB-400滤光片覆盖石英管, ZJB-400滤光片只能透过波长400 nm以上的光, 使石英管内藻体只接受 PAR(400~700 nm)。
1.2.2 PA处理
用ZJB-320滤光片覆盖石英管, ZJB-320滤光片只能透过波长320 nm以上的光, 藻体接收PAR+UVA的光辐射(320~700 nm)。
1.2.3 PAB处理
用ZJB-280滤光片覆盖石英管, 藻体接受PAR+ UVA+UVB的光辐射(280~700 nm)。本研究所用滤光片均购自南通银兴光学有限公司。每个辐射处理下3个重复。不同光辐射处理120 min, 然后置于光强为2.0 W/m2(PAR)的恒温光照培养箱(GXZ-380D, 宁波江南仪器)内, 低光恢复240 min, 温度设置为18 ℃。需要说明的是, 由于到达地球表面的自然阳光中, UVR只占阳光总能量的5%以下, 其中UVA占UVR的99%、UVB占1%[28], 因而在探讨UVR对藻类生理影响的时候, UVR引起总光能的升高部分往往被研究者忽略不计, 而重点分析这种短波辐射的效应。本研究用太阳模拟器获得的UVR占总能量4%, 因而忽略了UVR能量增加引起的效应。
1.3 最大光化学量子产量(Fv/Fm)的测定
Fv/Fm使用双调制式叶绿素荧光仪(FL6000, 捷克)进行测定。不同光辐射处理时, 每隔30 min取活体测定。低光恢复阶段, 每隔60 min取活体测定。测定前将藻体黑暗适应5 min, 使所有反应中心在测量前开放。用低辐照度(<0.1 μmoL photons·m–2·s–1)的测量光照射, 获得最小荧光(Fo)。随后, 用饱和光(3500 μmol photons·m–2·s–1)照射, 获得暗适应状态下的最大荧光(Fm)。PSII最大光化学量子产量为最大可变荧光(Fv)与暗适应下的最大荧光之间的比值, 即Fv/Fm, 其中Fv= Fm–Fo。
1.4 氧化应激响应分析
分别于光辐射处理120 min和恢复240 min后取藻体0.2 g FW, 用液氮速冻后于–80 ℃保存。测定前按照质量(g)︰体积(mL)=1︰9的比例加入9倍体积的匀浆介质(生理盐水), 冰水浴(0 ℃)条件下研磨成10%的组织匀浆液, 3 500转/分离心10 min后, 取上清液, 利用紫外可见分光光度计(UH5300, 日本)测定特定波长的吸光值并计算以下指标含量或活力。
活性氧损伤指标: 超氧阴离子(O2–): 模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统, 产生超氧阴离子自由基, 加入电子传递物质及gress氏显色剂, 使反应体系呈现紫红色, 用分光光度计在550 nm处测定吸光值计算其含量; 过氧化氢(H2O2): 与钼酸作用生成一种络合物在405 nm处测定其生成量可计算出H2O2的量; 丙二醛(MDA): 过氧化脂质降解产物中的丙二醛(MDA)与硫代巴比妥酸(TBA)缩合形成红色产物, 在532 nm处有最大吸收峰。O2–、H2O2和MDA的含量通过如下公式计算:
O2–含量= (OD−OD)/(OD−OD)×A×1000/A,
H2O2含量= (OD−OD)/(OD−OD)×A/A,
MDA含量= (OD−OD)/(OD−OD)×A/A,
其中,OD为对照OD值;OD为空白OD值;OD为测定OD值;OD为标准OD值;A为待测样本蛋白浓度; As为标准品浓度。
总抗氧化能力(T-AOC): 机体中有许多抗氧化物质, 能使Fe3+还原成Fe2+, 后者可与菲啉类物质形成稳固的络合物, 通过测定520 nm处吸光值计算其抗氧化能力。总抗氧化能力计算公式如下:
总抗氧化能力= (OD−OD)/0.01/30×()/A
其中,OD为对照OD值;OD为测定OD值;为取样量;为反应液总体积;A为待测样本蛋白浓度。
抗氧化酶指标: 超氧化物歧化酶(SOD): 通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基, 后者氧化羟胺形成亚硝酸盐, 在显色剂的作用下呈现紫红色, 用可见光分光光度计测定550 nm处的吸光度计算其活力; 过氧化物酶(POD): 利用过氧化物酶催化过氧化氢反应的原理, 通过测定420 nm处吸光度的变化得出其酶活性; 过氧化氢酶(CAT): 过氧化氢酶分解H2O2的反应可通过加入钼酸铵而迅速中止, 剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物, 在405 mm处测定其变化量, 可计算出CAT的活力。SOD、POD、CAT的活力通过如下公式计算:
SOD活力= (OD−OD)/OD/50%×()×D/(F/V),
POD活力= (OD−OD)/12×()//(F/V)×1000,
CAT活力= (OD−OD)×271×(1/60×)/A.
其中,OD为对照OD值;OD为测定OD值;F为样本鲜质量;为反应时间;为反应液总体积;为取样量;V为匀浆介质总体积;A为待测样本蛋白浓度,D为样本处理前稀释倍数。
抗氧化物指标: 还原型谷胱甘肽(GSH): 二硫代二硝基苯甲酸与巯基化合物反应时能产生一种黄色化合物, 可在420 nm处测定吸光值计算其含量; 抗坏血酸(AsA): Fe3+与还原型抗坏血酸迅速作用生产Fe2+, 后者再与啡罗啉显色反应, 可在536 nm处测定吸光值计算其含量。GSH、AsA的含量通过如下公式计算:
GSH含量= (OD−OD)/(OD−OD)×A××D/A,
AsA含量= (OD−OD)/(OD−OD)×A×D/A,
其中,OD为空白OD值;OD为测定OD值;OD为标准OD值;为GSH分子量;A为待测样本蛋白浓度;A为标准品浓度;D为样本处理前稀释倍数。
以上实验所用植物组织试剂盒均购自南京建成生物工程研究所。
1.5 数据处理
采用Excel和SPSS 17.0进行数据整理和统计分析, 使用GraphPad Prism 7作图。数据表示为: 平均数±标准差(=3), 使用单因素方差分析(one-way ANOVA, Duncan)进行差异性分析, 差异显著性水平设置为<0.05。
2 结果
2.1 辐射处理和低光恢复下铜藻的最大光化学量子产量(Fv/Fm)
不同紫外辐射处理和低光恢复下铜藻的最大光化学量子产量(Fv/Fm)变化情况如图1所示。铜藻在P、PA、PAB 3种处理下的初始Fv/Fm分别为0.703± 0.023、0.693±0.012、0.73±0.017, 随着光辐射处理时间的增加, 铜藻的Fv/Fm逐渐降低, 在光辐射处理120 min后分别降至0.24±0.015、0.17±0.017、0.15±0.035, 在P、PA和PAB 3种辐射处理下分别降低了65.9%、75.5%和79.5%, 在低光恢复过程中, P、PA和PAB 3种辐射处理藻体的Fv/Fm均逐渐升高, 低光恢复240 min后, 分别恢复到初始状态的86.73%、87.02%、79.91%。
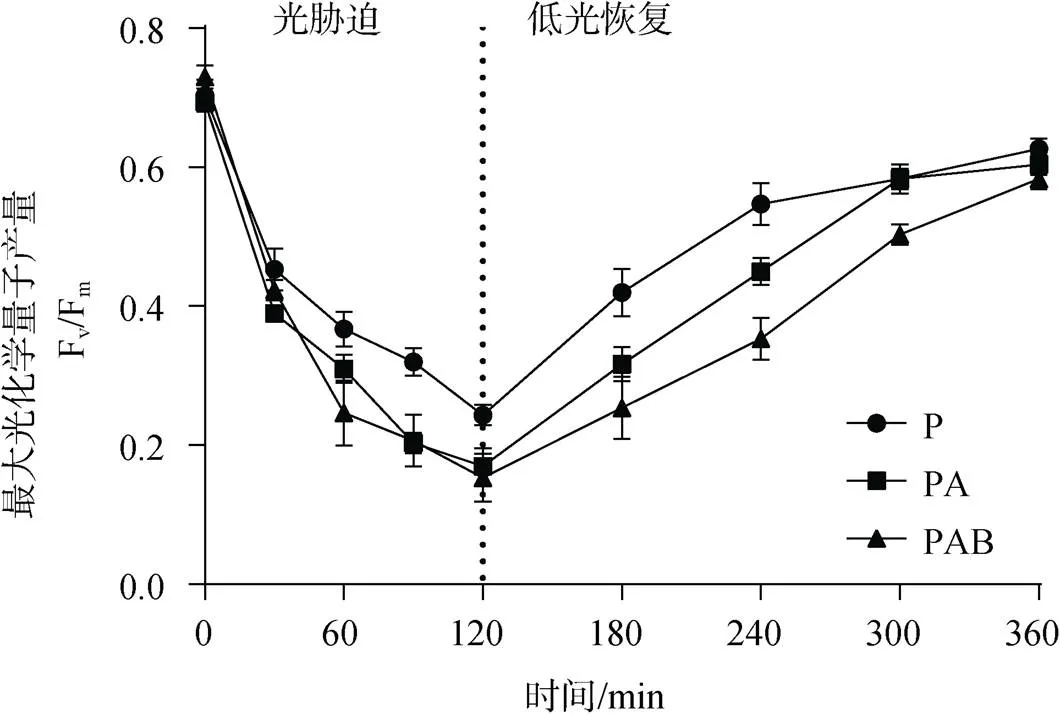
图1 光辐射处理和低光恢复下铜藻的最大光化学量子产量
2.2 辐射处理下铜藻的抗氧化应激响应
图2a表示不同光辐射处理下铜藻O2–含量随时间的变化。铜藻初始状态的O2–含量为11.436±1.086 U/g prot, 随着光辐射处理时间的增加, P处理下铜藻的O2–含量没有显著变化(>0.05)。PA和PAB处理组的O2–含量显著增加(<0.05), 分别增加至15.658±2.841和26.316±1.036 U/g prot, 且PAB处理组的O2–含量显著高于PA处理组(<0.05)。低光恢复240 min后, P和PA处理组的O2–含量较光辐射处理120 min后没有显著变化(>0.05), PAB处理组的O2–含量较光辐射处理后显著降低(<0.05), 降至22.141±0.792 U/g prot, 但仍高于初始状态。
不同光辐射处理下铜藻H2O2含量随时间的变化如图2b所示。初始状态时, H2O2含量为4.90± 0.095 mmol/g prot。光辐射处理120 min后, P处理下为5.46±0.669 mmol/g prot, 与初始状态差异不显著(>0.05); PA和PAB处理组的H2O2含量显著升高(< 0.05), 分别升高至7.224±0.245和8.389±0.705 mmol/gprot, 但PA和PAB处理组间没有显著性差异(> 0.05)。低光恢复240 min后, 各处理组的H2O2含量较光辐射处理120 min后没有显著变化(>0.05)。
图2c为不同光辐射处理下铜藻MDA含量随时间的变化。从图2c中可以看出, 铜藻初始状态的MDA含量为0.194±0.029 nmol/mg prot。随着光辐射处理时间的增加, 铜藻MDA的含量显著增加(< 005), 光辐射处理120 min后分别增加至0.286± 0.014、0.359±0.018、0.458±0.085 nmol/mg prot。PA和PAB处理组的MDA含量显著高于P处理组, 且PAB处理组的MDA含量最高。低光恢复240 min后, 各处理组的MDA含量较光辐射处理后均显著增加(<0.05), 分别增加至0.477±0.014、0.520±0.015、0.611 nmol/mg prot, 且P和PA处理组之间没有显著差异(>0.05)。PAB处理组的MDA含量最高, 显著高于P和PA处理组(<0.05)。
图3为不同光辐射处理下铜藻T-AOC随时间的变化。铜藻初始状态的T-AOC 1.68±0.171 U/mg prot。随着光辐射处理时间的增加, 3种处理组的T-AOC都显著增强(<0.05), 分别增强至2.966±0.535、3.671±0.448、4.847±0.426 U/mg prot。PA和PAB处理组的T-AOC显著高于P处理组(<0.05), 且PAB处理组的T-AOC最强。低光恢复240 min后, 3种处理组的T-AOC较光辐射处理后无显著差异(>0.05), 且均高于初始状态。
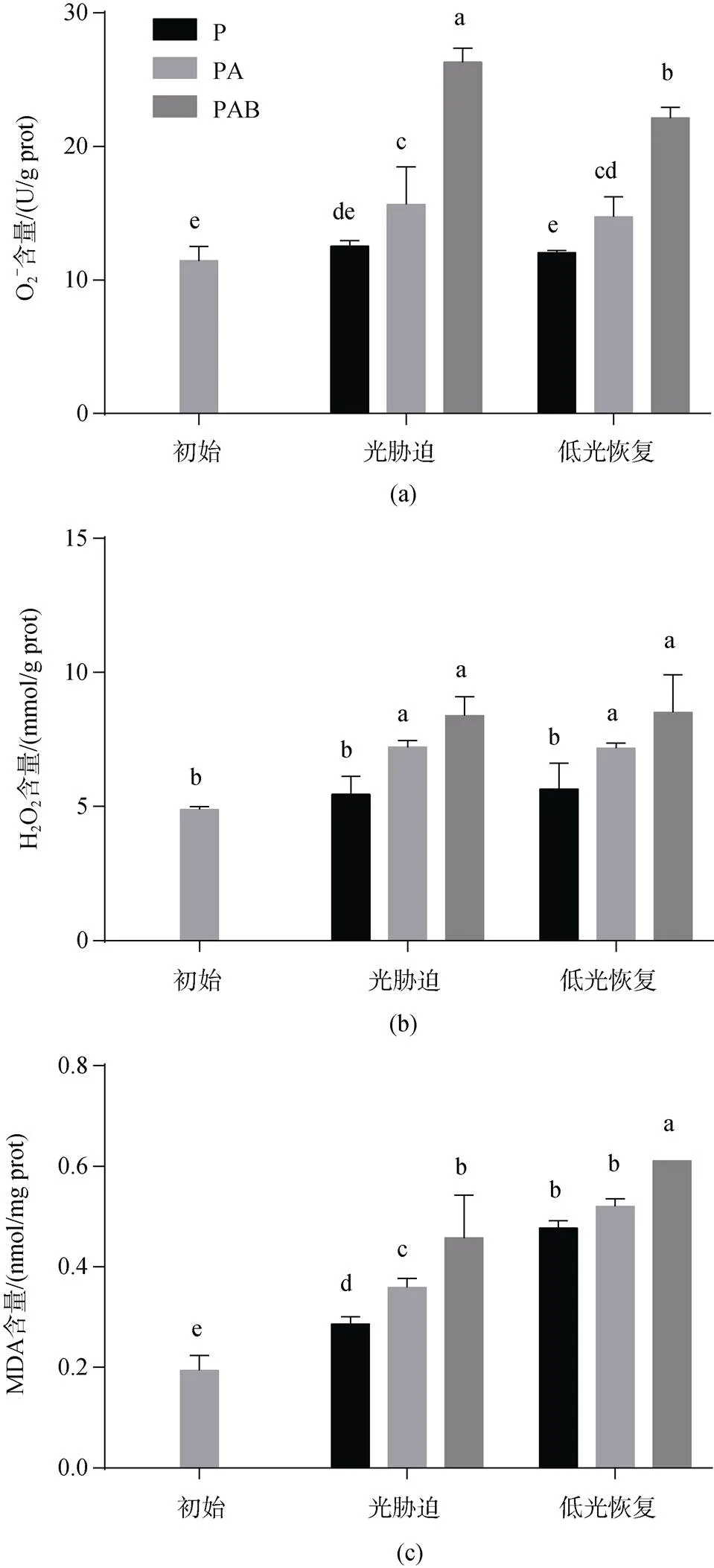
图2 铜藻活性氧成分和MDA含量变化
不同小写字母表示数值之间存在显著差异(<0.05), 图3~图5同
Different lowercase letters indicate significant difference (<0.05), Fig.3~Fig.5 are the same
不同光辐射处理下铜藻SOD活力随时间的变化如图4a所示。初始状态时, 铜藻的SOD活力为291.897±31.465 U/g FW。随着光辐射处理时间的增加, 3种处理组的SOD活力均显著增强(<0.05), 分别增至初始状态的2.47倍、2.52倍和2.66倍, 但P和PA处理之间没有显著差异(>0.05), PA和PAB处理之间没有显著差异(>0.05); PAB处理组的SOD活力显著高于P处理组(<0.05)。低光恢复240 min后, PAR和PA处理组的SOD活力较光辐射处理后没有显著差异(>0.05), PAB处理组的SOD活力显著增强(<0.05), 增至839.036±5.683 U/g FW, 较光辐射处理后增加了8.54%。
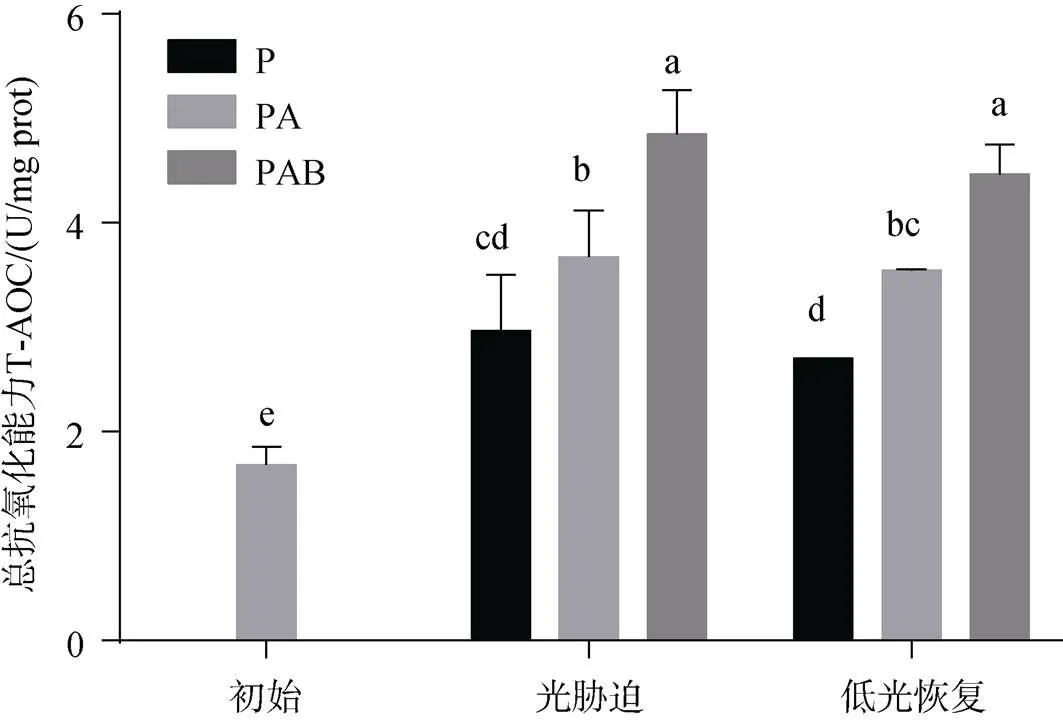
图3 铜藻总抗氧化能力变化
图4b为不同光辐射处理下铜藻CAT活力随时间的变化。初始时铜藻的CAT活力为2.559±0.099 U/mg prot。光辐射处理120 min后, 各处理组的CAT活力均显著升高(<0.05), 分别升高至3.079±0.036、3.320±0.461、6.561±0.333 U/mg prot。P和PA处理组的CAT活力没有显著差异(<0.05), PAB处理组的CAT活力显著高于P和PA处理组(<0.05)。低光恢复过程中, 各处理组的CAT活力较光辐射处理后显著降低(< 0.05), 低光恢复240 min后, 分别降低至1.767±0.139、2.222±0.293、2.718±0.085 U/mg prot, 且3种处理组间的CAT活力均存在显著性差异(<0.05), PA和PAB处理组的CAT活力与初始状态没有显著差异(>0.05), P处理组的CAT活力显著低于初始状态(<0.05)。
不同光辐射处理下铜藻POD活力随时间的变化如图4c所示。铜藻初始状态的POD活力为5.000 U/g FW。随着光辐射处理时间的增加, POD活力均显著增强(<0.05), 光辐射120 min后分别增强至14.000±1、15.667±0.578、18.333±1.528 U/g FW, 在P、PA和PAB 3种辐射处理下分别增至初状态的2.8倍、3.13倍和3.67倍。PA和PAB处理组的POD活力显著高于P处理组(<0.05), 且PAB处理组的POD活力最高。低光恢复240 min后, 各处理组的POD活力较光辐射处理后显著降低(<0.05), 分别降低至6.667± 0.578、8.000、10.333±0.577 U/g FW, PAR和PA处理组间的POD活力没有显著差异(>0.05), PAB处理组的POD活力显著高于PA和PAR处理组, 但各处理组在低光恢复240 min后的POD活力仍高于初始水平。
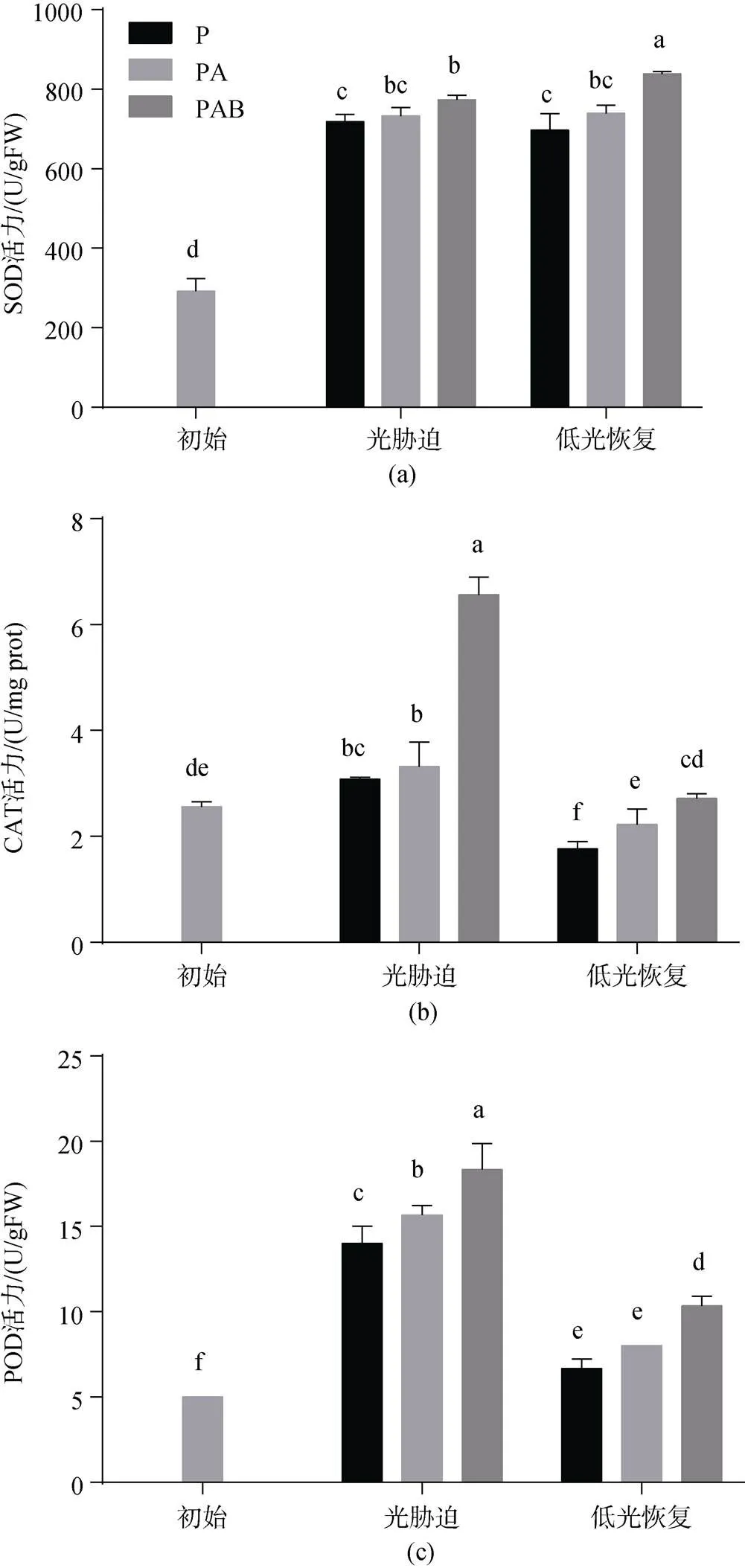
图4 铜藻抗氧化酶活性变化
不同光辐射处理下铜藻GSH含量随时间的变化如图5a所示。铜藻初始状态的GSH含量为0.336 mg/g prot。光辐射处理120 min后, 3种处理下的GSH含量均显著降低(<0.05), 分别降低至0.288±0.014、0.254± 0.016、0.207±0.024 mg/g prot。PA和PAB处理组的GSH含量显著低于P处理组(<0.05), 且PAB处理组的GSH含量最低。低光恢复240 min后, 各处理组的GSH含量较光辐射处理120 min后均显著升高(< 0.05), 分别升高至0.354±0.003、0.398±0.003、0.467± 0.02 mg/g prot, 但P处理组的GSH含量较初始状态没有显著差异(>0.05), PA和PAB处理组的GSH含量显著高于初始状态(<0.05)。
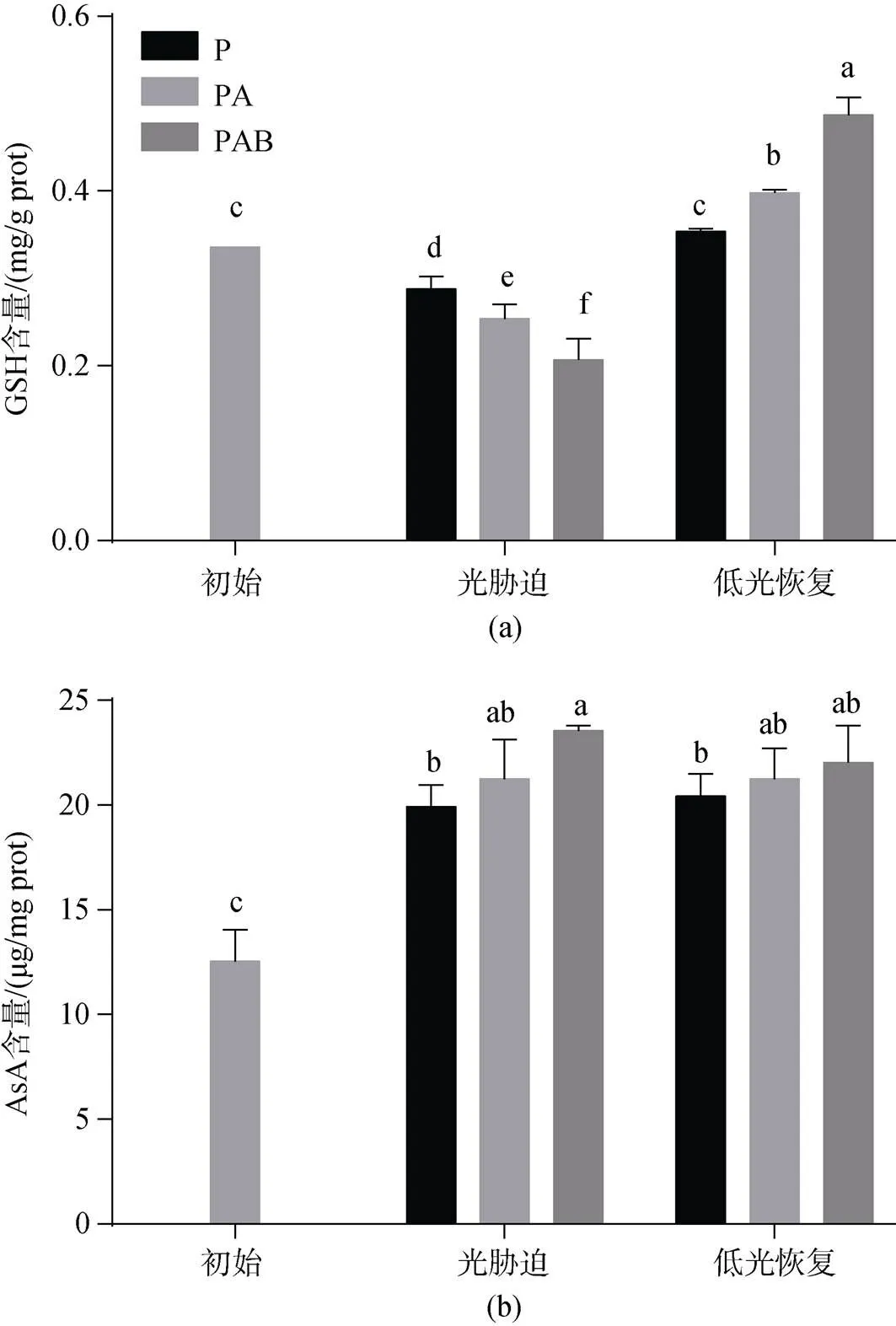
图5 铜藻抗氧化物含量变化
图5b为不同光辐射处理下铜藻AsA含量随时间的变化。铜藻初始状态的AsA含量为12.522±1.530 μg/mg prot。随着光辐射处理时间的增加, 3种处理下的AsA含量均显著升高(<0.05), 分别升高至19.929±1.033、21.243±1.891、23.549±0.256 μg/mg prot。P和PA处理组的AsA含量没有显著差异(>0.05), PAB和PA处理组的AsA含量没有显著差异(>0.05), 但PAB处理组的AsA含量显著高于P处理组(<0.05), 且PAB处理组的AsA含量最高。低光恢复240 min后, 各处理组的AsA含量较光辐射处理后无显著差异(>0.05), 且都高于初始状态。
3 讨论
光合作用是藻类最基础、最重要的生理活动, 能够快速对紫外辐射(ultraviolet radiation, UVR)作出响应。紫外辐射一般直接作用于光合器官, 其中光系统Ⅱ(photosystemⅡ, PSII)对紫外辐射尤其是紫外线B(ultraviolet B, UVB)最为敏感, 受到的光抑制也最严重[29-30]。虽然高可见光能够使藻类的光合活性降低, 电子传递速率减慢[31], 但是UV辐射对藻类的光抑制作用与高可见光相比更加严重。Fv/Fm是PSII的最大光化学量子产量, 它反映的是当所有PSII反应中心均处于开放态时的量子产量。藻类在非胁迫状态下的Fv/Fm约为0.65[32]。当藻类受到环境胁迫时, Fv/Fm显著下降。因此, Fv/Fm是研究光抑制或各种环境胁迫对光合作用影响的重要指标[33]。本研究中, 铜藻在强光处理下Fv/Fm降低, 紫外辐射加剧了这种胁迫, 3种辐射处理中胁迫程度依次为P 紫外线辐射对藻类的有害影响是众所周知的, 包括紫外线(280~315 nm)对脱氧核糖核酸、核糖核酸和蛋白质等分子靶标以及包括光合作用和生长在内的生理过程的直接影响[35-36]。紫外线辐射对藻类的胁迫大多与活性氧(单线态氧“1O2”、超氧自由基“O2–”和过氧化氢“H2O2”)的产生相关[37], 这些产生的活性氧成分在体内可以相互转化, 协同作用,形成一个复杂的反应网络, 因此, 大量活性氧自由基在藻体内的生成及滞留被认为是紫外辐射对海藻产生毒性与伤害作用的主要缘故之一[38]。植物的叶绿体是ROS产生的重要部位。叶绿体光合电子传递系统是 ROS的一个重要来源。在光系统I(photosystem I, PSI)中, 叶绿素分子吸收能量后由基态上升到不稳定的、高能的激发态, 在从激发态向较低能量状态转变的过程中会发生电子的渗漏, 电子转移到O2产生单线态氧1O2。在PSII中激发的三线态叶绿素分子与O2相互作用也产生1O2。UV辐射或强光胁迫引起的光抑制作用也会导致叶绿体内活性氧成分的产生[39]。本研究中, 当铜藻遭受光辐射处理后,O2–、H2O2含量显著升高, 紫外辐射加剧了藻体中活性氧产生, 且PAB处理比PA处理更能刺激藻体中活性氧的产生。MDA含量也因光辐射处理而增多, 且PAB处理组的MDA含量显著高于P和PA处理组。这是由于紫外辐射期间活性氧成分的产生增加, 导致膜脂过氧化[40]。ABO-SHADY等[41]的研究发现, 紫外辐射会增加绿球藻()中MDA含量, 与本研究结果一致。 为适应环境的改变, 藻类经过长期进化, 形成了感应胁迫的系统和有效的防御机制—抗氧化系统[42], 以降低活性氧自由基对细胞的损害。在应对紫外辐射胁迫时, SOD通常作为抗氧化系统的第一道防线, 能催化细胞内的超氧阴离子自由基(O2–)分解为过氧化氢和分子氧[43]。CAT在所有植物细胞中都存在, 它可以将过氧化氢迅速分解为水和氧气[44]。POD在植物体的不同组织中广泛存在, 是一种活性较高的适应性酶。一般来说, POD 可在逆境或衰老初期表达, 可以清除过氧化氢, 有效避免过氧化氢与有机过氧化物在藻类体内的积累, 表现为保护效应, 为细胞活性氧保护酶系统的成员之一[45]。在本研究中, 光辐射处理后, 铜藻内的SOD、POD、CAT活性和T-AOC均显著增强, 加入紫外处理使这些抗氧化酶的活性进一步增强, 且PAB处理组的抗氧化酶活性比PA处理组更强, 说明PAB处理进一步刺激铜藻内抗氧化酶的活性。AGUILERA等[46]研究发现, 夏季由于可见光和紫外辐射增强, 藻类的光合活性增强, 产生高浓度的氧气, 可能会增加氧化应激。随着季节性变化, 在冰破裂后随着水中光线的增高, 红藻(Rhodophyta)和绿藻()礁膜中SOD和CAT活性增强, 显示对UVR抵抗性的增强, 与本研究结果一致。由此可见, 藻类抗氧化状态的增加与环境条件的变化有关, 环境条件的变化促进了更高的光合活性, 从而导致更高水平的抗氧化应激。此外, 抗氧化物在清除活性氧中也发挥着重要作用。AsA和GSH是一类重要的抗氧化物质, 可直接同ROS反应, 将其还原, 又可作为酶的底物在活性氧的清除过程中扮演重要角色[47]。关于GSH的保护作用, 有观点认为氧化型和还原型谷胱甘肽的总量下降, 但保持较高的GSH/GSSG(氧化型谷胱甘肽, Glutathiol, GSSG)比值。本研究中, 光辐射处理120 min后, 铜藻内GSH含量显著降低, 可能与此有关[48], 低光恢复240 min后, GSH含量显著升高, 这可能是由于GSSG在谷胱甘肽还原酶(glutathione reductase, GR)的催化作用下被还原为GSH, 缓解氧胁迫、保护机体[49]。AsA含量在光辐射处理120 min后显著增多, AsA通过传递电子给PSII, 保持电子的持续传递, 以减轻胁迫损伤的程度[50]。此外, 这可能说明GSH在铜藻清除活性氧中发挥的作用很小或者其对光辐射处理不敏感, 而AsA能够作为有效的抗氧化活性物质在活性氧清除反应中发挥更重要的抗氧化作用。AGUILERA等[46]调查了大西洋中22种不同藻类(包括红藻(Rhodophyta)、绿藻(Chlorophyta)及褐藻(Phaeophyta))的抗氧化酶活性, 发现与其他种类的海藻相比, 某些褐藻中的酶活性普遍处于较低水平。而本研究发现, 加入紫外处理后, 铜藻具有较高的SOD、POD、CAT活性, 这可能是紫外辐射胁迫诱导的结果, 是铜藻为了适应逆境条件变化的一种调节性反应, 能够在一定程度上增强铜藻对紫外胁迫的抵抗力。 将处理后的藻体转移到低光条件下, 铜藻内MDA和H2O2含量仍保持较高含量, 但POD、CAT含量显著下降, 这可能是因为胁迫造成了细胞膜脂过氧化程度加深。CAT主要清除光呼吸中产生的H2O2[51], 叶绿体中H2O2的清除是通过 HALLIWELL- ASADA途径进行的[52], 这些H2O2可能要通过另外的途径进行清除。SOD和AsA始终保持较高的值, 最终使得T-AOC与SOD及AsA的变化趋势最为相似(辐射处理后显著升高, 低光恢复后无显著变化)。经紫外胁迫的铜藻, SOD在整个过程中持续发挥作用。此外, AsA对铜藻抗氧化能力也具有重要贡献, 大量合成AsA有助于铜藻应对胁迫环境, 最终使得铜藻的光合活性逐渐恢复。本研究中, PA、PAB处理后的藻体低光恢复速度慢于PAR处理后的恢复速度, 且PAB处理后的藻体恢复速度最慢。这说明PAB引起了更大程度的光损伤, 因此在低光恢复中恢复速度较慢。 综上所述, 当铜藻遭受紫外损伤时, 体内活性氧动态平衡遭到破坏, O2–、H2O2等活性氧成分大量积累, SOD、POD、CAT等抗氧化酶活性短时间内快速上升, 同时机体迅速合成ASA等抗氧化物, 从而在活性氧清除反应中发挥作用。与UVA相比, UVB造成的氧化胁迫及对藻体抗氧化系统的激活具有更加显著的作用。这种抗氧化应激响应的激活, 能够快速修复紫外胁迫下的氧化胁迫, 这可能是漂浮铜藻适应海水表面高UVR辐射的一种保护机制。 [1] 毕远新, 章守宇, 王伟定, 等.枸杞岛铜藻垂直分布格局及成因分析[J].生态学报, 2014, 34(17): 4931- 4937. BI Yuanxin, ZHANG Shouyu, WANG Weiding, et al.Vertical distribution pattern ofand its relationship with environmental factors around Gouqi Island[J].Acta Ecologica Sinica, 2014, 34(17): 4931-4937. [2] TERAWAKI T, YOSHIKAWA K, YOSHIDA G, et al.Ecology and restoration techniques forbeds in the Seto Inland Sea, Japan[J].Marine Pollution Bulletin, 2003, 47(1): 198-201. [3] DAVIS T A, VOLESKY B, VIEIRA R.seaweed as biosorbent for heavy metals[J].Water Research, 2000, 34(17): 4270-4278. [4] SFRISO A, FACCA C.Annual growth and environmental relationships of the invasive speciesandin the lagoon of Venice[J].Estuarine Coastal and Shelf Science, 2013, 129: 162-172. [5] TUSSENBROEK B V, HERNÁNDEZ ARANA H A, RODRÍGUEZ-MARTÍNEZ R E.Severe impacts of brown tides caused bysppon near-shorecommunities[J].Marine Pollution Bulletin, 2017, 122: 272-281. [6] BYEON S Y, OH H J, KIM S.The origin and population genetic structure of the ‘golden tide’ seaweeds,, in Korean waters[J].Scientific Reports, 2019, 9: 7757. [7] MA J, WANG W, LIU X Y, et al.Zinc toxicity alters the photosynthetic response of red algato ocean acidification[J].Environmental Science and Pollution Research, 2020, 27: 3202-3212. [8] VICTOR S, ADRIANA Z.Green and golden seaweed tides on the rise[J].Nature, 2013, 504: 84-88. [9] CASELLE J E, DAVIS K, MARKS L M.Marine management affects the invasion success of a non-native species in a temperate reef system in California, USA[J].Ecology Letters, 2018, 21: 43-53. [10] COOK E, PALYS J E.A fish kill coincident with denseaccumulation in a tropical bay[J].Bulletin of Marine Science, 2015, 91(4): 455-456. [11] WILLIAMS A, FEAGIN R.as a natural solution to enhance dune plant growth[J].Environmental Management, 2010, 46(5): 738-747. [12] XING Q G, GUO R H, WU L L, et al.High-resolution satellite observations of a new hazard of golden tides caused by floatingin winter in the Yellow Sea[J].IEEE Geoscience and Remote Sensing Letters, 2017, 14(10): 1815-1819. [13] RUMYANTSEVA A, HENSON S, MARTIN A, et al.Phytoplankton spring bloom initiation: The impact of atmospheric forcing and light in the temperate North Atlantic Ocean[J].Progress in Oceanography, 2019, 178: 102202. [14] QI L, HU C M, WANG M Q, et al.Floating algae blooms in the East China Sea[J].Geophysical Research Letters, 2017, 44: 11501-11509. [15] TEDETTI M, SEMPÉRÉ R.Penetration of ultraviolet radiation in the marine environment.A review[J].Photochemistry & Photobiology, 2010, 82(2): 389-397. [16] 韩博平, 韩志国, 付翔.藻类光合作用机理与模型[M].北京: 科学出版社, 2003. HAN Boping, HAN Zhiguo, FU Xiang.Mechanism and model of algal photosynthesis[M].Beijing: Science Press, 2003. [17] NAN G N, ZHANG Q S, SHENG Z T, et al.Coordination between xanthophyll cycle and antioxidant system in(Sargassaceae, Phaeophyta) in response to high light and dehydration stresses[J].Journal of Applied Phycology, 2016, 28(4): 2587-2596. [18] 陈善文, 武宝玕.藻类对UV-B增强的响应及其分子基础(综述)[J].暨南大学学报(自然科学与医学版), 2000, 5: 88-94. CHEN Shanwen, WU Baoxuan.Algal responses to enhanced UV-B and its mechanism on molecular level[J].Journal of Jinan University(Natural Science and Medicine Edition), 2000, 5: 88-94. [19] WU H Y, COCKSHUTT A M, CAMPBELL M C A.Distinctive photosystem II photoinactivation and protein dynamics in marine diatoms[J].Plant Physiology, 2011, 156(4): 2184-2195. [20] NISHIYAMA Y, YAMAMOTO H, ALLAKHVERDIEV S.Oxidative stress inhibits the repair of photodamage to the photosynthetic machinery[J].The EMBO Journal, 2014, 20(20): 5587-5594. [21] APEL K, HIRT H.Reactive oxygen species: Metabolism, oxidative stress, and signal transduction[J].Annual Review of Plant Biology, 2004, 55(1): 373-399. [22] NANDA R, AGRAWAL V.Elucidation of zinc and copper induced oxidative stress, DNA damage and activation of defence system during seed germination inVahl[J].Environmental and Experimental Botany, 2016, 125: 31-41. [23] 宫庆礼, 王鹏, 王晓艳, 等.温度对裙带菜幼孢子体抗氧化系统的影响[J].中国海洋大学学报(自然科学版), 2016, 46(11): 91-98. GONG Qingli, WANG Peng, WANG Xiaoyan, et al.Effect of temperature on antioxidant system of juvenileSporophyte[J].Periodical of Ocean University of China(Natural Science Edition), 2016, 46(11): 91-98. [24] 宣慧, 佟少明, 侯和胜.高温胁迫对海带配子体生长和生理的影响[J].天津农业科学, 2011, 17(2): 5-8. XUAN Hui, TONG Shaoming, HOU Hesheng.Effects of high temperature stress on growth and physiology of gametophytes of[J].Tianjin Agricultural Sciences, 2011, 17(2): 5-8. [25] 鹿宁, 臧晓南, 张学成, 等.高温胁迫下不同龙须菜品系抗氧化能力的比较[J].武汉大学学报(理学版), 2010, 56(5): 570-577. LU Ning, ZANG Xiaonan, ZHANG Xuecheng, et al.Comparison of antioxidant activities of different strains ofunder high-temperature stress[J].Journal of Wuhan University(Nature Science Edition), 2010, 56(5): 570-577. [26] 马茜, 王玉珏, 孙西艳, 等.光和温度对两种绿潮藻光合途径及抗氧化功能的影响[J].海洋学报, 2020, 42(8): 21-29. MA Qian, WANG Yuyu, SUN Xiyan, et al.Effects of light and temperature on the photosynthetic pathway and antioxidant function of two green tide species[J].Haiyang Xuebao, 2020, 42(8): 21-29. [27] 詹冬梅, 吴海一, 侯和要, 等.漂浮铜藻室内保存及海上越冬试验[J].海洋湖沼通报, 2019, 2: 116-122. ZHAN Dongmei, WU Haiyi, HOU Heyao, et al.Tentative indoor conservation and seawater overwintering of floating seaweed[J].Transactions of Oceanology and Limnology, 2019, 2: 116-122. [28] FRANCESCO G, CHECCUCCI G, BORNMAN J F.Environmental UV radiation: impact on ecosystems and human health and predictive models[M].Netherlands: Springer, 2006. [29] SPETEA C, HIDEG É, VASS I.The quinone electron acceptors are not the main sensitizers of UV-B induced protein damage in isolated photosystem II reaction centre and core complexes[J].Plant Science, 1996, 115(2): 207- 215. [30] VASS I, TURCSÁNYI E, TOULOUPAKIS E, et al.The mechanism of UV-A radiation-induced inhibition of photosystem II electron transport studied by EPR and chlorophyll fluorescence[J].Biochemistry, 2002, 41(32): 10200-10208. [31] 徐沙, 杨燕君, 许金铸, 等.群体和单细胞微囊藻对短期高光胁迫的生理响应[J].水生生物学报, 2017, 41(2): 443-447. XU Sha, YANG Yanjun, XU Jinzhu, et al.Colonial and single-celled form of microcystis to short-term high stress[J].Acta Hydrobiologica Sinica, 2017, 41(2): 443-447. [32] KOLBER Z, FALKOWSKI Z P.Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem II[J].Plant Physiology, 1988, 88(3): 923-929. [33] 梁丽壮, 李晓燕, 胡雪.沙柳实际光化学效率与光合有效辐射日变化动态及其对环境因子的响应[J].华东森林经理, 2020, 34(3): 1-8. LIANG Lizhuang, LI Xiaoyan, HU Xue.Diurnal variation of actual photochemical efficiency and photosynthetic active radiation ofand its response to environmental factors[J].East China Forest Management, 2020, 34(3): 1-8. [34] 周娜娜, 冯素萍, 高新生, 等.植物光合作用的光抑制研究进展[J].中国农学通报, 2019, 35(15): 116-123. ZHOU Nana, FENG Suping, GAO Xinsheng, et al.Research progress on photoinhibition of plant photosynthesis[J].Chinese Agricultural Science Bulletin, 2019, 35(15): 116-123. [35] AGUILERA J, KARSTEN U, LIPPERT H, et al.Effects of solar radiation on growth, photosynthesis and respiration of marine macroalgae from the Arctic[J].Marine Ecology Progress Series, 1999, 191(10): 109- 119. [36] BISCHOF K, HANELT D, WIENCKE C, et al.UV- effects on photosynthesis and related enzyme reactions of marine macroalgae[J].Planta, 2000, 211: 555-562. [37] LESSER M P.Acclimation of phytoplankton to UV-B radiation: oxidative stress and photoinhibition of photosynthesis are not prevented by UV-absorbing compounds in the dinoflagellate[J].Marine Ecology Progress Series, 1996, 132(1/3): 287-297. [38] MALANGA G, PUNTARULO S.Oxidative stress and antioxidant content inafter exposure to ultraviolet-B radiation[J].Physiologia Plantarum, 2010, 94(4): 672-679. [39] FRYER M J, KEVIN O, MULLINEAUX P M, et al.Imaging of photo-oxidative stress responses in leaves[J].Journal of Experimental Botany, 2002, 372: 1249-1254. [40] SABER H, EI-SHEEKH M M, IBRAHIM A, et al.Effect of UV-B radiation on amino acids profile, antioxidant enzymes and lipid peroxidation of some cyanobacteria and green algae[J].International Journal of Radiation Biology, 2020, 96: 1-30. [41] ABO-SHADY A M, EI-SHEEKH M M, EI-NAGGAR A H.Effect of UV-B radiation on growth, photosynthetic activity and metabolic activities ofsp.[J].Annals of Microbiology, 2008, 58(1): 21-27. [42] 李璇, 岳红, 王升, 等.影响植物抗氧化酶活性的因素及其研究热点和现状[J].中国中药杂志, 2013, 38(7): 973-978. LI Xuan, YUE Hong, WANG Sheng, et al.Research of different effects on activity of plant antioxidant enzymes[J].China Journal of Chinese Materia Medica, 2013, 38(7): 973-978. [43] GRENE A R, NEVAL E, HEATH L S.Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J].Journal of Experimental Botany, 2002, 372: 1331-1341. [44] 尹永强, 胡建斌, 邓明军.植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J].中国农学通报, 2007, 1: 105-110. YIN Yongqiang, HU Jianbin, DENG Mingjun.Latest development of antioxidant system and responses to stress in plant leaves[J].Chinese Agricultural Science Bulletin, 2007, 1: 105-110. [45] ZHANG J, KIRKHAM M B.Drought-stress-induced changes in activities of superoxide dismutase, catalase, and peroxidase in wheat species[J].Plant and Cell Physiology, 1993, 35(5): 785-791. [46] AGUILERA J, BISCHOF K, KARSTEN U.Seasonal variation in ecophysiological patterns in macroalgae from an Arctic fjord.II.Pigment accumulation and biochemical defence systems against high light stress[J].Marine Biology, 2002, 140(6): 1087-1095. [47] 张容芳, 唐东山, 刘飞.藻类抗氧化系统及其对逆境胁迫的响应[J].环境科学与管理, 2011, 36(12): 21-25. ZHANG Rongfang, TANG Dongshan, LIU Fei.Algae antioxidant system and its influence on stress[J].Environmental Science and Management, 2011, 36(12): 21-25. [48] SGHERRI C L M, LOGGIM B, BOCHICCHIO A, et al.Antioxidant system in Boea hygroscopica: changes in response to desiccation and rehydration[J].Phytochemistry, 1994, 37(2): 377-381. [49] 程华, 李琳玲, 常杰, 等.植物抗氧化酶的研究进展[C]// 园艺学进展(第八辑)—中国园艺学会第八届青年学术讨论会暨现代园艺论坛论文集.上海: 上海交通大学出版社, 2008. CHENG Hua, LI Linling, CHANG Jie, et al.Research progress of plant antioxidant enzymes[C]// Progress in horticulture (Part 8) —Proceedings of the 8th Youth Symposium and Modern Horticultural Forum of Chinese Horticultural Society.Shanghai: Shanghai Jiaotong University Press, 2008. [50] TOTH S Z, NAGY V, PUTHUR J T, et al.The physiological role of a-scorbate as photosystem ll electron donor: protection against pho-toinactivation in heat-stressed leaves[J].Plant Physiology, 2011, 156(1): 382-392. [51] WILLEKENS H, LANGEBARTELS C, TIRE C, et al.Differential expression of catalase genes in(L.)[J].Proceedings of the National Academy of Sciences, 1994, 91(22): 10450-10454. [52] 陈立松, 刘星辉.水分胁迫对龙眼幼苗叶片膜脂过氧化及内源保护体系的影响[J].武汉植物学研究, 1999, 2: 105-109. CHEN Lisong, LIU Xinghui.Effects of water stress on leaf membrane lipid peroxidation and endogenous protection system in longan young seedlings[J].Journal of Wuhan Botanical Research, 1999, 2: 105-109. Anti-oxidative stress response ofto UV radiation exposure LI Ling-xue1, YAN Fang1, 2, WU Hong-yan1, 2, ZANG Sha-sha1, 2, JIANG Xiao-tong1, LI Bao-qi1, LV Zheng-zheng1, XU Zhi-guang1, 2 (1.School of Life Sciences, Ludong University, Yantai 264025, China; 2.Key Laboratory of Marine Biotechnology in Universities of Shandong, Ludong University, Yantai 264025, China) ; UVR; photosynthetic activity; oxidative stress response The enhancement of ultraviolet radiation (UVR) usually leads to the production of reactive oxygen species in algae, thus damaging the photosynthetic organs of algae and causing algae photoinhibition.golden tide frequently broke out in many parts of the world in recently years.When the golden tide forms, the algae drifting on the sea surface would receive more UVR, but the physiological mechanism of the golden tide algae to cope with this UVR stress is still unclear.In this study,, the species responsible for the Golden tide in China, was selected as the research object and was introduced to three distinct radiation treatments of P (PAR, photosynthetic active radiation, 400–700 nm, 200 W/m2), PA (PAR+UVA, 320–400 nm) and PAB (PAR+UVA+UVB, 280–700 nm) implemented by the laboratory set solar simulator, to investigate the photosynthetic activity and the anti-oxidative stress response of this algae to the UVR exposure.The results demonstrated that the photosynthetic activity of algae was inhibited by all three radiation treatments, emulated by the decline in the maximum photochemical quantum yield (Fv/Fm) with radiation period, which included the decreasing degree of PAB>PA>P.During the following recovery of low light (PAR, 2.0 W/m2), Fv/Fmof algae recovered gradually.Correspondingly, the contents of the O2–, H2O2(reactive oxygen species, ROS) and the MDA (product of membrane lipid peroxidation) in the algae exposed to UVR increased significantly under the PAB treatment demonstrating a higher proportion in comparison to the PA treatment.Additionally, such UVR-induced high levels of the O2–, H2O2,and the MDA was sustained till the low-light recovery process.The antioxidant enzymatic activities of the SOD, CAT, and the POD, along with the AsA capacity, also significantly rose from the initial respective radiation treatments.However, during the low light recovery process, the CAT and the POD activity declined, but no such decrease was measured in the SOD and the AsA activity, illustrating that the total antioxidant capacity (T-AOC) of the algae sustained a comparatively higher level throughout the culture.During both the respective radiation treatments and the low light recovery process, the UVR, including the UVA and the UVB, exhibited substantive elevation in the accumulation of the oxidases, antioxidants, and the T-AOC, with the highest values measured under the PAB treatment.The innovation of this study is that for the first time, the anti-oxidative stress responses of golden tide algae under UVR stress have been systematically and comprehensively explored, which would provide important data support for revealing the physiological mechanism of adaption to drifting in. [Shandong Provincial Natural Science Foundation, Nos.ZR2020MD092, ZR2019MC015, ZR2020QC025] Jul.13, 2021 P735 A 1000-3096(2022)03-0081-12 10.11759/hykx20210713001 2021-07-13; 2021-09-27 山东省自然科学基金项目(ZR2020MD092; ZR2019MC015; ZR2020QC025) 李凌雪(1997—), 女, 山东日照人, 硕士研究生, 主要从事藻类生理生态相关研究, E-mail: 1054135191@qq.com; 徐智广(1977—), 通信作者, E-mail: bigwide@163.com (本文编辑: 谭雪静)

