双层探测器光谱CT诊断肝纤维化分期的最佳单能量研究
袁海滨 李 新 强金伟 王璐娜 杨琰昭 李若坤
肝纤维化是肝组织对不同病因所造成的慢性肝损伤的修复反应,血管生成在肝纤维化进程中具有重要作用[1]。新生血管的数量、形态及功能对肝脏血流动力学均有不同程度的影响,表现为肝脏的强化异常,进而通过CT值测量、CT灌注成像等方法得以反映。由于X线衰减系数与物质组成并不直接相关,这就造成了基于CT值的灰度图像在物质鉴别和精准定量方面受到限制。
双层探测器光谱CT技术是新一代双能量CT成像技术,单次扫描即可获得常规混合能量图像(conventional polyenergetic images,CPI)和虚拟单能量图像(virtual monoenergetic image,VMI)[2-3]。VMI可以改善图像质量、提高软组织对比,有助于肝脏血管显示、肿瘤检出及鉴别[2,6]。本研究拟探讨双层探测器光谱CT最佳单能量成像对肝纤维化分期的诊断价值。
方 法
1. 动物模型
6月龄雄性新西兰大白兔30只[生产许可证号SCXK(沪)2012-0011,使用许可证号SYXK(沪)2008-0050],体重1.5~2 kg,由上海交通大学医学院附属瑞金医院实验动物中心采购。实验组(n=26)采用腹腔注射10%CCI4诱导肝纤维化,0.2 mL/kg;对照组(n=4),腹腔注射同等剂量生理盐水。实验组于初次给药后每2周随机选取4只进行CT检查,对照组于2周后行CT检查。
2. 检查方法
采用双层探测器光谱CT(IQon Spectral CT,Philips Healthcare,Best,The Netherland)进行扫描,参数如下:管电压120 kV;固定电流50 mA,探测器配置为64 mm×0.625 mm,螺距0.891;旋转时间0.27 s。耳缘静脉静脉注射碘对比剂(350 mgI/mL),剂量5 mL,速率0.5 mL/s,采用主动脉阈值触发法进行增强扫描,主动脉达到设定阈值后延迟5 s和60 s采集动脉期(arterial phase,AP)、门脉期(venous phase,VP)图像。扫描完成后自动生成SBI(spectral based image)图像,重建层厚和层距均为1 mm。
3. 图像分析
使用光谱多模态肿瘤跟踪(software-spectral multimodality tumor tracking,sMMTT)半自动分割技术勾画全肝及主动脉感兴趣区(ROI),避免肉眼可见的门区血管及胆管分支,测量全肝混合能量(CPI)及不同单能量图像(VMI 40~70 keV)的平均CT值。根据以下公式计算肝脏标准化强化值:ΔCT=(CTlivercontrast-CTliverprecontrast)/(CTaortacontrast-CTaortaprecontrast)。
4. 病理学检查
扫描结束后耳缘静脉注射10%氯化钾5 mL处死家兔,右前叶上段组织取材,行HE及Masson染色。根据METAVIR系统进行肝纤维化分期:F0,无肝纤维化;F1,门管区少量纤维化;F2,门脉周围少量纤维间隔形成;F3,大量纤维间隔形成,但未形成假小叶;F4,肝硬化。
5. 统计学分析
采用方差分析比较不同纤维化分期动脉期和门脉期肝脏ΔCT值差异;采用Spearman相关性分析明确动脉期、门脉期的肝脏ΔCTCPI及ΔCTVMI(40~70)与纤维化分期相关性;采用ROC评价对纤维化分期的诊断效能。统计分析采用SPSS22.0软件,P<0.05为差异有统计学意义。
结 果
30只实验动物中,F0~F4期肝纤维化数目分别为4、5、6、11和4。正常肝脏和肝纤维化CT影像和病理结果见图1和2。
不同纤维化分期动脉期和门脉期肝脏ΔCT值见表1和2,动脉期肝脏ΔCT值无差异,门静脉期ΔCT值存在显著性差异。
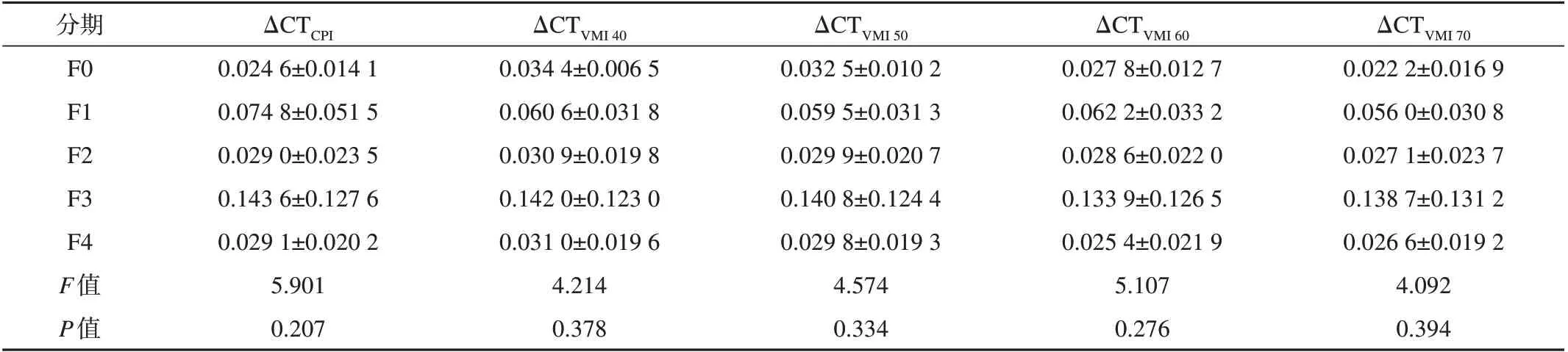
表1 不同分期纤维化动脉期肝脏标准化强化值(ΔCT)
动脉期ΔCTCPI及ΔCTVMI(40~70)值与纤维化均无相关性(表3);门脉期ΔCTCPI及ΔCTVMI(40~70)值与纤维化呈不同程度正相关(表3),其中门脉期ΔCTVMI40与纤维化的相关性最高(r=0.595,P=0.001),门脉期ΔCTCPI与纤维化相关性最低(r=0.453,P=0.012)。门脉期ΔCTVMI40与纤维化分期相关性见图3。
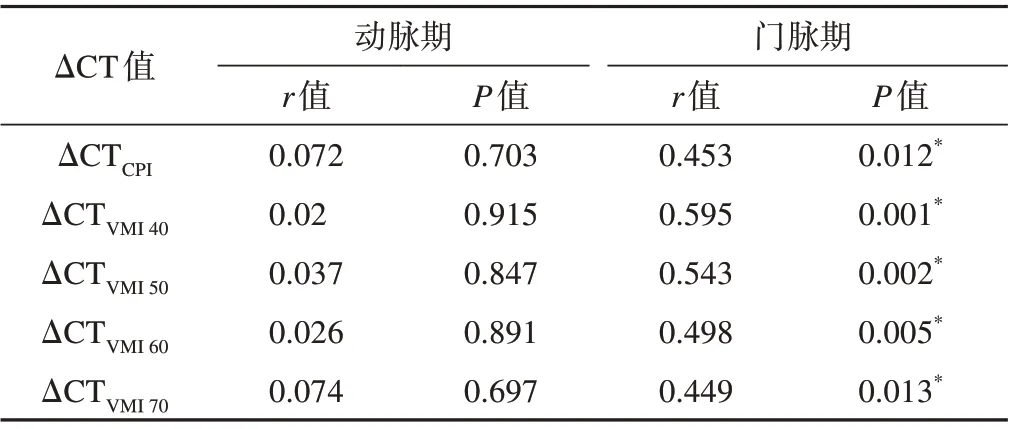
表3 动脉期和门脉期肝脏ΔCT值与纤维化相关性
门脉期ΔCTVMI40对各期肝纤维化的诊断效能见表4和图4。

表4 门脉期肝脏ΔCTVMI 40对肝纤维化的诊断效能
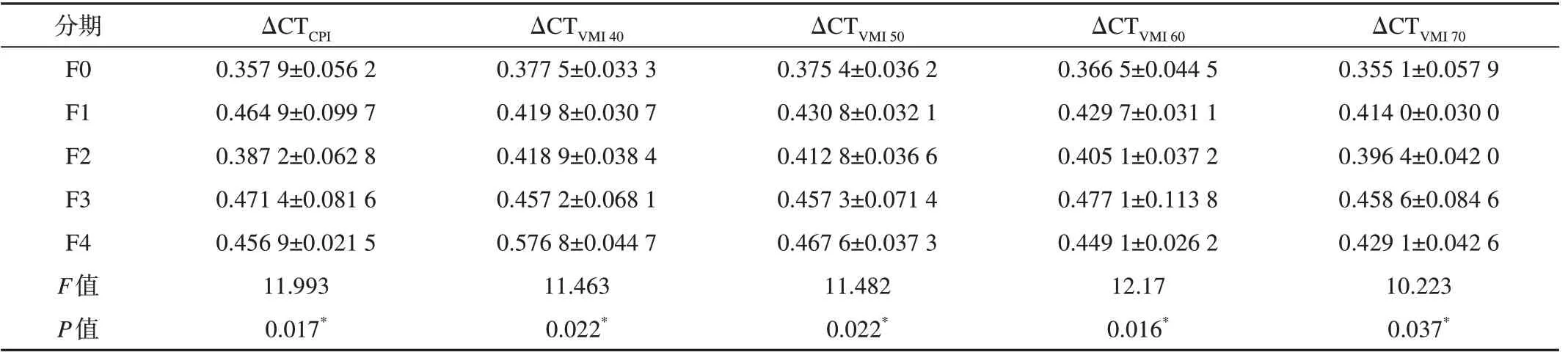
表2 不同分期纤维化门脉期肝脏标准化强化值(ΔCT)
讨 论
1.双层探测器能谱CT原理
光谱CT的基本结构和普通CT相似,但有上、下两层空间上对等的探测器,可以利用探测器实现改动能量的分离,低能级X射线被顶层钇基石榴石层吸收,高能级X射线被下层稀土陶瓷GOS层吸收,可进行重建虚拟单能量图像。双层探测器采集的高、低能数据在投影数据域内时间和空间上完全匹配的前提下进行解析,包含有常规CT图像信息及各种能谱信息,可直接调用实现能谱多参数图像的重建,并可供回顾性分析使用。与其他双能量CT成像模式相比,双层探测器技术的优势在于扫描前不用预判是否需要双能量扫描,没有器官和扫描视野的限制,而且高、低能两套数据集在空间和时间上完全配准,有助于大幅度降低能谱图像的噪声[8]。
2.肝纤维化与血管生成
血管生成是肝纤维化进程中的重要病理生理过程之一[9]。Lu等[10]采用同步辐射X线相衬衍射增强成像(DEI)技术研究肝纤维进程中的微血管变化,结果显示,与正常对照组比较,肝纤维化组(造模6周)血管密度增加1.4倍,肝硬化组(造模10周)增加2倍,在造模30周后肝纤维化发生逆转,其血管密度较肝硬化组减少约30%,CD34免疫组化显示正常组、肝纤维化组和肝硬化组微血管密度分别为7.1±2.3、9.42±2.12和14.4±3.11,提示不同阶段肝纤维化血管生成存在差异。既往研究显示,在不同的肝纤维化时期,基于CT灌注成像的血流平均通过时间、门静脉灌注和肝脏总体血流灌注之间存在显著的不同[11-12]。
3.最佳单能量monoE诊断肝纤维化的价值
双层探测器光谱CT在获取常规图像的同时还可获取VMI,每个图像序列能级用keV表示,范围从40至200,低keV范围内VMI可增强碘可视化程度。本研究结果显示,动脉期肝脏ΔCT值在门静脉期差异显著,采用混合能量CT值测量时,ΔCT值与纤维化分期呈中等相关(r=0.453,P=0.012),进一步的VMI定量分析显示,其相关性随能级减低而增加,VMI 40 keV时接近强相关(r=0.595,P=0.001),对各期肝纤维化均显示出较高的诊断效能(AUC:0.790~0.865)。
总之,双层探测器光谱CT最佳单能量成像较混合能量成像更灵敏地显示肝脏强化值与纤维化程度相关性,对肝纤维化诊断分期具有重要价值。但本研究有一定局限性:各期肝纤维化分布不够均衡,会导致阳性预测值偏高;仅为动物模型中的发现,不能完全模拟肝纤维化的真实过程,研究结论还需要在临床人群中进一步验证。

