镉在南美蟛蜞菊、蟛蜞菊及其杂交种中的迁移和分布特征
黄骏东,柯伟倩,陈广欣,古晓倩,张启雷,2*,彭长连*
镉在南美蟛蜞菊、蟛蜞菊及其杂交种中的迁移和分布特征
黄骏东1,柯伟倩1,陈广欣1,古晓倩1,张启雷1,2*,彭长连1*
(1. 广东省植物发育生物工程重点实验室, 华南师范大学生命科学学院, 广州 510631; 2. 中国林业科学研究院热带林业研究所, 广州 510520)
为了解植物对镉的吸收和迁移特性,用200mol/L镉处理蟛蜞菊()、南美蟛蜞菊()及其杂交种,研究了其对镉的吸收、迁移与分布的差异。结果表明,随着镉处理时间的延长,3种植物茎和叶中的镉含量逐渐上升,叶片的镉含量逐渐与茎相当,而根部的镉含量一直是最高的;整株水平上,杂交种的镉含量一直是最高的。恢复生长后,3种植物根中镉含量均呈下降趋势,杂交种(50.4%)>蟛蜞菊(35.8%)>南美蟛蜞菊(33.7%)。镉在3种植物的叶位分布模式在去镉前后没有明显的变化,杂交种更偏向将重金属镉积累于幼叶和成熟叶中。3种植物从叶脉、叶脉间隙到叶片边缘的镉含量逐渐下降,南美蟛蜞菊叶脉的镉含量(2 766.3g/kg)最高。可见,杂交种对镉的吸收和转运转移能力高于双亲, 预示其在未来应用于植物修复中具有更大的潜力。
镉;蟛蜞菊;杂交种;植物修复;重金属
随着我国经济的发展,工农业生产活动对大气、水体和土壤的重金属污染程度越来越严重。我国国土资源部和环境保护部在2014年发布的报告中指出,镉在重金属土壤污染中排第一位,在过去30 a间呈逐年上升的趋势,并预计农业用地的镉浓度未来以较高的速率逐年提高[1]。镉作为一种非必需元素,对于生物体是一种危害性较大的有毒重金属[2],镉的物理化学性质决定了其在水、土壤和空气中的高移动性[3–4],并且镉在食物链中转移性高,威胁人类健康[5]。镉在生态系统中移动的一个重要环节是“土壤-植物”,即从土壤中富集于植物体的过程。镉从土壤进入植物体的第一步是根部的吸收,主要通过共质体与质外体途径进入到根的维管系统,而后通过木质部和韧皮部往地上部分运输并发生再分配[6]。镉对植物生长发育产生不利的影响, 如影响植物对其他营养元素的吸收、转移和利用,抑制植物的光合作用等代谢过程,打破植物体内活性氧代谢平衡,使活性氧不断积累造成氧化胁迫, 最终导致叶片黄化、卷曲、萎蔫等[7–9]。
目前国内外已经有多种治理方法来有效降低重金属含量,其中植物和微生物修复法具有良好的生态效益和经济效益[10],植物修复技术包括植物提取、植物稳定和植物挥发。植物提取是植物从土壤中吸收重金属元素,并在茎和叶中存留,这涉及植物对重金属的吸收、转移并富集至地上部分的可收集部位,从而进行收割处理[10–11]。植物对重金属的吸收、转移和在地上部再分配能力在植物修复重金属土壤效率中起着关键作用[12–13]。
种间杂交是植物界普遍现象,本地种与外来种的杂交已有许多报道[14]。入侵种与本地种的杂交被认为是促进植物入侵力和适应性的主要推动力之一,其主要机制是通过杂交形成新的物种、引起遗传变异、固定杂种优势、降低遗传负荷等多个途径,促进入侵力和适应性的进化,所形成的杂交种相较于双亲具有更高的适应性与更宽的生态位[15],因此,杂交种通常对环境胁迫具有更高的耐受力。南美蟛蜞菊(),又称三裂叶蟛蜞菊,菊科(Compositae)蟛蜞菊属多年生草本植物, 是世界最有害的100种入侵物种之一[16],原产于南美洲及中美洲热带地区,起初以地被绿化植物引入, 而后逃逸成为入侵种,在华南地区对社会经济和生态系统造成严重的损失和破坏[17]。蟛蜞菊()为同属多年生草本植物,广泛分布于我国华南地区。2013年,Wu等[18]在野外发现并鉴定了1种表型介于南美蟛蜞菊和蟛蜞菊之间的杂交种,前期研究表明,杂交种的竞争力与南美蟛蜞菊相似,且对氮沉降更为敏感[19],但对低温低光环境的适应性没有出现超亲优势[20]。
前期研究结果表明,南美蟛蜞菊[21–23]和蟛蜞菊[24–25]能够富集镉并对其具有一定的耐受性。但是,2种蟛蜞菊及其杂交种对镉的吸收、转运转移能力的比较研究尚未见报道。因此,本研究在营养液中添加氯化镉培养蟛蜞菊、南美蟛蜞菊及其杂交种,探讨镉在植物体内的迁移和分布情况,以了解杂交种对镉的迁移能力是否具有超亲优势及其未来在植物修复上的应用潜力。
1 材料和方法
1.1 材料
蟛蜞菊()、南美蟛蜞菊()及其杂交种采自广州市中国科学院华南植物园园区(23º10′ N, 113º21′ E)。在夏季5—6月份,3种植物以扦插苗的方式在培养箱中室温培养,待茎条长出2~3 cm的根和嫩芽后,转移至Hoagland营养液中培养,每隔7 d换1次营养液, 待长出3~ 4对叶子时,选取生长状态一致的幼苗进行后续试验。前期试验表明,植物经200mol/L的镉处理能存活且较快出现重金属胁迫相关症状,因此采用200mol/L镉处理。幼苗分为处理组和对照组,每种5株,共15株,置于育苗盆中。对照组使用Hoag- land营养液培养,处理组在Hoagland营养液中添加200mol/L氯化镉。镉胁迫21 d后3种植物转移至无镉营养液中继续恢复培养7 d,比较植株不同部位叶片中镉含量的变化,以考察镉的移动性。
1.2 方法
镉和其他金属元素含量的测定 3种植物分别进行镉处理7、21和28 d后,收集植株,5次生物学重复(下同)。先用蒸馏水冲洗根系,重复3次,而后置于20 mmol/L EDTA-Na2溶液中浸泡15 min,重复浸泡2次后再用蒸馏水冲洗3次,以除去根系表面附着的重金属离子。将根系、叶片、茎分开放入样品袋,于100 ℃下杀青30 min,然后在60 ℃下烘干,用研磨器粉碎,保存备用。准确称取根、茎、叶粉末各0.20 g,移至消解罐中,加入浓硝酸5 mL,使用微波消解仪(COOLPEX, 上海屹尧)进行消解。消解过后,定容至50 mL。使用电感耦合等离子体质谱仪(Agilent7800, USA)测定样品的Cd2+含量及其他金属(Na、K、Ca、Mn、Fe、Zn和Cu)离子含量。
叶片各部位镉含量的测定 为检测叶片中镉的分布情况,取镉胁迫处理21 d后的从茎顶端往下第3片叶片(也是发黄症状最为明显的叶片),将叶片分为叶脉、叶片边缘和叶脉间隙3个部分(图1),分别消解并测定其镉含量。

图1 叶片部位
1.3 数据统计分析
实验数据通过IBM SPSS Statistics 19.0 (IBM, Armonk, NY, USA)进行统计分析。对3种植物根、茎、叶中的镉含量进行单因素方差分析, 采用Duncan’s法进行多重比较(<0.05)。采用Sigmaplot 14.0 (Systat Software Inc., USA)进行绘图。
2 结果和分析
2.1 镉胁迫下表型变化
从图2可见, 3种植物在200mol/L镉胁迫下,叶片均出现了黄化现象,南美蟛蜞菊叶片的黄化最为严重,叶片基部叶脉处甚至出现了褐色坏死斑,而在蟛蜞菊和杂交种的叶片中没有出现明显的坏死斑。
2.2 根、茎、叶中镉含量的变化
从表1可见,随镉胁迫时间的延长,叶片的镉含量呈逐渐上升的趋势,胁迫7 d杂交种叶片中镉含量最高,南美蟛蜞菊和蟛蜞菊的没有显著差异; 胁迫28 d,南美蟛蜞菊叶片中镉含量最高。与叶片的变化趋势相似,3种植物茎的镉含量也逐渐升高,杂交种茎部镉含量最高。根的镉含量呈现先升后降的变化趋势,胁迫28 d后,南美蟛蜞菊根的镉含量最高。从整株植物来看,3种植物的镉含量均呈现上升的趋势,以杂交种的最高。
从图3可见,镉主要分布于叶片和茎中,随着胁迫处理时间的延长,镉在南美蟛蜞菊和杂交种根中所占比例逐渐下降,而蟛蜞菊则呈先升后降的变化趋势;镉在蟛蜞菊和南美蟛蜞菊茎中所占比例逐渐下降,杂交种呈先降后升的变化趋势;镉在蟛蜞菊和南美蟛蜞菊的叶片中所占比例呈上升趋势,杂交种呈先升后降的趋势。胁迫28 d后,镉在茎中所占比例依次为杂交种(55%)、蟛蜞菊(53%)和南美蟛蜞菊(42%);叶中依次为南美蟛蜞菊(54%)、蟛蜞菊(42%)和杂交种(38%);根中依次为杂交种(7%)、蟛蜞菊(5%)和南美蟛蜞菊(4%)。可见,南美蟛蜞菊吸收的镉主要集中在光合器官(叶)中,而蟛蜞菊和杂交种集中在茎中。

图2 3种植物在200 μmol/L镉胁迫下的表型

表1 胁迫下根、茎、叶镉含量的变化(μg/kg DW)
=5。同列数据后不同字母表示差异显著(<0.05, Duncan’s检验)。
=5. Data followed different letters indicate significant differences at 0.05 level by Duncan’s test.
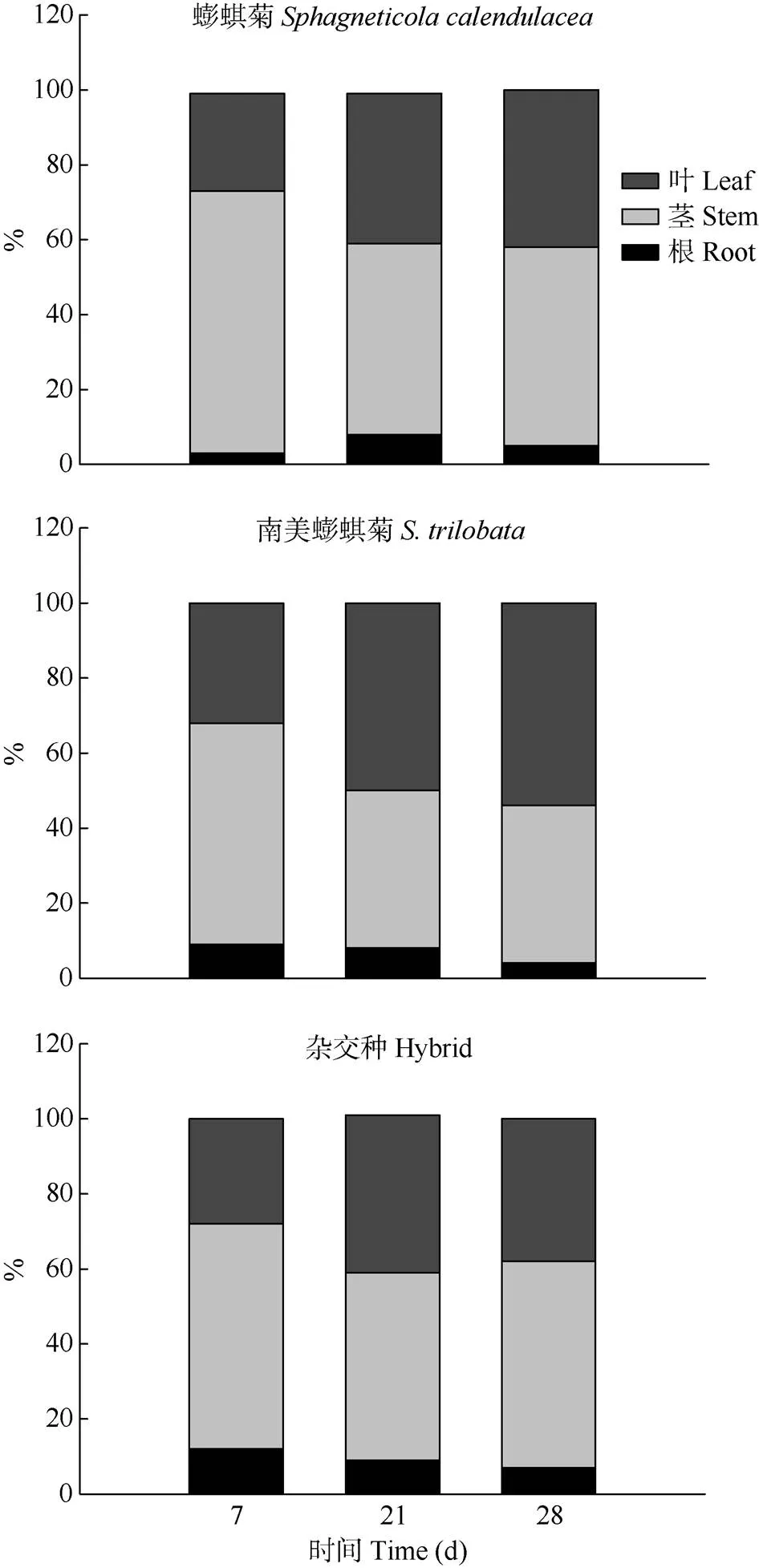
图3 根、茎、叶中镉含量所占比例
2.3 镉在蟛蜞菊体内的移动性
总体来看,镉在叶中的分布模式没有发生显著改变(图4)。镉含量越大的叶位,黄化现象越明显,镉在叶中的分布模式与表型相符合(图2)。恢复培养后,3种植物新叶片(第6片叶)中镉含量均极低,蟛蜞菊老叶(第1片叶)和幼叶(第5片叶)中镉含量显著提高,而成熟叶(第2~4片叶)中镉含量无显著变化;南美蟛蜞菊各叶位的叶片中镉含量没有显著变化;而杂交种第4和5片叶中镉含量显著提高,且第4片(成熟叶)比第5片叶(幼叶)增加幅度更大, 这说明3种植物从胁迫生长到恢复生长,根部所积累的镉不断地往地上部分转移(图5)。恢复生长后,蟛蜞菊的幼叶和老叶中的镉含量高于成熟叶,南美蟛蜞菊所有叶位的叶片镉含量没有显著变化,杂交种则是除新展开的叶片,叶龄越小,镉含量就越大。
恢复培养7 d后,3种植物根中的镉含量均显著下降(图5),说明根部积累的镉可能由根部运输至地上部分, 其中,杂交种根中镉含量下降幅度最大(50.4%),蟛蜞菊和南美蟛蜞菊分别下降了35.8%和33.7%。由此可见,杂交种将镉往地上部分转运的能力更强,从而可以较大限度降低镉对根部的损伤。

图4 恢复生长后不同叶位镉含量的变化。n=5。柱上不同字母表示差异显著(P<0.05, Duncan’s检验)。
2.4 镉在叶片中的分布
镉胁迫21 d时3种植物叶片中镉含量没有显著差异(表2),因此选择此时的叶片研究镉的分布特性。结果表明,3种植物叶片镉分布具有相同的变化趋势,从叶脉、叶脉间隙到叶片边缘镉含量逐渐减少。蟛蜞菊的镉含量从叶脉到叶脉间隙和从叶脉间隙到叶片边缘分别下降了26%和79%,南美蟛蜞菊下降了79%和59%,杂交种下降了2%和62%。镉在叶片中的移动性越强,其含量下降就越小。因此,镉在叶中的移动性依次为杂交种>蟛蜞菊>南美蟛蜞菊。南美蟛蜞菊叶脉的镉含量最高,分别比蟛蜞菊和杂交种高2和2.5倍,蟛蜞菊和杂交种之间没有显著差异。这与镉胁迫下南美蟛蜞菊叶脉处受损最严重的表型相吻合,说明南美蟛蜞菊受到镉的毒害作用最强,出现了褐色的坏死斑(图2)。

表2 叶片不同部位的镉含量
=5。同列数据后不同字母表示差异显著(<0.05, Duncan’s 检验)。
=5. Data followed different letters indicate significant differences at 0.05 level by Duncan’s test.
2.5 镉胁迫对其他金属元素吸收的影响
从表3可见,镉胁迫下Na、K、Ca、Mn、Fe、Zn、Cu等矿质元素含量在3种植物中均出现不同程度的波动,其中,Ca2+含量在胁迫后均出现下降。
3 结论和讨论
对于植物来说,镉是一种非必需重金属元素, 具有较高的毒性与移动性[7]。根是植物吸收水分和营养物质的器官,直接与土壤接触,植物通过根部吸收外界营养元素,同时也会吸收共存的重金属元素[26]。根部所吸收的重金属元素,通过共质体或质外体途径转移至木质部,而后通过维管柱转移至地上部分,通过韧皮部在茎、叶、籽实中进行分配[6]。本文研究了重金属镉在同科同属的3种植物中的分布和移动特征,镉胁迫过程中3种植物根部的镉含量始终高于茎和叶,胁迫第28天叶片中的镉含量与茎相近,说明重金属镉首先被根部吸收,通过茎向上运输并向叶片积累。镉在植物不同器官中的积累情况因植物种类、品种而异,一般来说,大部分的镉积累在根中,少部分被转移至地上部分,呈现根>茎>叶>籽实,而超富集植物地上部分的重金属含量通常高于地下部分[27]。水培条件下的大豆()吸收的92%镉滞留在根部,叶片中的镉含量是茎的1/10[28]。用同样方法处理蓖麻()的2个品种、菜豆()和玉米(),根、茎、叶中的镉含量依次下降[29–30]。镉滞留根部可能是镉离子与根部皮层细胞的蛋白质和多糖类等物质结合形成稳定的大分子化合物,进而减少镉离子对地上部分的毒害作用[31]。随胁迫时间的延长,茎和叶的镉含量都呈上升的趋势,其中杂交种茎部镉含量相对较高,根部则呈先升后降的趋势,这可能与根长时间受镉胁迫出现烂根有关,其中杂交种的变化幅度较小,这说明杂交种在28 d的镉胁迫中,根部能保持较为良好的生长状况,具有较高的向地上运输镉的能力。从根、茎、叶镉含量所占比例来看,3种植物受到镉胁迫时, 根部能将吸收的外界镉离子向地上部分转移。

图5 根部的镉含量变化。n=5。1: 蟛蜞菊; 2: 南美蟛蜞菊; 3: 杂交种。柱上不同字母表示差异显著(P<0.05, Duncan’s检验)。
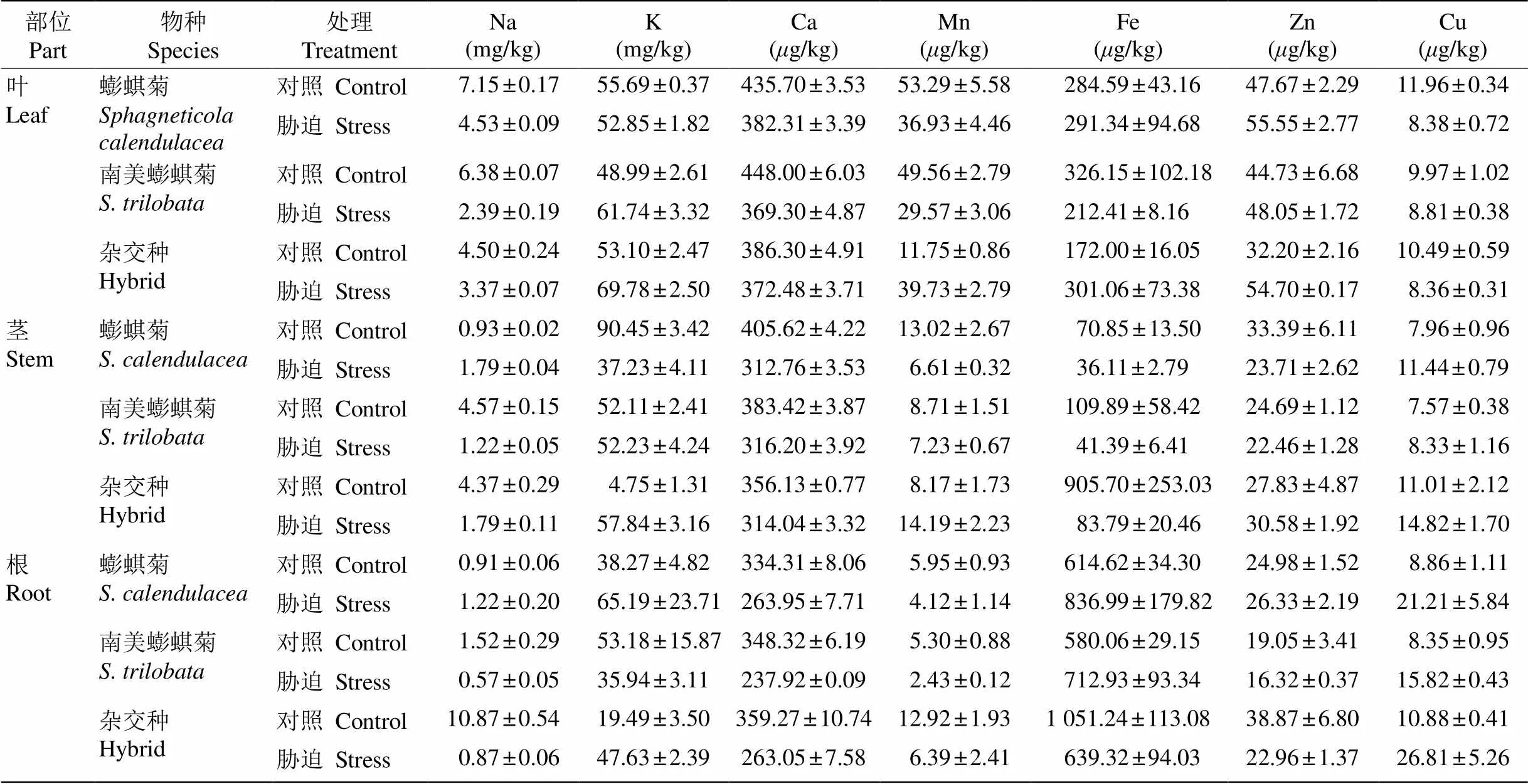
表3 镉胁迫对金属元素含量的影响
恢复培养7 d后,3种植物的根部镉含量出现下降,以杂交种的下降幅度最大,进一步说明杂交种向上运输镉的能力较强。恢复培养7 d,蟛蜞菊和杂交种各叶位的镉含量均有上升,这可能与胁迫时储存在根部和茎部中的镉转移至叶片有关。蟛蜞菊偏向于将镉积累在老叶和幼叶中,南美蟛蜞菊偏向于各个叶位均匀积累,而杂交种更偏向积累于幼叶和成熟叶中。镉在不同植物中有不同的分布模式,与木质部的向上运输和韧皮部的再分配2个过程密切相关。镉超富集植物龙葵()具有较强的地上部运输能力并积累在老叶和子叶中,镉在地上部分进行再分配的能力较弱[32],而镉在非超富集植物体中的分布情况与其有所不同,如白羽扇豆()将绝大部分的镉滞留在根部,地上部分较少积累[26]。在非超富集植物小麦()中镉通过木质部往地上部运输以及通过韧皮部在不同叶位进行再分配的能力较其它重金属元素弱[33]。植物将重金属元素积累在老叶中会大大降低植物提取效率,因为重金属会随着老叶的脱落重新回归土壤[13]。镉在3种植物中具有不同的分布模式,且3种植物对镉具有不同的运输能力,表明他们之间存在不同的转运机制,这有待于今后进一步研究。南美蟛蜞菊将大量的镉积累在叶脉处,有利于减少镉对代谢活跃部位的抑制,这与南美蟛蜞菊叶脉处有褐色坏死斑的表型一致。镉在叶片中的分布模式对其代谢过程如光合作用有密切联系,在叶片特定部位的镉含量与该部位的光合能力呈负相关。Pietrini等报道镉主要积累在叶脉,可以减少镉对叶片其余部位光合能力的抑制[34],而在超富集植物天蓝遏蓝菜()中, 镉主要积累在叶片的边缘[35]。
植物正常的生长发育需要各种矿质元素,是植物体的组成成分且具有调节生理功能的作用,主要是通过根部吸收,进而通过木质部和韧皮部在地上部分分布与再分配[36]。镉对于植物来说是一种非必需元素,但在化学性质上与Zn、Fe、Ca、Mn等矿质元素相似,通过与这些矿质元素竞争转运蛋白进入到植物体中[37–39]。不仅矿质元素间在植物中的吸收、分布等过程具有竞争作用,许多重金属元素与矿质元素同样也存在类似的竞争作用,表现在植物对重金属元素的吸收会抑制其他矿质元素的吸收与利用[40]。本研究表明,重金属镉显著影响了植物对Na、K、Ca、Mn、Fe、Zn和Cu等的吸收和积累,其中Ca含量在3种植物的根、茎、叶中都下降。有研究表明,植物对Cd和Ca的吸收与积累存在竞争关系[37,39],也有一些研究表明两者存在协同关系[41], 这可能与植物种类和器官不同有关。本研究表明, Cd和Ca在3种植物的根、茎、叶中具有竞争关系,这可能与镉进入植物体利用了钙的通道有关。镉胁迫下Ca2+通道抑制剂(LaCl3)使空心菜()和紫苋菜()对镉的吸收受到显著抑制[42–43]。
目前,修复受到重金属污染的土壤已有较多实用技术方法,其中植物修复技术因其成本低、修复效率较高而受到广泛关注。植物提取技术(植物修复中的一种)是利用植物对重金属的吸收,并将其转运至可收割部位的一种原地生物修复技术[11]。重金属积累在植物的具体部位与植物修复效率以及实际修复过程中方案的制定(例如收割植物体哪个部位以及收割时间)密切相关[12–13]。结合我们前期的研究,杂交种对重金属镉胁迫(200mol/L)的抗性上具有超亲优势[44],以及对镉具有较强的吸收和向上转运能力,偏向于将镉积累于第2~3叶位的叶片中,这说明杂交种在未来的植物修复中具有较高的应用潜力。将杂交种应用于修复受到重金属污染的土壤,仍需要进一步在野外实地调查与研究。
[1] ZHAO F J, MA Y B, ZHU Y G, et al. Soil contamination in China: Current status and mitigation strategies [J]. Environ Sci Technol, 2015, 49(2): 750–759. doi: 10.1021/es5047099.
[2] YUAN M, HE H D, XIAO L, et al. Enhancement of Cd phyto- extraction by twospecies with endophyticsp. JN27 [J]. Chemosphere, 2014, 103: 99–104. doi: 10.1016/j.chemosphere. 2013.11.040.
[3] YANG Y, GE Y C, ZENG H Y, et al. Phytoextraction of cadmium- contaminated soil and potential of regenerated tobacco biomass for recovery of cadmium [J]. Sci Rep, 2017, 7(1): 7210. doi: 10.1038/ s41598-017-05834-8.
[4] HASAN S A, FARIDUDDIN Q, ALI B, et al. Cadmium: Toxicity and tolerance in plants [J]. J Environ Biol, 2009, 30(2): 165–174. doi: 10. 1016/C2017-0-02050-5.
[5] TANG Y T, DENG T H B, WU Q H, et al. Designing cropping systems for metal-contaminated sites: A review [J]. Pedosphere, 2012, 22(4): 470–488. doi: 10.1016/S1002-0160(12)60032-0.
[6] SONG Y, JIN L, WANG X J. Cadmium absorption and transportation pathways in plants [J]. Int J Phytoremed, 2017, 19(2): 133–141. doi: 10. 1080/15226514.2016.1207598.
[7] DAS P, SAMANTARAY S, ROUT G R. Studies on cadmium toxicity in plants: A review [J]. Environ Pollut, 1997, 98(1): 29–36. doi: 10. 1016/S0269-7491(97)00110-3.
[8] DALCORSO G, FARINATI S, MAISTRI S, et al. How plants cope with cadmium: Staking all on metabolism and gene expression [J]. J Integr Plant Biol, 2008, 50(10): 1268–1280. doi: 10.1111/j.1744-7909. 2008.00737.x.
[9] BENAVIDES M P, GALLEGO S M, TOMARO M L. Cadmium toxi- city in plants [J]. Braz J Plant Physiol, 2005, 17(1): 21–34. doi: 10.1590/ S1677-04202005000100003.
[10] GARBISU C, ALKORTA I. Phytoextraction: A cost-effective plant- based technology for the removal of metals from the environment [J]. Bioresour Technol, 2001, 77(3): 229–236. doi: 10.1016/S0960-8524 (00)00108-5.
[11] MARQUES A P G C, RANGEL A O S S, CASTRO P M L. Reme- diation of heavy metal contaminated soils: Phytoremediation as a potentially promising clean-up technology [J]. Crit Rev Environ Sci Technol, 2009, 39(8): 622–654. doi: 10.1080/10643380701798272.
[12] HU Y, TIAN S K, FOYER C H, et al. Efficient phloem transport signi- ficantly remobilizes cadmium from old to young organs in a hyper- accumulator[J]. J Hazard Mater, 2019, 365: 421–429. doi: 10.1016/j.jhazmat.2018.11.034.
[13] FELLER U, ANDERS I, WEI S H. Distribution and redistribution of109Cd and65Zn in the heavy metal hyperaccumulatorL.: Influence of cadmium and zinc concentrations in the root medium [J]. Plants, 2019, 8(9): 340. doi: 10.3390/plants8090340.
[14] ELLSTRAND N C. Evolution of invasiveness in plants following hybridization [J]. Biol Invasions, 2009, 11(5): 1089–1091. doi: 10.1007/ s10530-008-9389-9.
[15] ELLSTRAND N C, SCHIERENBECK K A. Hybridization as a stimulusfor the evolution of invasiveness in plants? [J]. Proc Natl Acad Sci USA, 2000, 97(13): 7043–7050. doi: 10.1073/pnas.97.13.7043.
[16] LOWE S, BROWNE M, BOUDJELAS S, et al. 100 of the world’s worst invasive alien species: A selection from the global invasive species database [R]. Auckland: Invasive Species Specialist Group, 2000.
[17] WU Y Q, HU Y J, LIAO F L.: A species from introduced to potential invasive [J]. Guihaia, 2005(5): 413–418.
吴彦琼, 胡玉佳, 廖富林. 从引进到潜在入侵的植物——南美蟛蜞菊 [J]. 广西植物, 2005(5): 413–418.
[18] WU W, ZHOU R C, NI G Y, et al. Is a new invasive herb emerging? Molecular confirmation and preliminary evaluation of natural hybridi- zation between the invasive(Asteraceae) and its native congenerin South China [J]. Biol Invasions, 2013, 15(1): 75–88. doi: 10.1007/s10530-012-0269-y.
[19] NI G Y, ZHAO P, WU W, et al. A hybrid of the invasive planthas similar competitive ability but different response to nitrogen deposition compared to parent [J]. Ecol Res, 2014, 29(2): 331–339. doi: 10.1007/s11284-014-1130-9.
[20] SUN Z Y, CHEN Y Q, SCHAEFER V, et al. Responses of the hybrid betweenandto low temperature and weak light characteristic in south China [J]. Sci Rep, 2015, 5(1): 16906. doi: 10.1038/srep16906.
[21] PERNIA B, CALABOKIS M, NORIS K, et al. Effects of cadmium in plants of(L.) Pruski [J]. Bioagro, 2019, 31(2): 133–142.
[22] ZHU J L, XU Z F, CAO H L, et al. Effect of cadmium on photo- synthetic traits in[J]. Ecol Environ, 2008, 17(2): 657–660. doi: 10.16258/j.cnki.1674-5906.2008.02.039.
朱建玲, 徐志防, 曹洪麟, 等. 镉对南美蟛蜞菊光合特性的影响[J]. 生态环境, 2008, 17(2): 657–660. doi: 10.16258/j.cnki.1674-5906.2008. 02.039.
[23] LIN M Z, LIN N W, QIU X F, et al. Wedelia trilobata’s response to heavy metals and heavy metal absorption and enrichment in its body with sludge as a part of growth substrate [J]. J Anhui Agric Univ, 2012, 39(2): 286–291. doi: 10.13610/j.cnki.1672-352x.2012.02.002.
林茂兹, 林能文, 邱雪芬, 等. 蟛蜞菊对污泥重金属的响应、吸收与富集作用[J]. 安徽农业大学学报, 2012, 39(2): 286–291. doi: 10. 13610/j.cnki.1672-352x.2012.02.002.
[24] XIAO N C, ZHANG Y X, SONG B, et al. Enrichment characteristics and application potential of dominant plants for heavy metals in typical cadmium-rich lead-zinc mining areas of Guangdong [J]. Environ Pollut Control, 2021, 43(3): 343–347. doi: 10.15985/j.cnki.1001-3865.2021. 03.014.
肖乃川, 张云霞, 宋波, 等. 广东省典型富镉铅锌矿区中优势植物重金属富集特性与应用潜力[J]. 环境污染与防治, 2021, 43(3): 343–347. doi: 10.15985/j.cnki.1001-3865.2021.03.014.
[25] LU R R, HU Z H, ZHANG Q L, et al. The effect ofon the plant growth, Cd translocation and accumulation in the new Cd-hyperaccumulator[J]. Ecotox Environ Safe, 2020, 203: 110988. doi: 10.1016/j.ecoenv.2020.110988.
[26] PAGE V, WEISSKOPF L, FELLER U. Heavy metals in white lupin: Uptake, root-to-shoot transfer and redistribution within the plant [J]. New Phytol, 2006, 171(2): 329–341. doi: 10.1111/j.1469-8137.2006. 01756.x.
[27] ZHANG Y X, YU F, ZHANG Y Y, et al. Uptake, translocation and accumulation of cadmium in plant [J]. Chin J Ecol Agric, 2008, 16(5): 1317–1321.
张玉秀, 于飞, 张媛雅, 等. 植物对重金属镉的吸收转运和累积机制[J]. 中国生态农业学报, 2008, 16(5): 1317–1321.
[28] CATALDO D A, GARLAND T R, WILDUNG R E. Cadmium distri- bution and chemical fate in soybean plants [J]. Plant Physiol, 1981, 68 (4): 835–839. doi: 10.1104/pp.68.4.835.
[29] YE W L, GUO G F, WU F, et al. Absorption, translocation, and detoxification of Cd in two different castor bean (L.) cultivars [J]. Environ Sci Pollut Res, 2018, 25(29): 28899–28906. doi: 10.1007/s11356-018-2915-0.
[30] GUO Y, MARSCHNER H. Uptake, distribution, and binding of cadmium and nickel in different plant species [J]. J Plant Nutri, 1995, 18(12): 2691–2706. doi: 10.1080/01904169509365094.
[31] ZHANG J B, HUANG W N. Advances on physiological and ecological effects of cadmium on plants [J]. Acta Ecol Sin, 2000, 20(3): 514–523. doi: 10.3321/j.issn:1000-0933.2000.03.030.
张金彪, 黄维南. 镉对植物的生理生态效应的研究进展 [J]. 生态学报, 2000, 20(3): 514–523. doi: 10.3321/j.issn:1000-0933.2000.03.030.
[32] WEI S H, ANDERS I, FELLER U. Selective uptake, distribution, and redistribution of109Cd,57Co,65Zn,63Ni, and134Csxylem and phloem in the heavy metal hyperaccumulatorL. [J]. Environ Sci Pollut Res, 2014, 21(12): 7624–7630. doi: 10.1007/s11356- 014-2636-y.
[33] PAGE V, FELLER U. Selective transport of zinc, manganese, nickel, cobalt and cadmium in the root system and transfer to the leaves in young wheat plants [J]. Ann Bot, 2005, 96(3): 425–434. doi: 10.1093/ aob/mci189.
[34] PIETRINI F, ZACCHINI M, IORI V, et al. Spatial distribution of cadmium in leaves and its impact on photosynthesis: Examples of different strategies in willow and poplar clones [J]. Plant Biol, 2010, 12 (2): 355–363. doi: 10.1111/j.1438-8677.2009.00258.x.
[35] COSIO C, DESANTIS L, FREY B, et al. Distribution of cadmium in leaves of[J]. J Exp Bot, 2005, 56(412): 765–775. doi: 10.1093/jxb/eri062.
[36] PAN R C. Plant Physiology [M]. 7th ed. Beijing: Higher Education Press, 2012: 32–64.
潘瑞炽. 植物生理学[M]. 第7版. 北京: 高等教育出版社, 2012: 32–64.
[37] PERFUS-BARBEOCH L, LEONHARDT N, VAVASSEUR A, et al. Heavy metal toxicity: Cadmium permeates through calcium channels and disturbs the plant water status [J]. Plant J, 2002, 32(4): 539–548. doi: 10.1046/j.1365-313X.2002.01442.x.
[38] LLAMAS A, ULLRICH C I, SANZ A. Cd2+effects on transmembrane electrical potential difference, respiration and membrane permeability of rice (L) roots [J]. Plant Soil, 2000, 219(1–2): 21–28. doi: 10.1023/A:1004753521646.
[39] TIAN S K, XIE R H, WANG H X, et al. Calcium deficiency triggers phloem remobilization of cadmium in a hyperaccumulating species [J]. Plant Physiol, 2016, 172(4): 2300–2313. doi: 10.1104/pp.16.01348.
[40] KRUPA Z, SIEDLECKA A, SKORZYNSKA-POLIT E, et al. Heavy metal interactions with plant nutrients [M]// PRASAD M N V, STRZAŁKA K. Physiology and Biochemistry of Metal Toxicity and Tolerance in Plants. Dordrecht: Springer, 2002: 287–301. doi: 10.1007/ 978-94-017-2660-3_11.
[41] DECHAMPS C, ROOSENS N H, HOTTE C, et al. Growth and mineral element composition in two ecotypes ofon Cd contaminated soil [J]. Plant Soil, 2005, 273(1): 327–335. doi: 10.1007/s11104-005-0099-0.
[42] HE B Y, YU D P, CHEN Y, et al. Use of low-calcium cultivars to reduce cadmium uptake and accumulation in edible amaranth (L.) [J]. Chemosphere, 2017, 171: 588–594. doi: 10.1016/j.chemosphere.2016.12.085.
[43] HE B Y, LING L, ZHANG L Y, et al. Cultivar-specific differences in heavy metal (Cd, Cr, Cu, Pb, and Zn) concentrations in water spinach (‘Forsk’) grown on metal-contaminated soil [J]. Plant Soil, 2015, 386(1): 251–262. doi: 10.1007/s11104-014-2257-8.
[44] ZHANG Q L, CHEN G X, SHAO L, et al. The hybridization between(L.) Pruski and(L.) Pruski improved the tolerance of hybrid to cadmium stress [J]. Chemosphere, 2020, 249: 126540. doi: 10.1016/j.chemosphere.2020. 126540.
Migration and Distribution Characteristics of Cadmium in,and Their Hybrid
HUANG Jundong1, KE Weiqian1, CHEN Guangxin1, GU Xiaoqian1, ZHANG Qilei1,2*, PENG Changlian1*
(1. Guangdong Key Laboratory of Biotechnology for Plant Development, School of Life Science,South China Normal University,Guangzhou 510631, China; 2. Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China)
In order to understand themigration and absorption characteristics of cadmium,the differences in absorption, migration and distribution of cadmium were studied in(indigenous congener),(alien invasive species) and their hybrid treated with Hoagland solution containing 200mol/L CdCl2. The results showed that the cadmium concentrations in stems and leaves of three species gradually increased with the time extension of cadmium treatment, and the cadmium concentrations in leaves gradually matched that in stems, while that in roots of three species was always the highest. For the whole plant, cadmium concentration of the hybrid was also the highest under stress. After recovery growth, the cadmium concentrations in roots of hybrid,, anddeclined by 50.4%, 35.8%, and 33.7%, respectively. Distribution pattern of cadmium in leaves of three species had not significant change treated with/without CdCl2. The hybrid tended to accumulate cadmium in young and mature leaves. The cadmium concentrations gradually decreased from vein, internal vein and leaf edge of three species, which in internal vein ofwas the highest (2 766.3g/kg). Therefore, the hybrid displayed stronger ability to absorb, transport and transfer cadmium than its parents, suggesting that it had greater potential in phytoremediation in the future.
Cadmium;; Hybrid; Phytoremediation; Heavy metal
10.11926/jtsb.4448
2021-05-14
2021-07-28
国家自然科学基金项目(32171493, 31870374)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 32171493, 31870374).
黄骏东,男,硕士,主要从事植物生理生态研究。E-mail: hjd201909ecology@126.com
. E-mail: dalei45666@163.com, pengchl@scib.ac.cn

