血管内皮间质样转分化遗传示踪小鼠模型的构建及其在肝纤维化研究中的应用
许 皓, 阮 柏,2, 历志文, 房志强, 王 琳, 窦科峰
1 空军军医大学西京医院 肝胆胰脾外科, 西安 710032;2 空军军医大学航空航天医学系 航空航天临床医学中心, 西安 710032
肝纤维化是各种慢性肝损伤的共同病理改变,也是慢性肝病发展到肝硬化的必经环节。其病理特征是肌纤维母细胞产生大量肝内细胞外基质(ECM),并过度沉积在纤维间隔和窦周间隙,导致正常肝小叶结构破坏和异常血管重建[1]。以往研究[2-3]普遍认为,活化的肝星状细胞(HSC)是纤维化肝脏中肌纤维母细胞的主要来源。
α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)是公认的间质样细胞标志物。近年来,研究者通过遗传示踪技术在实体器官纤维化模型中证明,一部分血管内皮细胞能够转分化为α-SMA+的肌纤维母细胞,进而产生ECM并参与各器官的纤维化进展[4-5]。肝脏组织特异性的血管内皮——肝血窦内皮细胞(liver sinusoidal endothelial cell,LSEC)在肝损伤病理条件下也会发生内皮间质样转分化,即由内皮细胞向间质样细胞特征转变。在此过程中,LSEC不仅表达间质样细胞标志物,同时也会产生ECM并参与肝脏血窦区的胶原沉积和纤维化形成[6]。
tdTomato荧光蛋白(tandem-dimer tomato,tdTomato)和增强绿色荧光蛋白(enhanced green fluorescent protein,eGFP)作为稳定的荧光标记物,已广泛应用于转基因小鼠品系构建和细胞标记实验。利用荧光蛋白标记α-SMA,可特异性反映细胞发生间质样转分化的情况。同时,利用Cre/Loxp系统介导的他莫昔芬可诱导条件性基因敲除技术,Cre重组酶可在成体细胞中特异性识别两个Loxp位点间的序列,发生特异性基因片段删除的“剪切效应”,实现特定种类细胞的靶基因敲除[7-8]。本研究设计构建了一种Acta2-Knockin(KI)荧光示踪基因敲入小鼠,该基因全长包含9个外显子(图1),构建策略是在第2个外显子的下游内含子区插入Loxp-tdTomato-STOP-Loxp-eGFP片段。再与内皮特异性Cdh5-CreERT工具鼠进行杂交,最终构建出Cdh5-CreERT/Acta2-KI遗传示踪小鼠,当他莫昔芬诱导Cre重组酶激活时,成体小鼠血管内皮细胞中tdTomato和STOP终止子序列将被Cre/Loxp系统切除,形成移码突变,此时若内皮细胞表达Acta2,则会翻译表达eGFP。
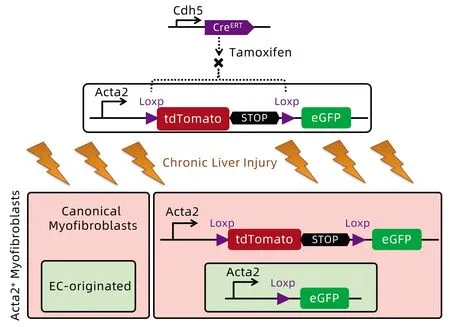
图1 Cdh5-CreERT/Acta2小鼠的构建策略与作用机制Figure 1 Establishing strategy and mechanism of Cdh5-CreERT/Acta2 mice
1 材料与方法
1.1 主要试剂 ECM培养基套装(Sciencell:1001)、CCl4(天津富宇:04519)、橄榄油(国药集团:69018028)、他莫昔芬(Sigma:T5648)、玉米油(Sigma:C8267)、鼠尾直接PCR试剂盒(成都福际:TP-01331)、OCT包埋剂(Sakura:4583)、免疫荧光封闭液(碧云天:P0260)、免疫染色一抗/二抗稀释液(碧云天:P0262/P0265)、Hoechst33342(Thermo:H3570)、兔源性RFP抗体(Abcam:ab62341)、小鼠源性eGFP抗体(Abcam:ab6673)、驴抗兔荧光二抗(Invitrogen:A-21206)、驴抗小鼠荧光二抗(Invitrogen:A-21202)等。
1.2 示踪小鼠的构建与繁育 本实验所用遗传示踪小鼠的构建策略如图1所示。利用CRISPR-Cas9基因编辑技术,构建基于Acta2基因的Loxp-tdTomato-STOP-Loxp-eGFP基因敲入(Acta2-KI)小鼠,并与本实验室繁育的Cdh5-CreERT工具鼠杂交。选取Cdh5-CreERT+且Acta2-KI杂合或纯合小鼠作为目标示踪Cdh5-CreERT/Acta2-KI小鼠进行后续实验分析。实验用小鼠均在SPF级动物实验室内饲养[实验动物生产许可证号:SCXK(军)-2017-0021,实验动物使用许可证号:SYXK(军)-2017-0044],每天光照12 h,温度20 ℃~25 ℃,湿度50%~60%。
1.3 小鼠基因组DNA提取与基因型鉴定 小鼠基因组DNA的提取按鼠尾直接PCR试剂盒说明书进行。分别剪取子代小鼠尾尖约0.5 cm于离心管中,每管加入4 μL Foregene Protease Plus和100 μL Buffer MP,涡旋混匀。65 ℃金属浴孵育30 min后,95 ℃孵育5 min。12000 r/min离心5 min,取上清至新的离心管中。
将提取的Cdh5-CreERT/Acta2-KI小鼠基因组DNA进行PCR扩增并鉴定其基因型,PCR引物见表1。PCR反应20 μL体系包括:基因组DNA模板2 μL,上、下游引物(10 nmol/L)各0.5 μL,2×Taq MasterMix(Dye)10 μL,ddH2O 7 μL。反应条件:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃终延伸2 min。取10 μL PCR终产物进行1.5%琼脂糖核酸凝胶电泳。后置于凝胶电泳仪中成像并分析。

表1 PCR扩增引物Table 1 PCR amplification primer
1.4 他莫昔芬诱导方案与肝纤维化模型建立 经PCR基因型鉴定,得到Cdh5-CreERT/Acta2-KI小鼠,待小鼠6~8周龄时,开始他莫昔芬诱导。用玉米油配制他莫昔芬终浓度为20 μg/μL,按100 μL/只剂量,腹腔注射连续5 d(1次/d),共5次,诱导Cre重组酶激活。再静置1周后,用橄榄油配制15%CCl4,按4 μL/g体质量剂量,腹腔注射连续6周(2次/周),共12次,诱导小鼠形成肝纤维化病变,完成后取材。
1.5 小鼠肝脏组织处理 腹腔注射1%戊巴比妥钠麻醉小鼠,20 mL生理盐水灌注左心室,同时剪开右心耳,剥离肝脏,剪取部分肝叶,4%多聚甲醛固定30 min,30%蔗糖PBS溶液4 ℃过夜脱水,次日以OCT包埋,-80 ℃冻存小鼠肝脏组织包埋块,于冰冻切片机上切片,片厚8 μm。
1.6 小鼠原代LSEC分离与培养 参考本实验室既往研究[9]报道的实验方法分离小鼠原代LSEC。采用胶原酶两步灌注法对小鼠肝脏进行消化,组织处理器匀浆消化,筛网过滤,反复50×g低速离心去除细胞悬液中的肝细胞,获得的细胞悬液用400×g离心7 min收集细胞沉淀,通过OptiPrep密度梯度离心获取上层HSC,通过CD146免疫磁珠进一步分选获得LSEC。
将新鲜分离出的LSEC用ECM培养基(含胎牛血清、双抗)重悬,接种于铺好细胞爬片的24孔板中,37 ℃ 5%CO2培养箱恒温培养,4~5 h后倒置显微镜下观察细胞是否贴壁,对贴壁后的细胞换液,此后每2 d换液1次,7 d后镜下观察。待LSEC发生间质样转分化后,用1×PBS缓冲液洗5 min,4%多聚甲醛固定15 min后染色观察。
1.7 免疫荧光染色 小鼠肝脏组织冰冻切片上滴加免疫荧光染色封闭液,于湿盒内室温封闭1 h,将稀释后的抗RFP和GFP一抗(稀释比1∶200)滴加在组织上,湿盒4 ℃过夜;次日,用对应稀释后荧光二抗(稀释比1∶300)室温避光染色2 h,Hoechst33342染核10 min,50%缓冲甘油封片,4 ℃保存。原代LSEC细胞爬片的免疫荧光染色步骤,类同此法。用激光共聚焦显微镜分别观察组织、细胞样本中荧光蛋白tdTomato(红色)和eGFP(绿色)的表达。
2 结果
2.1 小鼠基因型鉴定结果 小鼠基因型检测结果显示:Cdh5-CreERT、Acta2-KI突变型、Acta2-KI野生型小鼠PCR分别扩增出900 bp、1663 bp、301 bp的目的条带,综合三种琼脂糖核酸凝胶电泳分析结果,即可鉴定小鼠基因型。2、4号(扩增出900 bp、1663 bp、301 bp条带)为Cdh5-CreERT+/Acta2-KI+/-杂合小鼠,5号(扩增出900 bp、1663 bp条带)为Cdh5-CreERT+/Acta2-KI+/+纯合小鼠,3、7、8号(扩增出900 bp、301 bp条带)为Cdh5-CreERT+/Acta2-KI-野生型小鼠(图2)。
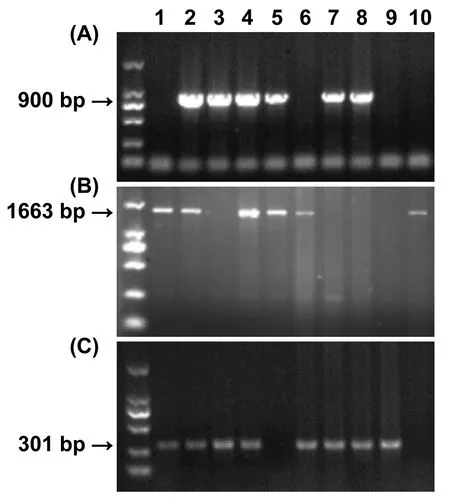
注:(A)为 Cdh5-CreERT条带;(B) 为Acta2-KI突变型条带; (C) 为Acta2-KI野生型条带。
2.2 体外转分化模型中荧光示踪 研究表明,体外培养的HSC会发生细胞形变,随着培养天数增加逐步趋向肌纤维母细胞的特性。为从细胞水平阐明LSEC向肌纤维母细胞样细胞转分化的能力,取健康7~9周龄未经他莫昔芬诱导、诱导完成后的Cdh5-CreERT/Acta2-KI小鼠,分离原代LSEC和HSC,在体外培养,用倒置显微镜观察其培养不同天数后的形态变化。发现3 d时,部分LSEC已由最初的卵圆形变为长梭形,继续延长培养时间,细胞体积变大,细胞边缘向周围伸展生成较多伪足,7 d时外形特征已近似肌纤维母细胞,提示LSEC在体外培养过程中发生内皮间质样转分化。在体外培养7 d后,进行免疫荧光染色,结果显示(图3):(1)免疫染色阴性对照组,LSEC无显著的红色

图3 体外培养7 d后LSEC和HSC的免疫荧光染色Figure 3 Immunofluorescent staining of LSEC and HSC after 7 d culture in vitro
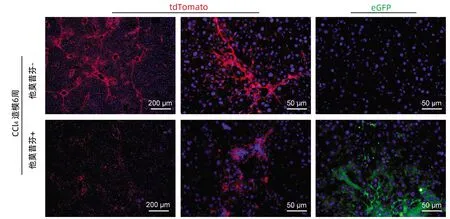
图4 CCl4诱导肝纤维化模型肝脏组织免疫荧光染色Figure 4 Immunofluorescent staining of liver tissue for CCl4 induced fibrotic model
荧光(tdTomato)和绿色荧光(eGFP),HSC经活化后产生较显著的红色荧光;(2)未经他莫昔芬诱导组经免疫染色后,LSEC和HSC均表达红色荧光;(3)他莫昔芬诱导组经免疫染色后,LSEC出现明显的绿色荧光,说明Cre/LoxP系统在他莫昔芬的诱导下产生了“基因剪切”效应,表达出eGFP,即LSEC转分化为肌纤维母细胞样细胞。
2.3 肝纤维化模型的荧光示踪 为进一步验证该遗传示踪小鼠的可靠性,分别选取7~9周龄未经他莫昔芬诱导和诱导完成后的Cdh5-CreERT/Acta2-KI小鼠,同时用CCl4造模6周,取肝脏组织制作冰冻切片,对LSEC进行免疫荧光染色。结果显示(图4):未诱导组肝脏切片可见明显的红色荧光,但未出现绿色荧光;而经他莫昔芬诱导组除了红色荧光,同时可见部分区域表达绿色荧光。这说明在肝纤维化过程中,部分LSEC确实发生了内皮间质样转分化。
3 讨论
几乎各种慢性肝病的诱因均可引起肝纤维化。多种损伤因素刺激下,肝脏产生慢性炎症并反复发作,经过长期的自我修复,最终限制正常的肝再生,增加肝功能衰竭的风险,逐渐形成难以恢复的肝硬化[10]。从细胞层面来看,肝纤维化过程中,除肝细胞变形、凋亡甚至坏死,各类炎症细胞的浸润和炎症因子的刺激外,肝内多种被激活的非实质细胞均有可能转化为肌纤维母细胞,产生ECM并在肝脏中大量沉积[1,11]。及时逆转早期形成的纤维化,是近几十年来公认的能够有效阻止肝硬化发生的治疗策略[12]。
以往研究普遍认为活化的HSC是转化为肌纤维母细胞的主要来源细胞。近年研究发现,内皮间质样转分化广泛存在于心[13]、肾[14]、肺[15]等器官的纤维化过程中。研究者[4-5]通过遗传示踪技术发现部分血管内皮细胞在纤维化中可转分化为肌纤维母细胞并参与器官的纤维化进展。前期研究表明,无论在体内外,LSEC均能够发生内皮间质样转分化并分泌胶原且表达间质样标志物(如α-SMA等),证实了部分LSEC在纤维化条件下能够获得间质样特征[6]。但之前的研究仍缺乏较准确的遗传学示踪证据。
本研究建立的Cdh5-CreERT/Acta2-KI遗传示踪模型小鼠,利用内皮特异性Cre/Loxp重组酶系统和CRISPR-Cas9基因编辑技术,实现了对内皮间质样转分化LSEC的特异性荧光标记。经他莫昔芬诱导,Cre重组酶被激活,进入细胞核内与Acta2基因的Loxp-tdTomato-STOP-Loxp位点结合,使由LSEC转分化而来的肌纤维母细胞表达绿色荧光蛋白(eGFP)。而其他来源的肌纤维母细胞因不能激活内皮特异性的Cdh5-CreERT发挥“剪切效应”,故翻译tdTomato后在STOP终止子处停止,因此仅表达红色荧光蛋白(tdTomato)。综上,可达到对LSEC来源肌纤维母细胞特异性示踪的目的。
在此基础上,本研究通过原代LSEC体外培养诱导间质样转分化、小鼠CCl4诱导肝纤维化模型验证了Acta2-KI所插入荧光片段的可示踪性,证实了Cdh5-CreERT/Acta2-KI遗传示踪小鼠的有效性、可靠性。进一步阐明了肝纤维化过程中肌纤维母细胞的来源多样性,这将为慢性肝损伤的病理机制研究和抗纤维化治疗提供新的理论依据。
伦理学声明:动物实验操作符合空军军医大学西京医院伦理委员会标准,伦理审批时间:2018年3月6日,批号:KY20183238-1。
利益冲突声明:本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:许皓、阮柏完成实验设计,分析数据,撰写文章;历志文、房志强协助实验操作和数据收集分析;王琳、窦科峰指导研究思路,修改文章并定稿。

