基线IgM水平对原发性胆汁性胆管炎治疗应答的预测价值
韩 琳, 梁庆升, 谢 欢, 陈 英, 赵 军, 张明月,2, 李保森, 董艳丽, 孙 颖,2
1 解放军总医院第五医学中心 肝病医学部, 北京 100039; 2 解放军医学院 研究生院, 北京 100039;3 牡丹江康安医院 肝脏肿瘤科, 黑龙江 牡丹江 157010
原发性胆汁性胆管炎(PBC)是一种慢性进行性的胆汁淤积性肝病,90%以上的患者血清抗线粒体抗体(AMA)阳性,部分患者血清IgM水平升高,随着病情的缓解而有所下降[1],因此明确IgM水平与PBC发生、发展及转归的关系,对于指导PBC治疗及预后评估具有重要的临床意义。
1 资料与方法
1.1 研究对象 选取2010年1月—2020年1月于解放军总医院第五医学中心就诊的熊去氧胆酸(UDCA)初治PBC患者637例,所有患者均具有治疗1年以上的临床数据。纳入标准:(1)符合PBC诊断标准[2-3];(2)UDCA规范治疗(13~15 mg/kg)1年以上。排除标准:(1)合并其他的慢性肝病;(2)肝移植术后;(3)合并其他免疫性疾病、恶性肿瘤及感染性疾病;(4)资料不完整。
1.2 研究方法 采用回顾性分析的方法,采集患者性别、年龄及入院基线的血液学指标、生化指标、免疫学指标及影像学指标;并根据巴黎标准进行UDCA疗效判定[4-5],将PBC患者分为UDCA完全应答组和UDCA应答不良组(包括无应答及部分应答)。
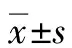
2 结果
2.1 一般情况 本研究共纳入PBC患者637例,其中男126例,女511例,平均56岁(50~66岁),基线IgM升高者357例(56.0%),UDCA完全应答者436例(68.4%),其他基线资料见表1。
2.2 UDCA不同疗效的基线临床资料比较 按照UDCA治疗应答情况,637例患者中436例发生完全应答,201例为应答不良。性别分布中,完全应答组与应答不良组分布无统计学意义(P值均>0.05),基线存在肝硬化的患者UDCA应答率更高(78.9% vs 71.1%,P=0.032),生化指标中,TBil、AST、ALP、TBA和TC在两组间存在统计学差异(P值均<0.001)。免疫指标中,应答不良组IgA、IgM水平及抗Gp210阳性率均较高(P值均<0.05)。预后风险评分中,应答不良组MRS、Globe评分、UK-PBC评分均高于完全应答组(P值均<0.001)(表2)。
2.3 不同IgM水平PBC患者临床特征及UDCA疗效比较
2.3.1 IgM升高与IgM正常PBC患者基线特征及治疗应答差异 按照IgM升高与IgM正常将PBC患者分为两组,分析患者基线特征及治疗应答。性别分布、年龄、肝硬化占比在两组中比较差异均无统计学意义(P值均>0.05);生化指标中,AST、ALP、TC在IgM升高组显著高于IgM正常组(P值均<0.001);免疫指标中,IgA、IgG水平及抗Gp210阳性率在IgM升高组显著高于IgM正常组(P值均<0.05),但两组在UDCA治疗应答方面并无统计学差异(P>0.05)(表3)。
2.3.2 应用ROC曲线确定IgM最佳临界值 将各项基线指标进行ROC曲线分析(图1,表4),结果显示预测UDCA治疗1年后应答不良的生化指标包括TBil、AST、ALP、TBA、TC,免疫指标包括IgA、IgM、IgG,计算IgM最佳临界值为1.5×ULN。
2.3.3 分析不同IgM水平PBC患者基线特征及治疗应答差异 根据IgM预测UDCA应答不良的最佳临界值将患者分为IgM≥1.5×ULN及IgM<1.5×ULN两组,性别分布、年龄、肝硬化占比在两组中比较差异均无统计学意义(P值均>0.05);IgM≥1.5×ULN组AST、ALP、TC显著高于IgM<1.5×ULN组(P值均<0.05);IgM≥1.5×ULN组IgG水平及抗Gp210阳性率显著高于IgM<1.5×ULN组(P值均<0.001)。IgM≥1.5×ULN组

表1 PBC患者基线特征及UDCA治疗1年后的应答情况
图1 PBC患者基线指标预测UDCA治疗1年后应答不良的ROC曲线

表2 UDCA治疗完全应答与应答不良患者基线指标及风险评分差异 Table 2 Differences of baseline characteristics and risk scores between PBC with complete response and poor response toUDCA treatment
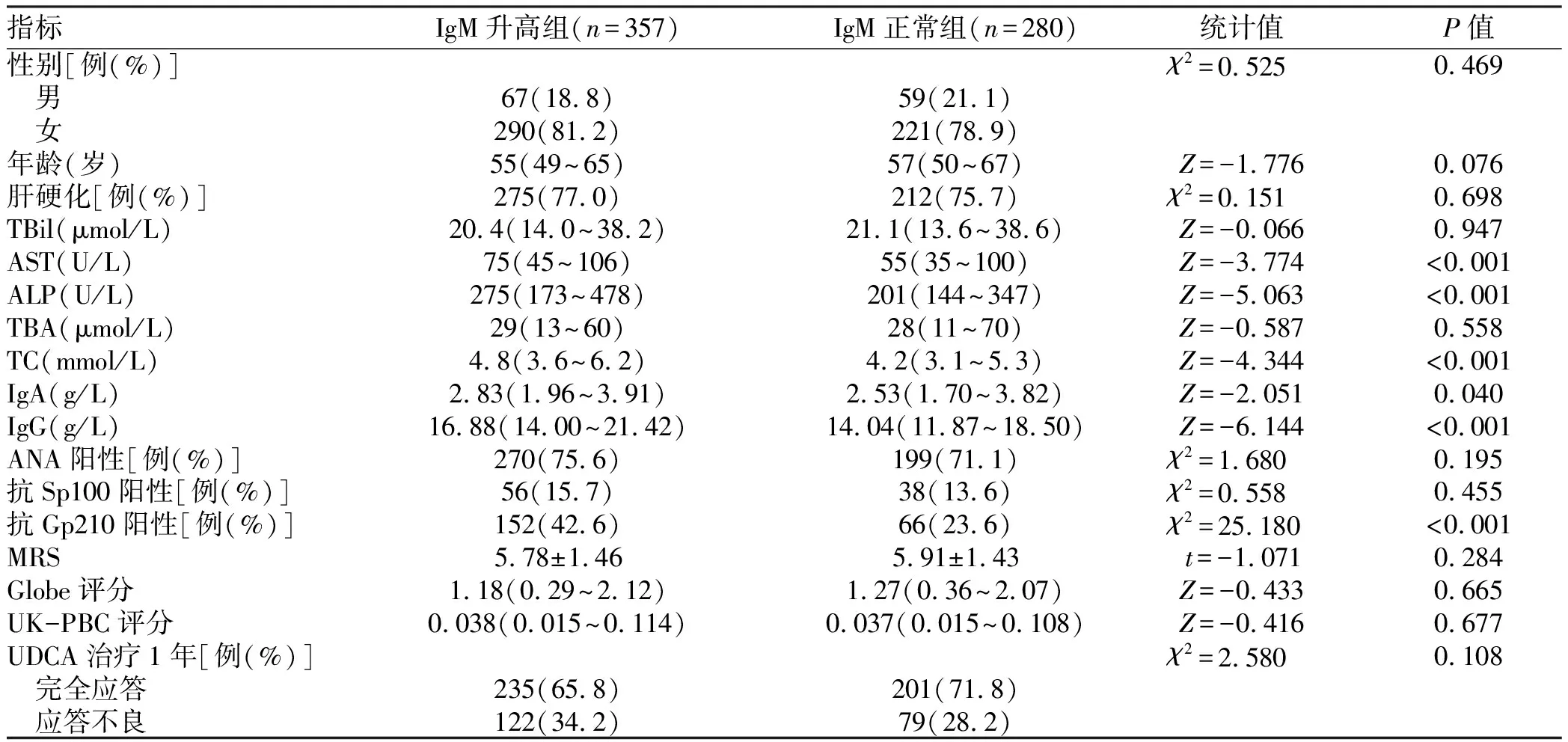
表3 IgM升高与IgM正常的PBC患者基线特征及治疗应答差异Table 3 Differences of baseline characteristics and biochemical response to UDCA treatment between IgM-normal and IgM-elevated PBC
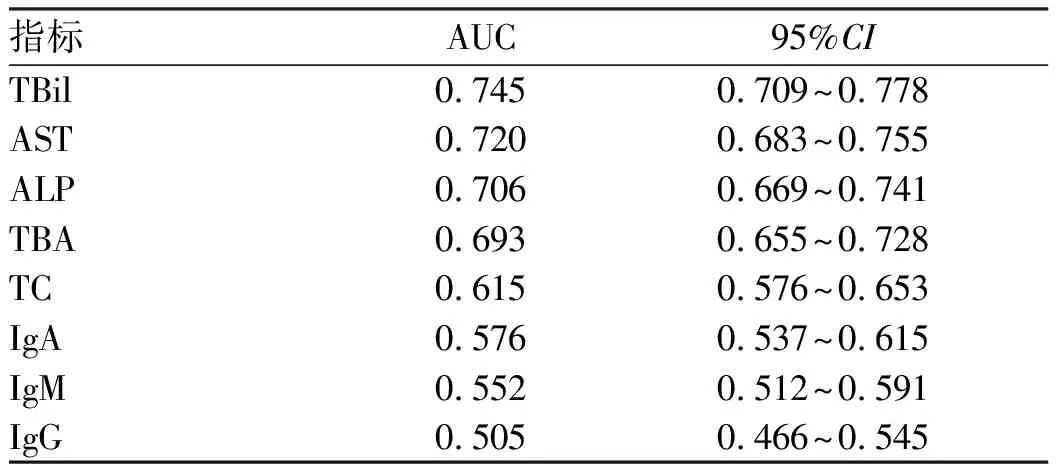
表4 PBC患者基线指标预测UDCA治疗1年后应答不良的AUC
经过UDCA治疗后发生应答不良患者显著高于IgM<1.5×ULN组(38.3% vs 27.1%,P=0.003)(表5)。
2.4 不同IgM水平预测应答不良的风险分析森林图 对IgM≥1.5×ULN组及IgM<1.5×ULN组两组的各项指标进行预测应答不良的风险值分析,结果显示IgM≥1.5×ULN组相对IgM<1.5×ULN组预测整体应答不良的风险值为1.416 (95%CI:1.129~1.776,P=0.003)。亚组分析中,无肝硬化患者,IgM≥1.5×ULN预测应答不良风险值为1.821(95%CI:1.224~2.711,P=0.003)。其他情况详见图2。
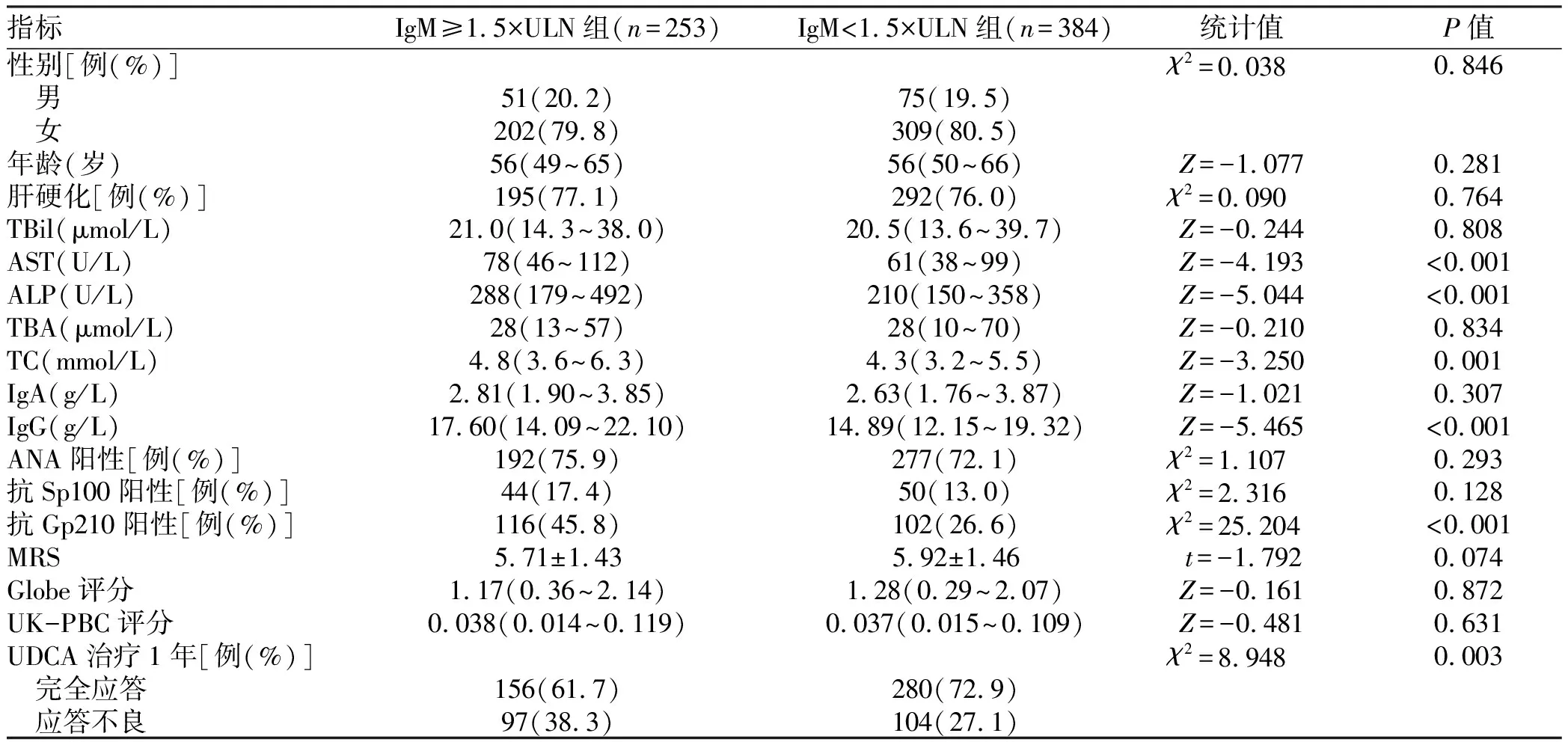
表5 不同IgM水平PBC患者基线临床特征及UDCA疗效比较
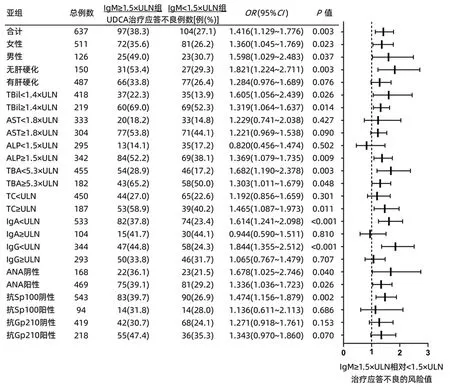
图2 IgM≥1.5×ULN相对IgM<1.5×ULN预测治疗应答情况亚组分析森林图
3 讨论
IgM具有强大的杀菌、激活补体、免疫调理和凝集作用,通常出现在初次体液免疫应答的最早阶段,是连接固有免疫和获得性免疫的纽带,也参与某些自身免疫疾病和超敏反应的病理过程。PBC是一种器官特异性的自身免疫性疾病,IgM升高是PBC典型的血清学特征之一,但是其升高的机制至今尚未完全阐明,外源微生物的分子模拟、免疫耐受性的破坏、免疫功能紊乱可能是导致高IgM水平的重要原因[9-10],IgM在PBC疾病进程中可能发挥免疫调节及免疫损伤的双重作用[9]。不同于PBC,自身免疫性肝炎(AIH)患者以IgG升高为主,其水平随着病情缓解而逐渐下降,IgG是AIH疾病转归的重要监测指标之一。作为PBC常规检测项目,IgM并未被国内外指南纳入诊疗和预后评估的指标。IgM在PBC发生、发展、疗效及转归中是否具有预测价值,目前尚缺乏大量的临床研究结果作为指导。
UDCA是PBC治疗的一线药物,可显著改善部分PBC患者非肝移植存活率[11-12],但仍有30%~40%的患者对UDCA治疗无应答,本研究中显示UDCA完全应答率为68.4%,对于这部分患者需要及时联合一种或两种二线药物来改善胆汁淤积以预防疾病进展[13]。UDCA治疗可能影响IgM水平,研究[14]发现UDCA能够显著降低细菌CpG诱导的总IgM和IgM-AMA的产生,但对IgG-AMA的水平却无影响。IgM与肝硬化相关症状和肝脏相关事件的发生关系密切,在UDCA联合苯扎贝特治疗过程中,不论ALP及GGT下降与否,当IgM水平持续异常时,患者的预后均较差,其生存期显著低于IgM水平正常化的患者,治疗过程中IgM水平的逐步正常化可能提示预后较好[15]。对于UDCA不完全应答的PBC患者,在给予联合利妥昔单抗治疗后,IgM水平随着肝功能指标的好转而逐步下降[16]。IgM正常化可作为长期预后的预测指标,但初始IgM正常患者IgM水平的变化情况及预测因素尚缺乏研究。在本研究中,UDCA治疗基线IgM平均水平为2.76 g/L,IgM升高的占比为56.0%,在UDCA完全应答组与应答不良组之间,基线IgM水平存在显著性差异(P=0.034),进一步分析IgM升高与IgM正常组患者的临床特征及在UDCA治疗1年后的疗效差异,发现IgM正常组UDCA应答率高于IgM升高组(71.8% vs 65.8%),但两组差异无统计学意义(P=0.108),通过ROC曲线分析获得IgM预测UDCA治疗1年后应答不良风险的最佳临界值(1.5×ULN),按最佳临界值进行分组后,结果显示IgM<1.5×ULN组的PBC患者发生UDCA应答率显著高于IgM≥1.5×ULN组(72.9% vs 61.7%,P=0.003),IgM≥1.5×ULN组发生UDCA应答不良风险是前者的1.416倍(95%CI: 1.129~1.776),因此基线IgM水平可能有助于预测PBC治疗应答。
IgM是进展期PBC的危险因素,与PBC胆管损伤及纤维化密切相关。进展期PBC的肝组织中IgM表达水平显著升高[17],在胆道闭锁的患儿中,靶向胆管上皮细胞的IgM自身抗体能够激活补体并参与肝纤维化的发生,从而使疾病不断进展[18-19]。 在本研究中血清IgM升高组的PBC患者,其肝硬化占比也偏高,因是回顾性研究,患者缺乏UDCA治疗基线及治疗后的组织学证据,无法评估IgM与疾病进展、转归之间的相关性,今后尚需要进一步完善。
UDCA生化应答的PBC患者具有较好的预后,即使进展为肝硬化的患者,如仍处于代偿期,也可达到延长生存期、降低肝病相关病死率及肝移植需求的目标[20]。MRS是一种常用的预测生存概率模型,最初用于筛选肝移植对象和确定肝移植手术时机[6],MRS对于失代偿期肝硬化的PBC患者也具有较强的预测性。UK-PBC评分[8]及GLOBE评分[7]是近年来被采用的PBC预后模型。在接受UDCA治疗的PBC患者中,MRS、UK-PBC评分和GLOBE评分对患者肝移植或死亡的风险预测均具有较好的准确性[21]。本研究结果显示MRS、Globe评分、UK-PBC评分在UDCA完全应答组及应答不良组之间均具有显著性差异,提示UDCA完全应答组的非肝移植存活率均显著高于应答不良组,但在IgM升高组和正常组之间以及IgM≥1.5×ULN组和IgM<1.5×ULN组之间,三种预测模型评分均无明显差异,这说明基线IgM水平还不能作为独立预测非肝移植存活率的指标。
总之,本研究结果提示基线IgM水平对于预测UDCA应答具有重要价值,基线IgM水平较高的PBC患者,治疗中应密切监测IgM水平,如持续异常,应及时联合二线药物治疗。
伦理学声明:本研究方案于2020年5月9日经解放军总医院第五医学中心伦理委员会批准,批号:R2015140DC020。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:韩琳、梁庆升负责课题设计,撰写论文;谢欢、陈英、张明月负责收集数据及资料分析;李保森、赵军负责修改论文;孙颖、董艳丽负责拟定写作思路,指导撰写文章并最后定稿。

