基因6型慢性丙型肝炎的流行病学特征及抗病毒疗效分析
黄锦妮, 江建宁, 梁丹丹, 龙诗雨, 董国珍, 苏 曼, 李继娇, 滕春玲, 张 萍, 苏明华
广西医科大学第一附属医院 感染性疾病科, 南宁 530021
HCV具有较高的人群易感性,广泛散布在全球各地的所有年龄、性别、种族和地区人群中。近十年来,全球慢性丙型肝炎(CHC)患病率增加至2.8%,总感染人数超过1.85亿。慢性HCV感染是导致肝硬化、肝细胞癌(HCC)、肝衰竭等肝脏疾病的关键因素,每年因感染HCV致死的患者高达35万例。我国一般人群HCV感染者约560万,考虑加上高危人群和高发地区的HCV感染者,合计可达1000万[1-3]。急性HCV感染很少被诊断,约80%的患者会进展为慢性感染,且一般无明显临床特征,若未及时有效抗病毒治疗,持续的HCV感染能引起肝脏的氧化应激和脂肪变性,从而增加导致癌变的基因组突变风险[4-5]。基因6型目前已知共有29种亚型(表示为6a~6xf),是一个亚型丰富、遗传多样性高的基因型,有研究[6]表明,基因6型较非6型患者发生HCC的风险高,且合并肝硬化者更易进展为HCC。因此,了解和认识HCV基因6型的防治与“丙型肝炎消除”关系紧密。在直接抗病毒药物(DAA)问世之前,我国对于基因6型CHC患者的治疗方案为PR方案[聚乙二醇干扰素联合利巴韦林(ribaririn,RBV)],此方案疗效不佳、疗程长、严格的干扰素适应证、诸多药物副作用等种种因素导致接受PR治疗的人群日益减少,9%~15%的患者在临床药理试验研究中因严重不良事件而停止治疗[5,7]。第一个DAA于2011年上市,随着疗程短、直接作用不同靶点、持续病毒学应答(SVR)率高、安全性高、依从性好的DAA不断完善及面世,DAA逐渐成为丙型肝炎治疗道路上的主流。临床研究显示,基因6型CHC患者用DAA治疗后可获得较高的SVR率,但真实世界的情况是否与临床研究的结果一致有待商榷,为此,本研究对基因6型CHC患者流行病学特征和抗病毒治疗的效果进行分析。
1 资料与方法
1.1 研究对象 选取2012年12月—2020年12月在本院感染性疾病科诊治的97例基因6型CHC患者(均为广西户籍)。其中62例进行抗病毒治疗,分为干扰素治疗组(22例)和DAA治疗组(40例,均为初治患者)。排除合并酒精性、药物性、遗传代谢性、中毒性及自身免疫性等因素所致肝损害,肝衰竭,依从性差,合并心、脑、肺等严重原发疾病,精神疾病及孕妇或哺乳期的患者。
1.2 研究方法 入组患者根据2011、2014、2016年欧洲肝病学会(EASL)、2016年世界卫生组织(WHO)、我国《丙型肝炎防治指南(2019年版)》[8]分别采用不同的干扰素方案及DAA方案进行治疗,干扰素组方案:PR方案、PR+索磷布韦(sofobuvir,SOF),疗程24~48周;DAA组方案:SOF联合维帕他韦(velpatasvir,VEL)(无论有无合并代偿期肝硬化,疗程均为12周)、SOF联合来迪派韦(ledipasvir,LDV)(无论有无合并代偿期肝硬化,疗程均为12周)、SOF联合达卡他韦(daclatasvir,DCV)(无论有无合并代偿期肝硬化,疗程均为12周)、SOF联合RBV(疗程24周),具体治疗方案见表1。收集患者治疗前1周、治疗第4周、停药时、停药后第12周(干扰素组加测停药后第24周)的HCV RNA、肝功能、血常规、肾功能等指标,HCV RNA采用实时荧光定量PCR法,<15 IU/mL为阴性。HCV RNA为评估疗效的主要指标,肝功能为次要指标,血常规及肾功能为药物不良反应评估的主要指标。比较不同方案在治疗第4周(RVR)、停药时(Epoint)、停药后第12周(SVR12)的病毒学应答率及药物不良反应。

表1 不同治疗方案及疗程Table 1 Different treatment plans and courses of treatment
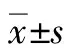
2 结果
2.1 流行病学特征及基线资料 97例基因6型CHC患者平均年龄(41.97±10.12)岁,30~40岁感染者占比最高,为47.4%(46/97)。静脉吸毒是主要传播途径,主要分布在30岁~40岁(47.4%)。97例基因6型CHC患者中62例患者接受抗病毒治疗,其中干扰素治疗组22例,DAA治疗组40例(非肝硬化33例,代偿期肝硬化7例,均为初治患者),DAA组患者治疗前1周的平均HCV RNA为122.0(8.3~320.0)×105IU/mL(表2)。

表2 97例患者流行病学特征及基线资料Table 2 Epidemiological characteristics and baseline dataof 97 patients
2.2 疗效分析 干扰素治疗组总体治疗RVR、Epoint、SVR12、SVR24率分别为81.8%(18/22)、86.4%(19/22)、81.8%、81.8%,其中1例患者在疗程结束停药3个月后出现复发。但干扰素治疗组联合用SOF的SVR12率为100%。DAA治疗组总体的RVR率为87.5%(35/40),Epoint、SVR12率均为100%,未发现治疗失败或复发的患者。不同方案虽RVR率不同,但SVR12率均为100%。不同方案的SVR率比较差异无统计学意义(P>0.05)。2组各方案的RVR、Epoint、SVR12率见图1。
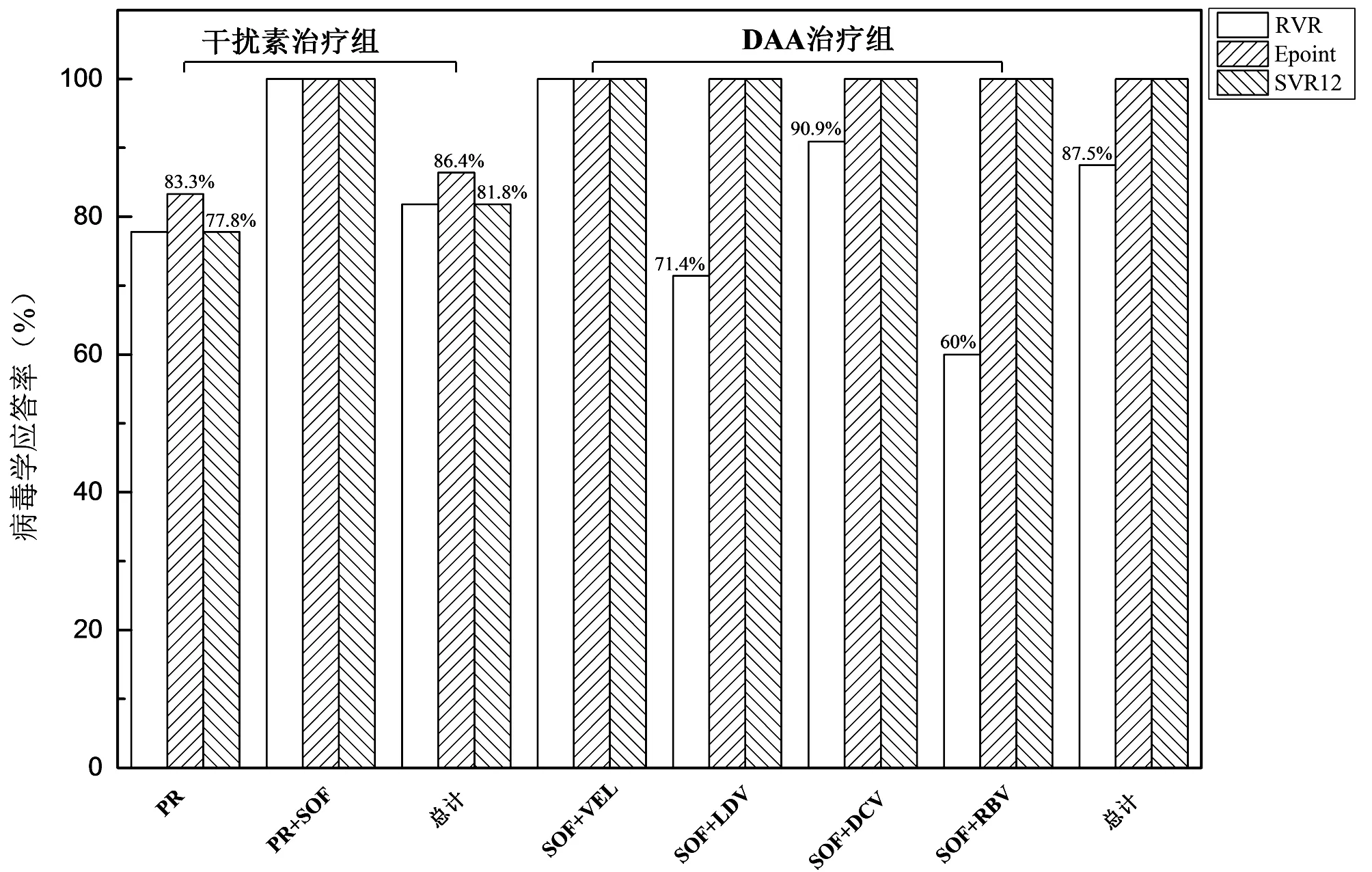
图1 不同治疗方案的病毒学应答率
2.3 肝硬化对DAA治疗组的影响 40例DAA治疗组患者分为代偿期肝硬化组(n=7)和非肝硬化组(n=33),2组在基因亚型、治疗前HCV RNA水平比较均无明显统计学差异(P值均>0.05),代偿期肝硬化组年龄为46(46~51)岁,非肝硬化组年龄为41(37~42)岁,两组SVR12率均达100%。有2例非肝硬化患者合并HBV(用恩替卡韦抗病毒),1例非肝硬化患者合并格林-巴利综合征(用激素+泮托拉唑);1例代偿期肝硬化患者合并艾滋病(用HAART方案AZT+3TC+EFV),SVR率也达100%。本研究组中所有治疗前肝功能异常(即ALT、AST升高)者疗程中均未使用护肝药,在抗病毒治疗后肝功能均恢复正常。
2.4 安全性比较 干扰素治疗组中有11例(PR方案8例,PR+SOF 3例)出现乏力、头晕、头痛及血液系统异常(包括中性粒细胞减少、贫血)等不良反应多,停药后上述不良反应均好转恢复,有1例患者因副作用暂停治疗;DAA治疗组有5例(SOF+LDV 2例,SOF+DCV 2例,SOF+RBV 1例)出现乏力、头晕、头痛及血液系统异常,但治疗过程监测均无肾功能损害及中止治疗者。
3 讨论
HCV是黄病毒科的单股正链RNA病毒,编码约3000个氨基酸的多蛋白前体,前体被切割成至少10种不同的蛋白质,包括核心蛋白区、包膜蛋白区以及非结构蛋白[9-10]。目前已报道的HCV可分为7种主要基因型及超过100种亚型,本研究探讨的基因6型主要在东南亚国家及周边地区流行,其中老挝的基因6型占总HCV感染率高达95.6%[9,11-12]。基因6型常见于我国南部及西南地区。近年来,感染途径的改变及世界文化交流日益增多等因素导致我国基因6型在区域和人群HCV流行中所占比重越来越大[13]。既往研究[14]表明,我国基因6型CHC患者主要亚型为6a型。本文也提示广西地区基因6型患者中6a型为主要流行亚型,男性比女性更常见于基因6型的感染,这可能与性别之间不同的习惯和行为有关。马来西亚的一项研究[15]也提示基因6型多见于男性。20世纪90年代后,输血安全不断被完善,输血感染HCV发生率逐年下降,静脉吸毒在HCV的传播中发挥着重要作用。本研究静脉药瘾者占明确传播方式者63.1%,且感染者以30~40岁居多(47.4%)。国内研究[16]也提示40岁以下和静脉药瘾史是基因6型的独立预测因子。唐维等[17]和韦智等[18]研究也表明,广西地区丙型肝炎基因6型患者主要为有静脉药瘾史且年龄大多<40岁。
在DAA问世之前,对于基因6型CHC患者的治疗方案主要为PR方案,持续治疗24~48周。该方案的SVR率仅有65%~85%,药物副作用多[6]。该方案治疗周期长、干扰素的严格适应证及频繁的医院复查监测,导致接受PR方案治疗的人群部分不能耐受,目前国内外指南已不推荐该方案。随着疗程短、直接作用不同靶点、SVR率高、安全性高、依从性好的DAA陆续上市,已成为CHC患者抗病毒治疗的首选方案。基因6型虽为结构复杂、亚型丰富的基因型,对DAA的治疗有着高SVR率及低复发率。本研究中PR方案组的SVR率为81.8%,8例患者出现流感样症状、血液系统异常等副作用,且有1例患者在结束疗程3个月后出现病毒学复发。PR+SOF方案组有3例患者出现药物不良反应,虽该方案也获得100%的SVR12,但干扰素有一定的不良反应;DAA组中SOF+RBV方案的RVR率为60%,虽Epoint、SVR12率均为100%,但其方案疗程长,用RBV副作用大,现有指南已不推荐用这两种方案。2016年EASL指南中的SOF+DAC方案虽可覆盖常见的基因型,SVR率可达95%~100%,本研究中该方案的RVR、SVR12率分别为90.9%、100%,但该方案对基因6型患者的有效性数据未发布,相对于丙通沙及夏帆宁等方案其应答率稍低及药物-药物相互作用较常见。本研究中SOF+VEL、SOF+LDV方案的Epoint、SVR12率均为100%。DAA治疗组中无一例治疗失败或复发,DAA治疗的SVR率较干扰素方案明显提高,结合《丙型肝炎防治指南(2019年版)》[8],认为6型初治的CHC患者采用SOF/VEL 12周或SOF/LDV 12周的方案治疗较佳。DAA治疗组里未获得RVR率的患者均无肝硬化且未合并其他疾病,治疗前HCV RNA为(1.63±0.70)×107IU/mL较获得RVR率患者的病毒载量(5.80±7.20)×107IU/mL低,可见患者未获得RVR率可能与肝硬化、合并症及病毒水平无关,也不影响SVR12率。
国内基因6型的CHC患者DAA治疗的临床研究及真实世界研究SVR12率均达100%,无治疗失败及复发患者[8],但国外研究发现基因6型的CHC患者用DAA治疗的SVR12率并未达100%,缅甸的真实世界研究发现基因6型患者治疗失败的原因与诊断为肝硬化有关,尤其失代偿期肝硬化患者被认为是疗效欠佳的人群[19-20]。DAA治疗组7例代偿期肝硬化患者SVR12率可达100%,其中2例采用SOF+LDV方案治疗的肝硬化患者并未联合RBV治疗或延长治疗疗程,也取得100% SVR12率,提示基因6型代偿期肝硬化患者用SOF+LDV12周的方案也是可行的。巴基斯坦的一项研究[21]显示,基因6型CHC患者发生肝硬化率低,本研究97例患者中肝硬化只有7例,占7.22%,提示在我国基因6型的CHC进展为肝硬化比率不高,这可能也是基因6型CHC获得较高SVR率的原因之一。基线耐药相关替代(RAS)是否影响治疗的SVR率,阳光等[22]对广西地区基因6型CHC患者进行NS5B区耐药突变位点检测,发现其突变率为7.9%,主要耐药突变位点为V494A,但患者DAA治疗后均获得100%的SVR12率。有研究[23-24]显示,在经历病毒学突破的患者中发现NS3和NS5A RAS,但患者SVR率仍较高。可见基因6型CHC基线RAS对治疗效果影响不大。
目前基因6型CHC的治疗方案有多种,笔者团队认为SOF+VEL、SOF+LDV方案是较好的治疗方案,由于本研究样本量有限,仍需在临床实践中扩大患者例数,最大程度的简化丙型肝炎诊治及监测流程,努力为2030年WHO的消除肝炎目标做出贡献。
伦理学声明:本研究方案于2020年12月29日经由广西医科大学第一附属医院伦理委员会审批,批号:伦审2020(KY-E-187)号,患者均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:黄锦妮对研究数据进行了获取分析及解释过程,并修改文章关键内容;江建宁、苏明华负责研究的思路或设计,参与修改文章关键内容;梁丹丹、龙诗雨、董国珍、苏曼、李继娇、滕春玲、张萍参与研究数据的获取分析过程。

