华木莲SgMLPK基因的克隆与亚细胞定位
邓凌帆, 邱珊姗, 刘苗苗, 张建强, 王颜波, 刘齐元, 王建革
(1.江西农业大学林学院,江西 南昌 330045;2.南昌工程学院水利与生态工程学院,江西 南昌 330029; 3.江西农业大学农学院,江西 南昌 330045)
植物育种的重要目标之一是利用杂种优势[1].作为避免近交和促进异交的繁育机制,自交不亲和(self-incompatibility, SI)是开花植物中广泛存在的现象,但在育种中,此机制是杂种优势利用的主要障碍,亲本杂合导致许多自交不亲和物种中自交不亲和与自交亲和现象非常普遍,这种转换为自交不亲和物种增添了新的育种途径.
一般地,自交不亲和分为配子体自交不亲和(gametophytic SI, GSI)、孢子体不亲和(sporophytic SI, SSI)和迟发性自交不亲和(late-acting SI, LSI),其中,迟发性自交不亲和专指花粉管生长到胚珠或穿透胚珠后又表现自交不亲和类型[2].研究表明[3,4],自交不亲和受S位点控制,该位点有2个连锁的S基因:花粉S基因和雌蕊S基因,连锁打破会造成自交不亲和向自交亲和转变.虽然自交不亲和有多种类型,但深入开展自交不亲和机制研究的物种并不多,主要局限在5个科内,其机制已呈现复杂特征.在车前科(Plantaginaceae)、茄科(Solanaceae)、蔷薇科(Rosaceae)配子体自交不亲和植物中,雌蕊S决定因子为S核糖核酸酶(S-ribonuclease, S-RNase),花粉决定因子为S位点F-box(S-locus F-box, SLF)或S单倍型特有F-box(S-haplotype-specific F-box, SFB)[5,6].罂粟科(Papaveraceae)配子体自交不亲和植物中雌蕊决定因子为柱头乳头细胞分泌蛋白(stigma-expressed secreted protein, PrsS),花粉决定因子为花粉表达跨膜受体蛋白(pollen-expressed transmembrane protein, PrpS)[7].在十字花科孢子体自交不亲和植物中,花粉决定因子为富含半胱氨酸S位点蛋白(S-locus cysteine rich protein, SCR),雌蕊决定因子为S位点受体激酶(S-locus receptor kinase, SRK)[8,9].自花授粉时,SCR与SRK互作,激活SRK,然后在M位点受体激酶(M-locus protein kinase, MLPK)参与下,触发下游级联反应,引起自交不亲和反应.关于迟发性自交不亲和的研究较少,机理尚不清楚.目前研究表明,迟发性自交不亲和通常在同科属中分布,在基部类群中较多.
木兰科珍稀植物华木莲(Sinomanglietiaglauca)处于木兰属和木莲属连接位置,在演化上具有重要科学价值[10].与其它木兰科植物一样,华木莲极具观赏价值,但其自我更新能力较差,无性繁殖困难,只能靠种子繁殖,表现自交不亲和.研究表明,华木莲传粉、结实正常,说明华木莲生殖保障不存在问题,濒危原因在于生存竞争力弱.如果能使华木莲从自交不亲和转换为自交亲和,充分利用最大杂种优势,将为华木莲育种开辟新的途径.因此,了解华木莲自交不亲和机理对于华木莲育种具有重要意义.
华木莲呈现迟发性自交不亲和特征.在木兰科中,除华木莲外,白玉兰(Magnoliadenudata)也呈现迟发性自交不亲和特征[11].研究表明[12,13],表现迟发性自交不亲和特征的山茶科山茶属植物茶树(Camelliasinensis)也有SRK基因.
迟发性自交不亲和与孢子体自交不亲和是两类差别较大的自交不亲和类型,而SRK和MLPK基因都是参与孢子体自交不亲和反应的重要基因.因此,存在的问题有:(1)SRK和MLPK基因是否参与华木莲的自交不亲和响应;(2)如果参与,何时何处参与自交不亲和反应以及作用如何;(3)如果不参与,两基因为什么如此保守,其功能是什么?基因克隆和亚细胞定位观察是研究基因功能的前提,本研究目标:(1)SgMLPK基因编码蛋白质理化如何?(2)编码蛋白质的亚细胞定位在何处?以期为解决SgMLPK基因在华木莲自交不亲和中的作用提供依据.
1 材料与方法
1.1 材料
试验于2019年3月至2021年4月进行.华木莲种植于江西农业大学校园内,花期分别对自花授粉和异花授粉心皮于授粉前、授粉后0.5 h取样,取样后样品用液氮迅速固定,-80 ℃冰箱冻存,用于RNA提取.用于瞬时的表达材料为烟草k326,种子处理后萌发1~2 d置于光照培养箱内培养,培养条件为光/暗周期16 h/8 h,光/暗温度24 ℃,光强1 500 lx,相对湿度85%,60 d后叶片用于瞬时表达.
1.2 RNA提取及华木莲SgMLPK基因克隆
RNA提取和反转录采用试剂盒进行,试剂盒TaKaRa MiniBEST Plant RNA Extraction Kit和PrimeScriptTM1st Strand cDNA Synthesis Kit购自TAKARA公司.提取的RNA用琼脂糖凝胶电泳进行检测,利用Oligo dT和随机6-mer引物进行反转录合成cDNA.在课题组前期三代测序基础上设计引物扩增SgMLPK, 前引物序列:5′-ATGGGGAATTGCTGGAGC-3′, 后引物序列:5′-TCATGTATA AAGGGGGGAAGC-3′. 反应体系为20 μL: 2×T5 Super PCR Mix for PAGE 10 μL,正向、反向引物各1 μL,模板1 μL,Nuclease-Free Water 7 μL.扩增程序:94 ℃ 5 min变性,然后94 ℃ 1 min,57 ℃ 30 s,72 ℃ 2 min,共30个循环,最后72 ℃ 10 min,4 ℃保存.目的产物克隆采用PROMEGA公司克隆载体pGME-T Easy载体,感受态大肠杆菌DH5α购自擎科生物公司,具体方法按照试剂盒说明书.对PCR产物低熔点琼脂糖进行电泳,切取相应条带回收.回收后与pGME-T Easy载体连接,然后通过热激法转化大肠杆菌DH5α.挑选克隆进行PCR扩增,被证实的阳性克隆送擎科生物公司测序.
1.3 序列分析
蛋白的理化性质与功能相关.为了解SgMLPK基因编码蛋白的理化性质,利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)推测蛋白的氨基酸组成;利用Pfam数据库(http://pfam.xfam.org/)分析蛋白结构域,并利用hmmer(https://www.ebi.ac.uk/Tools/hmmer)验证,利用ExPASy(https://web.expasy.org/protscale/)预测蛋白疏水性,基于TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对编码蛋白跨膜区进行推断,利用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)研究蛋白信号肽,利用Cell-PLoc(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测蛋白亚细胞定位.
1.4 进化分析
基于MLPK同源蛋白序列构建系统发育树研究不同物种MPLK基因之间的演化关系.MLPK同源蛋白序列从NCBI(https://www.ncbi.nlm.nih.gov/)搜索,去除不完整序列,同一物种蛋白取最长序列,通过hmmer(https://www.ebi.ac.uk/Tools/hmmer)鉴定,利用IQ-TREE软件基于最大似然法构建系统发育树,Bootstrap 1 000次,进化树用Evolview(https://www.evolgenius.info/evolview)展示.
1.5 重组表达载体构建
瞬时表达采用表达载体pCAMBIA1302进行,表达载体、质粒提取试剂盒及NcoⅠ酶购自擎科生物公司.选取测序证实的阳性克隆用LB液体培养基(10 g·L-1Tryptone、5 g·L-1Yeast extract、10 g·L-1NaCl)培养6 h后,用质粒提取试剂盒提取质粒.用NcoⅠ酶切割含目的基因片段克隆载体pGME-T Easy,用低琼脂糖电泳回收目的片段,同时用NcoⅠ酶在多克隆位点NcoⅠ-SpeⅠ处切割表达载体,然后将目的基因与之相连,构建目的基因与荧光蛋白基因融合的重组表达载体.将重组表达载体转化DH5α感受态细胞扩增,最后提取质粒对构建好的重组载体用KpnⅠ/SpeⅠ酶切验证连接正确性.
1.6 基因瞬时表达与编码蛋白亚细胞定位
瞬时表达采用农杆菌介导侵染的k326烟草叶片进行,感受态农杆菌GV3101购自上海唯地生物技术有限公司,农杆菌转化参照唯地公司程序进行.含有重组表达载体的DH5α细菌用LB液体培养基培养24 h后,用质粒提取试剂盒提取重组表达载体.通过热激法将重组表达载体导入农杆菌GV3101中,于28 ℃振荡培养2~3 h,在含卡那霉素和潮霉素的LB固体培养基上培养2~3 d(28 ℃),利用PCR筛选阳性克隆.对确证的阳性克隆,用含卡那霉素和潮霉素的LB液体培养基,在恒温28 ℃下振荡培养菌液 ,并调至D600 nm=1.0. 然后通过注射法侵染烟草叶片,36 h后用Olympus荧光显微镜检测,共检测6个叶片,每个叶片3个视野.
2 结果与分析
2.1 基因克隆及序列分析
SgMLPK基因长1 254 bp,命名为SgMLPK(GenBank登录号:MW 139902),编码蛋白共417个氨基酸(图1),分子质量45.836 ku,等电点9.15.
2.2 SgMLPK蛋白结构分析
在大多数细胞活动中起关键作用的蛋白质磷酸化是由蛋白激酶和磷蛋白磷酸酶介导的.蛋白激酶催化磷酸从三磷酸核苷酸(通常是ATP)转移到蛋白质底物侧链中的一个或多个氨基酸残基上,导致影响蛋白质功能的构象变化.磷蛋白磷酸酶则催化相反的过程.蛋白激酶分为三大类,其特征在于底物特异性;丝氨酸/苏氨酸蛋白激酶、酪氨酸蛋白激酶和双重特异性蛋白激酶.SgMLPK蛋白结构中存在许多丝氨酸/苏氨酸和酪氨酸蛋白激酶的催化结构域(图2a).它不包括双重特异性激酶的催化域.ExPASy ProtScale分析表明,编码蛋白存在疏水区(图2b),TMHMM分析未发现编码蛋白存在跨膜区域(图2c),但SignalP 5.0分析表明,编码蛋白有一信号肽,切点在29~30个氨基酸处(图2d).上述分析表明,SgMLPK具有丝氨酸/苏氨酸激酶活性,为胞质类受体激酶家族.

图1 SgMLPK基因序列及氨基酸序列Fig.1 Nucleotide sequence and protein sequence of SgMLPK

a:预测的SgMLPK结构域;b:预测的SgMLPK疏水性;c:预测的SgMLPK跨膜域;d:预测的SgMLPK信号肽.图2 SgMLPK结构分析Fig.2 Structure analysis of SgMLPK
2.3 SgMLPK系统进化分析

图3 SgMLPK系统发育树Fig.3 Phylogenetic tree of SgMLPK
在NCBI上搜索自交不亲和物种MLPK蛋白,去除不完整序列,每物种只取1个,加上SgMLPK,共得到12个序列.所有获得序列的结构都利用hmmer进行了验证,均含有Pkinase_Tyr基序.在此基础上,利用IQTREE构建了进化树(图3).结果表明,最佳模型为JTT+G4.根据进化树信息,木兰分支、真双子叶植物基部群、核心真双子叶植物出现分支.木兰分支中木兰科华木莲(Sinomanglietiaglauca)与樟科沉水樟(Cinnamomummicranthum)有同源性,其次是真双子叶植物基部群的莲科莲(Nelumbonucifera)和罂粟科罂粟(Papaversomniferum),超蔷薇分支中的十字花科与芸香科克莱门柚(Citrusclementina)支持率不同,超菊分支中茄科番茄(Solanumlycopersicum)、辣椒(Capsicumannuum)及旋花科牵牛(Ipomoeanil)处于顶端.MLPK系统发育树呈现的关系与物种演化关系大致相应.
2.4 重组表达载体构建
构建的重组表达载体如图4所示.表达载体pCAMBIA1302含有35S强启动子,并带有潮霉素(HygR)和卡那霉素(Kan)抗性基因,SgMLPK基因连接在NcoⅠ-SpeⅠ多克隆位点处,与绿色荧光蛋白(green fluorescent protein, GFP)基因形成融合基因.在构建融合基因时,切除了SgMLPK基因终止密码,插入位点处酶切识别位点发生变化,目的基因无法通过酶切回收,但利用PCR扩增可以获得.对已构建的重组表达载体进行KpnⅠ/SpeⅠ酶切(图5a),为确保转化后农杆菌含有目的基因,对培养后用于侵染的农杆菌进行PCR验证(图5b),结果表明,带有目的基因的重组表达载体已成功转化至农杆菌中.
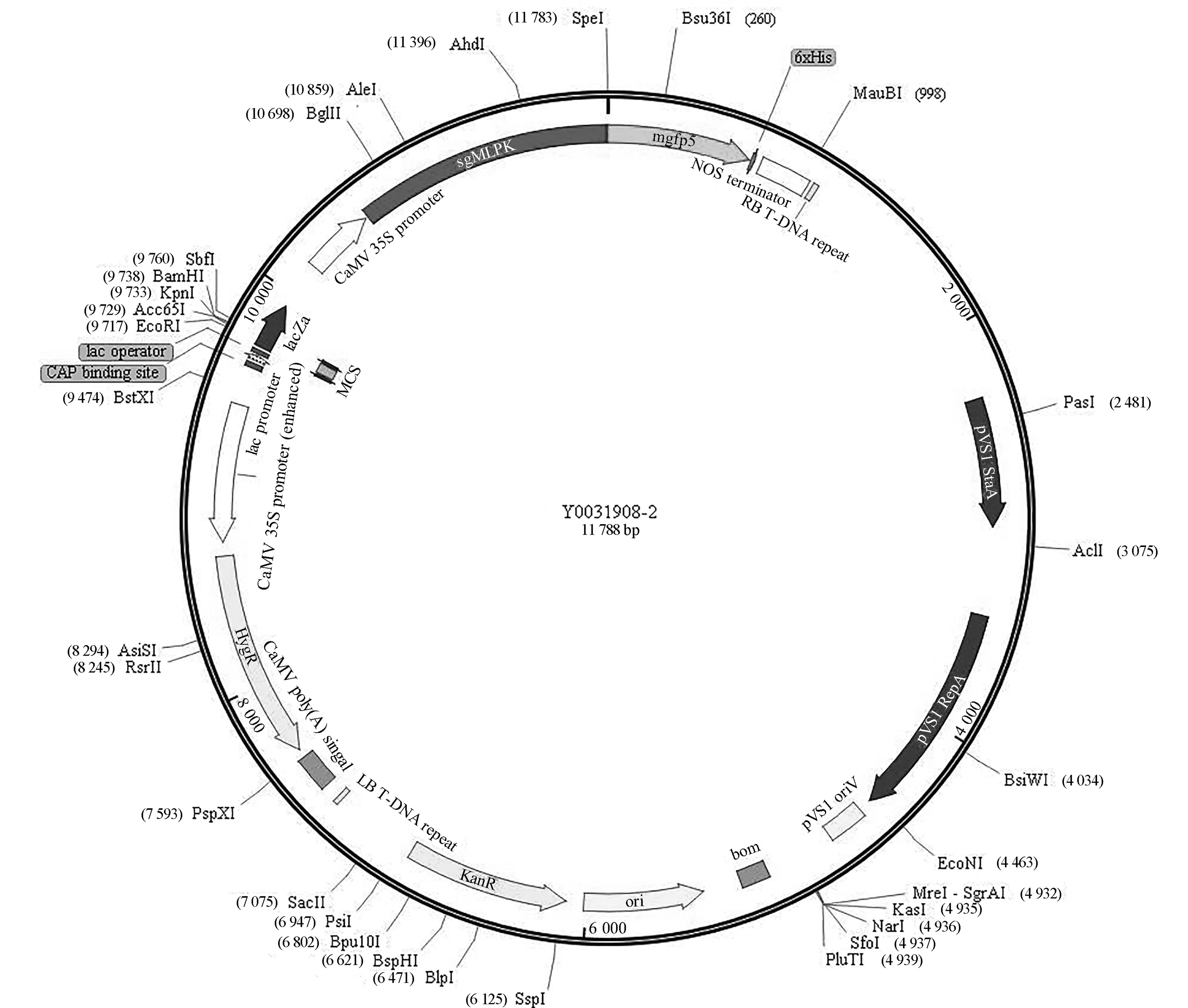
图4 含SgMLPK的重组表达载体Fig.4 Recombinant expression vector containing SgMLPK
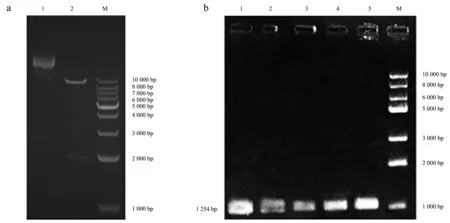
a:重组表达载体酶切验证;b:重组表达载体PCR验证.图5 重组表达载体验证Fig.5 Validation of recombinant expression vector
2.5 SgMLPK基因的亚细胞定位
基因编码蛋白亚细胞定位与基因发挥功能息息相关.为了观察SgMLPK亚细胞定位,将含有SgMLPK与GFP基因的农杆菌直接注射烟草k326叶片进行瞬时表达,36 h后于荧光显微镜下观察其亚细胞定位(图6).在注射部位周围,可看到明显荧光信号,说明基因得到表达正常.进一步观察表明,在细胞质与细胞膜处均有荧光,相对来说,细胞膜处荧光较强.与生物信息学分析结果相符.

a:合并;b:荧光;c:明场.图6 SgMLPK基因的亚细胞定位Fig.6 Subcellular localization of SgMLPK gene
3 讨论
在三代转录组生信分析基础上,本研究克隆出了SgMLPK基因,全长共1 254 bp,编码417个氨基酸.编码蛋白具有Pkinase_Tyr基序,有信号肽,但无跨膜结构,具备磷酸化功能,亚细胞定位于细胞质中,近细胞膜处较多.因此SgMLPK具备典型MLPK特征.
在十字花科植物中,MLPK蛋白具有丝氨酸/苏氨酸激酶活性,作为正调控元件参与孢子体自交不亲和反应.同SRK一样,MLPK也在开花期间,于柱头表达, 二者与质膜处发生互作.当自花花粉落在柱头上后,SCR与SRK互作,引起SRK构象发生变化,在MLPK参与下,磷酸化ARC1,触发自交不亲和级联反应[14].有研究表明[15],MLPK属于胞质类受体激酶家族,但产生两类转录子MLPKf1和MLPKf2,二者功能相同,但N端膜定位信号肽存在差异,前者通过其N端的豆蔻酰化基序定位到膜上,后者通过N端的疏水区定位到膜上.也有研究表明[16],野生型MLPK基因转入乳突细胞能够抑制自身花粉萌发和生长,MLPK与SRK可直接作用传递SI反应.本试验结果表明,SgMLPK基因与孢子体不亲和MLPK基因高度同源,且SgMLPK基因具有MLPK基因典型的特征.
迟发性自交不亲和机理目前尚不清楚,孢子体自交不亲和与迟发性自交不亲和为两种截然不同的类型,由于缺乏深入研究,尚不能确定SgMLPK基因在华木莲自交不亲和中的作用.但华木莲MLPK基因不仅与十字花科中的MLPK基因高度同源,其编码蛋白理化性质和亚细胞定位也相同,说明在进化中受到了较强的自然选择作用.基因同源,功能未必完全相同,因此,SgMLPK基因在自交不亲和中是否发挥作用有待于进一步探讨.
致谢:江西农业大学理学院王义华教授、江西农业大学农学院边建民教授、南昌大学医学院罗时文教授、南昌大学第一附属医院陈丽敏博士、中国林科院林研所张冰玉研究员对研究给予了帮助,谨致谢意!

