MRI弥散加权成像联合肿瘤标志物在乳腺肿块诊断中的价值
周怡,余文洁,管祥林,吴素文
清远市妇幼保健院 放射科,广东 清远 511500
0 引言
近年来,研究数据表明国内外乳腺癌患者人数不断增加,发病率逐年增高,已然成为女性群体中常见的恶性肿瘤,且发病年龄向年轻化推移[1-2],严重影响女性患者的身心健康。对于乳腺癌,及时发现、早期诊断对于患者后期治疗以及预后改善都具有重要意义,可有效提升和改善患者术后生存率和生活质量[3]。当前,随着医学研究进步以及影像学研究的深入,加之部分领域研究已深入分子生物学水平,使得采用影像检查联合血清肿瘤标志物进行诊断成为可能[4]。其中,弥散加权成像(diffusion weighted imaging,DWI)是乳腺疾病检查常用MRI序列。DWI相对常规序列显示病灶形态特征基础上,能够通过量化组织内水分子运动能力对病灶血流特征进行分析[5-6],从而有效提高乳腺癌诊断的准确率,并为接下来制定治疗方案和预后改善提供重要依据。本文深入探究MRI弥散加权成像联合肿瘤标志物[糖类抗原15-3(carbohydrate antigen 15-3,CA15-3)、糖类抗原12-5(carbohydrate antigen 12-5,CA12-5)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)及癌胚抗原(carcinoembryonic antigen,CEA)]在乳腺肿块诊断中的实际应用价值,为进一步增强乳腺肿块诊断效能,提升乳腺癌早期诊断提供相关实践依据。
1 资料与方法
1.1 一般资料
选取在本院2020年1月-2021年12月收治的经手术或组织活检病理确诊的乳腺肿块患者150例为研究对象,随机分为MRI诊断组、血清诊断组和联合诊断组,每组50例。所有患者均为女性,其中MRI诊断组患者年龄在25~58岁,平均(41.58±2.35)岁;血清诊断组患者年龄在27~62岁,平均(41.65±2.33)岁;联合诊断组患者年龄在25~63岁,平均(41.72±2.30)岁。三组患者一般资料比较具有可比性,差异不具有统计学意义(P>0.05)。本次研究经院内伦理委员会审核批准,且患者签署知情同意书。
纳入标准:①超声检查或经查体、X射线钼靶提示乳腺肿块;②年龄18~80岁;③经手术病理学明确诊断;④符合相关研究标准及程序。排除标准:①合并其他恶性肿瘤者;②伴乳腺假体填充;③伴MRI或手术禁忌证;④入院治疗前已开展针对性治疗,如放、化疗;⑤存在血液疾病,影响血清肿瘤标志物检测者[7]。
1.2 方法
1.2.1 MRI弥散加权成像扫描检查
采用美国GE SIGNA Explorer 1.5T核磁共振成像系统,在开展检查前要做好前期准备及预期工作,告知患者相关注意事项,安排和帮助患者以俯卧位在检查床上,足先进,同时患者双侧乳腺要悬垂于乳腺线圈环槽内。检查开始后,告知患者双臂要充分舒展前伸,置于头部两侧。之后开展弥散加权成像检查,弥散加权b值为600s/mm2,并做出相对应的DWI图像,从而判断DWI信号的相对高低情况[8-9]。
1.2.2 血清肿瘤标志物检测
检测前安排采集患者空腹肘正中静脉血3mL,静置10min。在采集血样充分凝固后置于离心机中,设定3000r/min离心10min。之后取上清以-20℃保存备用。统一安排采用安图2000plus全自动型化学发光免疫分析仪(安图生物公司)及配套试剂盒检测血清CA15-3、CA12-5、CA19-9及CEA水平。严格按照操作标准及相关规范进行,其中相关指标参考值范围:CA15-3为0~31.5U/mL,CA12-5为0~35U/mL,CA19-9为0~27U/mL,CEA为0~5ng/mL[10]。
1.2.3 诊断标准
乳腺肿块一般良性比较规则,多数呈圆形或者椭圆形的片块状,质韧、光滑、边界清楚、活动度佳,大部分是单发,少数可多发,一般没有临床特殊症状,多是在无意间或者体检时发现。恶性属于一种不规则的块状,而且边界有一些模糊不清,一般活动度比较差,还可伴有淋巴结肿大、乳头溢液等症状。影像学检查中乳房良性疾病的X线直接征象为乳腺区域轮廓光滑,呈圆形、类圆形或分叶、均质、低密度、透光。乳房肿瘤恶性经过乳腺钼靶检查,可见到其中的细小钙化灶,经过乳腺超声检查,可以对肿块性质做出判断。若疑似恶性者,需对肿块穿刺取出,进行病理学检查。
1.2.4 数据分析
分别评价不同检测及诊断方法的诊断敏感度、特异度、诊断准确率[11]。其中,标准计算参考方式如下,敏感度=真阳性/(真阳性+假阴性)×100%。特异度=真阴性/(真阴性+假阳性)×100%。诊断准确率=(真阳性+真阴性)/(真阳性+假阳性+真阴性+假阴性)×100%。
1.3 统计学分析
本次研究数据处理及分析采用SPSS 22.0软件进行分析,正态计量资料用()表示,两组正态计量数据组间比较用t检验,计数资料用[n(%)]表示,计数资料组间率的比较用χ2检验,以P<0.05为两组比较具有统计学差异。
2 结果
2.1 病理检查结果
MRI诊断组患者经手术病理检查,确诊者为29例;血清诊断组患者经手术病理检查,确诊者为10例;联合诊断组患者经手术病理检查,确诊者为18例。
2.2 MRI弥散加权成像扫描检查结果分析
MRI诊断组患者进行MRI弥散加权成像扫描检查,检出乳腺癌36例,确诊29例,详见表1。
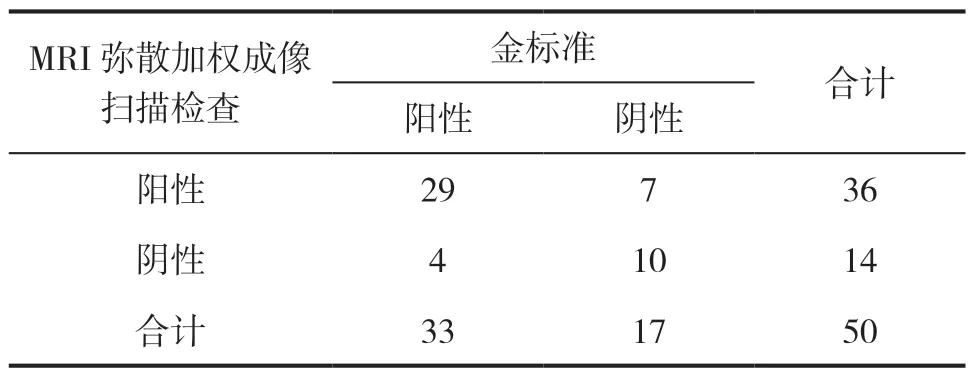
表1 MRI 弥散加权成像扫描检查结果
2.3 血清肿瘤标志物检测结果分析
血清诊断组患者进行血清肿瘤标志物检测,其中检测出有数值异常,提示乳腺癌17例,确诊10例,详见表2。

表2 血清肿瘤标志物检测结果
2.4 MRI弥散加权成像扫描检查联合血清肿瘤标志物检测结果分析
联合诊断组患者进行MRI弥散加权成像扫描检查联合血清肿瘤标志物检测,检出乳腺癌19例,确诊18例,详见表3。

表3 MRI 弥散加权成像扫描检查联合血清肿瘤标志物检测结果
2.5 不同诊断方法的敏感度、特异度以及诊断准确率对比
MRI弥散加权成像扫描诊断敏感度显著高于血清肿瘤标志物检测,差异具有统计学意义(P<0.05);血清肿瘤标志物检测特异度高于MRI弥散加权成像扫描诊断,且差异具有统计学意义(P<0.05);MRI弥散加权成像扫描诊断与血清肿瘤标志物检测诊断准确率差异不具有统计学意义(P>0.05);联合检查诊断敏感度、特异度、诊断准确率均显著高于单一检测方法,且差异具有统计学意义(P<0.05),详见表4。

表4 不同诊断方法的敏感度、特异度以及诊断准确率对比
3 讨论
当前伴随着社会水平的快速发展,人们生活工作中各种压力不断增加,生活习惯不断变化,各种疾病发生概率也逐渐提升。在女性群体中肿瘤发病率逐年升高,且恶性肿瘤占比逐年增加,同时患者群体呈现年轻化倾向,尤其是乳腺癌[12]。乳腺癌的发生,给女性患者生活及工作造成了莫大影响,带来身心多重压力。对于乳腺恶性肿瘤,早期确诊,并进行临床分期,深入了解病情发展情况,及时为患者制定有效治疗方案,给予其针对性措施,能够在一定程度上控制患者病情恶化,强化治疗效果,提高治愈率。因此,对乳腺癌患者群体来说,早期准确诊断和及时干预治疗十分重要[13]。
弥散加权成像作为一种功能性成像技术,具有无创、无电离辐射、检测效果好等多重优点。该方法是目前唯一能将活体组织内水分子扩散运动无创性检测出来的方法。该技术方法能够量化水分子在组织中的扩散程度,弥散加权成像技术较常规MRI序列而言更易检出病灶,从分子水平为良恶性肿瘤的定性诊断分析提供了参考[14]。乳腺癌患者血清中CA15-3、CA12-5、CA19-9及CEA的含量常出现升高,然而在部分良性疾病中也可能出现高于正常值的情况,CA15-3、CA12-5、CA19-9及CEA可作为乳腺肿块良恶性的临床辅助诊断指标[15]。本次研究结果显示无论是单独采用 MRI弥散加权成像扫描检查还是血清肿瘤标志物检测,诊断敏感度、特异度和准确率相较于金标准而言,均有显著性差异,在实际鉴别诊断中往往易发生缺陷,进而造成误诊、漏诊等情况发生。MRI弥散加权成像联合肿瘤标志物检测可明显提高乳腺肿块良恶性诊断的敏感度、特异度和诊断准确率。联合检测能够集中两种检测方法的优点,在检查过程中通过多方位、多视角对病灶进行全面观察和诊断,对其性质进行综合判断分析。
综上所述,MRI弥散加权成像联合肿瘤标志物检测能够为乳腺肿块良恶性筛查及诊断提供有力的鉴别依据,检测方法具有较高的敏感度、特异度和诊断准确率,能够提供较多的客观信息,提高诊断的准确性。将二者相结合,可对乳腺肿块进行更加客观的评估,减少超声医师对诊断的主观因素影响,有效提高诊断的准确性,为后期相关诊断标准制定提供借鉴基础。

