烤烟植株磷对矿质养分转运基因表达的影响及调控途径
潘晓英,陈俊标,李集勤,马柱文,徐婷裕,杨少海,黄振瑞
(广东省农业科学院作物研究所/广东省农作物遗传改良重点实验室/广东省烟草育种与综合利用工程技术研究中心,广东广州 510640)
烟草不仅是科学研究领域的重要模式植物,也是重要的经济作物,在我国的种植面积约有100万hm2。在生产上通常采取打顶和控制腋芽发生,使烟株在后期生长过程中将能量转移至叶片,促进烟叶产量最大化[1–2]。氮、磷和钾的供应在烟株的栽培过程中起着非常重要的作用。磷对烟叶成熟期的色泽形成以及烤后的烟叶品质具有重要影响,缺磷会延缓烟叶的成熟,并降低叶片中氮和镁的浓度[3]。过量供磷通常不会增加产量,反而会降低烟叶质量,出现叶片干燥和不规则的叶片形态[4]。过量施用磷肥还会导致环境污染与中微量元素缺乏等问题[5–6]。因此,探究烟株生长过程中磷养分的分配规律,对实现烟叶生产的高产高效具有重要意义。
植物体内养分间的关系十分复杂。研究发现,拟南芥在长期缺磷或低磷胁迫条件下,叶片中的钾浓度显著降低,并诱导编码钾转运蛋白基因的上调表达[7]。同样,在低钾的生长环境下,烟株体内的磷转运蛋白基因也显著上调[8]。此外,研究发现,增加钙养分的施用会降低烟株体内磷养分的浓度[9–10]。其次,磷养分与其他微量元素之间也存在复杂的交互作用。首先,磷和锌养分之间的交互作用研究较多。供磷水平增加会导致锌含量降低,如在小麦、玉米、大豆、棉花和番茄等多种作物中,随着磷肥施用量增加,作物体内磷浓度升高,但锌浓度显著降低[11–14]。而大麦的相关研究中,在正常供磷和低磷条件下,缺锌会上调磷转运蛋白的表达[15]。虽然锰是一种类似于锌的二价阳离子,但研究发现,磷会促进番茄对锰的吸收[11]。此外,研究发现,缺磷处理会导致幼苗期的拟南芥和水稻体内铁养分积累[7, 16–17]。缺磷会诱导大豆体内铜转运蛋白基因的上调表达[18]。这些结果综合表明,植物体内磷养分与其他养分之间存在复杂的交互作用,且磷养分与其他养分交互作用情况存在物种差异性。更重要的是,烟草中磷养分与其他养分的交互作用以及分子水平的相关研究尚未见具体报道。
鉴于磷在烟株生长发育过程中的重要作用,解析烟株体内磷营养分配规律及其与其它养分间的交互作用,为磷肥配合其他养分施用提供理论基础具有重要意义。本研究通过不同供磷处理,解析低磷与过量供磷对烟株体内的磷以及其它养分的浓度、含量以及分配规律的影响。其次,我们结合前期已有的转录组数据,筛选出86个养分转运相关的基因在启动子区域(2 kb)含P1BS转录元件,并对其中12个基因进行RT-qPCR验证。此外,我们结合分子生物学方法,鉴定到钾转运蛋白和镁转运蛋白基因受NtPHR2的直接调控。本研究结果将为改进烟叶生产中磷肥施用的管理策略提供理论基础,以最大限度地提高烟叶生产水平。
1 材料与方法
1.1 植物培养与生长条件
供试材料为我国的烟草主栽品种K326 (Nicotiana tabacumL. cv. K326)。将 K326 包衣种子播入泥炭、蛭石、珍珠岩(3∶1∶1, V∶V∶V)混合基质的漂浮苗盘中进行育苗,培养60天挑选长势一致的健壮烟苗,去除根部杂质,移栽至容量为4 L的塑料花盆,容器下部有孔,以便多余的水分漏出,底部垫尼龙网,防止漏砂。盆内含2 L石英砂(0.1%的盐酸浸泡后去离子水洗晾干),粒径为0.2~0.4 mm,表面覆盖一层陶粒,保持水分并避免产生绿藻。植物生长室条件:日光温室,昼夜温差为22℃~30℃。
培养过程中浇Hoagland营养液,具体配方为:3 mmol/L KNO3、2 mmol/L Ca (NO3)2、1 mmol/L KH2PO4、0.25 mmol/L MgSO4、25 μmol/L KCl、12.5 μmol/L H3BO3、1 μmol/L MnSO4、1 μmol/L ZnSO4、0.25 μmol/L CuSO4、0.25 μmol/L (NH4)6Mo7O24和 0.1 mmol/L Fe-EDTA。因此,对照条件磷浓度为1 mmol/L KH2PO4。低磷处理中磷浓度为 0.1 mmol/L KH2PO4,其余钾离子由KCl替代补齐。高磷处理中磷浓度为 5 mmol/L NaH2PO4,缺失的钾由 KCl替代补齐。移栽后,浇1/4的营养液300 mL,隔天浇一次。培养至7天,隔天浇1/2的营养液300 mL。培养至14天,浇全营养液,每天浇一次500 mL,每次浇完营养液将渗出的液体倒掉。每周浇一次去离子水1 L (避免盐害)。培养至28天开始不同供磷处理,每个处理7盆。培养至35天对烟株进行打顶(模拟生产实践)后继续培养至42天收获样品,收获前拍照记录。
1.2 样品收获与养分测定
收获提取总RNA样品:将烟株的根、茎、叶和腋芽,用铝箔纸包裹后立即在液氮中速冻,随后保存于-80℃备用。
收获用于测定养分浓度的样品:根、上部叶(从上往下4片叶)、下部叶(除去上部4片叶的全部叶片)、上部茎(上部叶对应的茎部)、下部茎(下部叶对应的茎部)、腋芽,分别用自来水洗涤,再用去离子水洗涤后放入烘箱(105℃)杀青0.5 h后,65℃烘干至恒重,称重记录,随后用不锈钢粉样机磨碎用于测定养分含量。
样品分析时,首先加入HNO3–H2O2,用微波消解仪 (CEM, Matthew, NC, USA)对样品进行消解。然后运用电感耦合等离子发射光谱仪(ICP-OES, OPTIMA 3300 DV, Perkins-Elmer, USA)对消解液中的养分浓度进行测定。整个分析过程中,用标准样品IPE684和IPE126对消解过程和测定过程进行质量监控。
1.3 启动子序列中含有磷调控顺式元件P1BS的基因鉴定
基于本团队前期已积累的根部转录组数据(PRJNA 649315),运用自定义Perl脚本在转录起始位点上游2 kb序列区域内,搜索磷调控顺式元件P1BS(5′–GNATATNC–3′),统计分析其数量和所在位置[19]。
1.4 实时荧光定量PCR分析(RT-qPCR)
RNA提取采用Trizol法(Invitrogen)。随后,运用 Prime ScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time, Takara)进行 cDNA 合成。合成的cDNA 经过 5 倍稀释后体积为 100 μL,取 2 μL 用于25 μL体系PCR反应。基因特异性引物见附表1。PCR反应程序为:95℃预变性2 min,40个循环程序 (95℃ 变性 15 s,60℃ 退火 30 s,72℃ 延伸 30 s)[20]。数据处理运用比较CT值法计算基因的相对表达量[21]。每个处理至少3个生物学重复和3个技术重复,同时设置阴性对照,采用泛素连接酶基因(evm.TU.HIC_ASM_12.2258)为内参对照。
1.5 酵母单杂与原生质体瞬时转化、EMSA
首先,酵母单杂部分,运用附表1的引物构建pAbAi酵母重组质粒,测序后利用BstBI线性化载体转入Y1HGold菌株,获得重组酵母菌。涂布于SD/-Ura/AbAn上筛选抑制各个酵母菌生长的金担子素(aureobasidin A,简称AbA)最低浓度。进一步利用重组酵母菌株制备感受态,并将NtPHR2-pGADT7(NtPHR2-AD) 转化感受态。得到含有靶基因和顺式元件的重组酵母菌,涂布于含有相应AbA背景浓度的培养基SD/-Leu/AbAn上,30℃倒置培养观察。其次,进行原生质体转化与双荧光素酶(dual luciferase reporter gene assay, LUC)分析,
将NtPHR2的编码序列克隆到载体pGreen ǁ 62-SK (效应子,effector)中,同时将靶基因的~1500-bp 启动子序列克隆到载体 pGreen II 0800-LUC (报告子,reporter)中,测序验证后,共转原生质体。同时以 pGreen ǁ 62-SK (效应子,effector)空载体与连接靶基因启动子的 pGreen II 0800-LUC (报告子,reporter)重组载体共转原生质体作为对照。后续实验运用酶标仪,参考本小组原有的标准方法测定萤火虫萤光素酶(LUC)和海肾萤光素酶(REN)的活性,计算LUC/REN值,具体步骤参见相关文献[22]。
将重组载体PET28a-NtPHR2转化大肠杆菌BL21,进行蛋白表达并纯化(Ni-NTA 纯化树脂预装柱C600791/C600793购自上海生工生物工程有限公司)。随后进行探针准备,凝胶制备与跑胶,转膜与交联。最后进行膜封闭、抗体孵育以及显色曝光获取图片等,按照试剂盒[LightShift®Chemiluminescent EMSA Kit (20148)与 Chemiluminescent Nucleic Acid Detection Module (89880)购自 Thermo Fisher Scientific]进行[22]。具体采用的引物和探针序列见附表1。
1.6 统计分析
数据分析,采用SAS统计软件包进行统计分析(SAS Institute Inc., 2001)。
2 结果与分析
2.1 低磷与过量供磷显著抑制烟株生长
图1结果显示,与对照条件和高磷处理相比,低磷处理的烟株叶片浅绿,叶片较小且下部叶明显衰老(图1A)。其次,低磷处理的烟株根系生物量明显偏少(图1B)。

图1 不同供磷水平下烤烟地上部和根系Fig. 1 The shoot and root of tobacco under different P supply levels
烟株收获后,对其干物质量统计分析发现,低磷显著抑制根部干物质量累积,但过量供磷并未增加根部干物质量(表1)。除茎和下部叶片外,低磷和过量供磷条件下的上部叶和腋芽干物质量累积显著低于对照条件下(表1)。以上结果表明,不同供磷水平,显著影响烟株根部和地上部干物质量。低磷向优化施磷(对照)的过程中,植株的干物质量呈显著增加的趋势,但过量施磷不会导致干物质量的进一步增加,反而会抑制烟株发育以及地上部干物质量累积。

表1 不同供磷水平下烟株各组织器官与整株干物质量 (g)Table 1 Dry matter of tobacco plant parts under differential P supply levels
2.2 供磷水平对烟株磷及其他矿质元素浓度的影响
随着供磷水平从低(LP)、正常(对照)到高(HP),烟株体内各组织器官中的磷浓度显著提高(图2),只有腋芽组织中,低磷条件下的磷含量高于对照,这可能是由于磷从其他部位向幼嫩部位(营养中心)转运增加。
本研究发现,低磷和高磷处理下的根系钾浓度均低于对照烟株根系,但地上部各组织,高磷处理时钾浓度随之升高,包括下部茎和上部茎、下部叶片和上部叶片以及腋芽组织。同时,我们发现低磷处理烟株的根系和地上部叶片中的钙浓度低于对照烟株。低磷处理的烟株根系和叶片(下部和上部)中镁浓度低于对照烟株,但高磷不会降低烟株地上部组织中的镁浓度,且发现高磷处理的烟株上部叶片和腋芽组织中镁浓度高于对照烟株(图2)。

图2 不同供磷水平下烟株磷、钾和钙、镁养分浓度Fig. 2 Concentrations of P, K, Ca and Mg in tobacco plant under different P supply levels
研究结果发现,低磷和高磷处理根系的微量元素铁、铜和锌浓度与对照无显著差异。低磷处理下烟株根系中锰浓度低于对照及高磷烟株。低磷和高磷处理的烟株地上部叶片中铁、锌和锰的浓度均低于对照烟株,但铜浓度在对照和高磷处理间无显著差异(图3)。

图3 不同供磷水平下烟株微量元素浓度Fig. 3 Micronutrient concentrations in tobacco plant under different P supply levels
2.3 供磷水平对烟株体内磷与其他矿质元素分配的影响
从表2结果可以发现,提高供磷水平显著降低了地上部磷元素的分配。与对照和高磷处理相比,低磷处理根系中钙、锰和锌的分布显著降低,表明常规和高磷处理促进了钙、锰和锌向地上部的转移。低磷和高磷处理均会促进镁和钾向地上部转移。供磷水平对铁和铜元素的分配没有显著影响。

表2 不同供磷水平下烟株各组织器官中养分的分配率(%)Table 2 Distribution percentage of a nutrient in tobacco plant parts as affected by Papplication levels
2.4 启动子区域具有P1BS顺式作用元件的矿质养分吸收与转运的相关基因筛选及其验证
低磷处理时,植物会产生一系列复杂的系统信号以维持磷稳态,PHR是这一调控网络的关键中心转录因子,主要通过与下游靶基因启动子区域的P1BS(5′-GNATATNC-3′)顺式作用元件结合调控其表达[23]。根中基因表达对磷营养变化的响应比地上部敏感,因此,我们运用前期已有根部转录组数据,筛选启动子区域具有P1BS顺式作用元件的基因。
经分析,烟株根部有12,850个基因在上游启动子2 kb序列中具有P1BS顺式作用元件,从中筛选出与养分吸收和转运相关的基因86个(附表2)。从中挑选出12个磷、钾、钙、镁以及铁、铜和锌转运蛋白基因,分析它们在不同供磷水平处理的根系组织中的表达量。结果发现,其中两个磷转运蛋白基因在低磷和高磷处理时,均上调表达(图4A、B)。在低磷和高磷处理时,两个钾转运蛋白基因均上调表达(图4C、D)。钙和镁转运蛋白基因在低磷或高磷处理时,表达量上调(图4E—G)。此外,其中的两个铁转运蛋白基因,在低磷和高磷处理时,表达量也上调(图4H、I)。其中一个铜转运蛋白基因在低磷处理时上调表达,在高磷处理时下调表达(图4J)。在低磷和高磷处理时,其中一个锌转运蛋白基因的表达上调,而另一个锌转运蛋白基因的表达量下降(图 4K、L)。
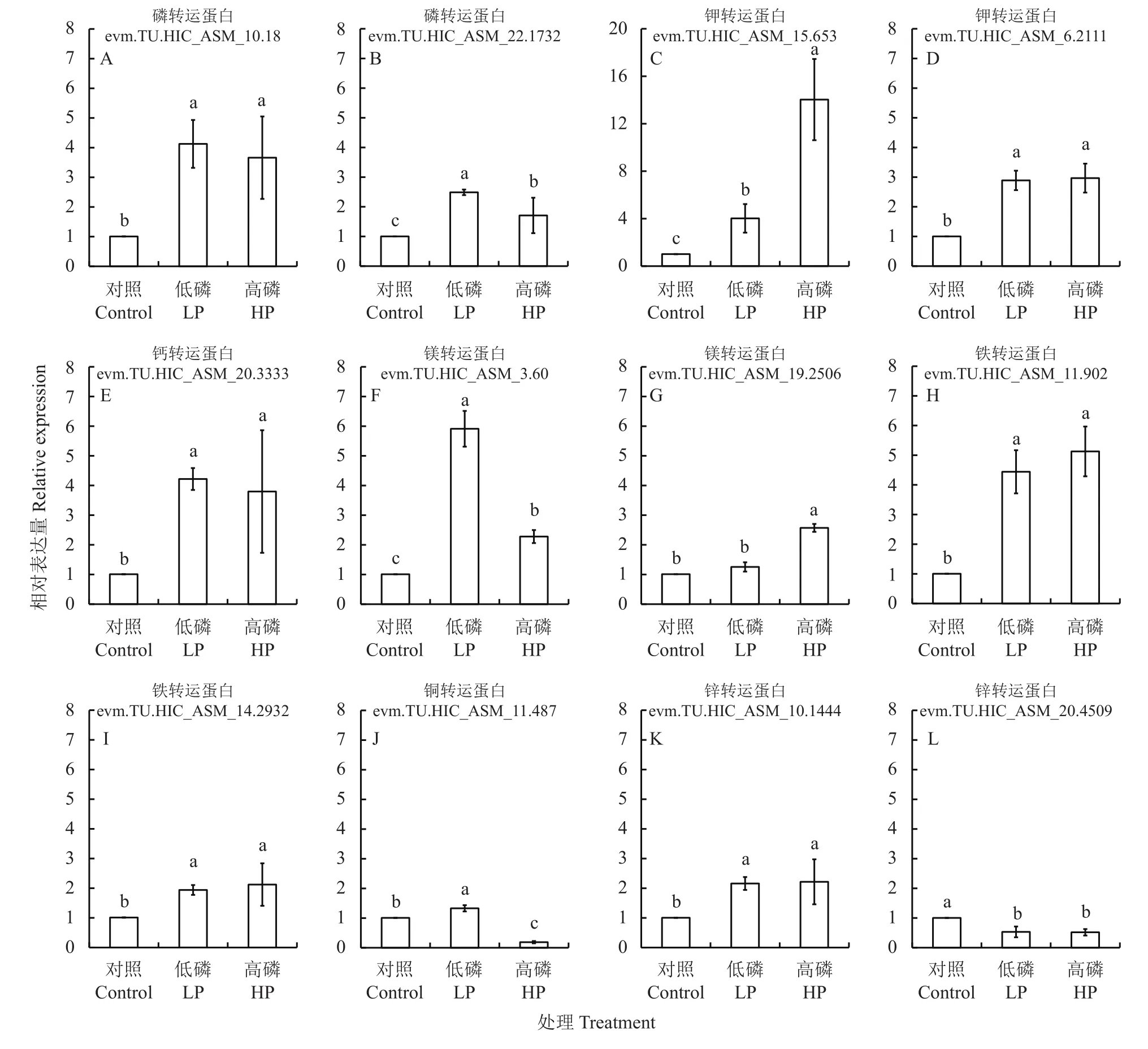
图4 荧光定量PCR验证附表2中选取的12个基因对低磷和高磷的响应Fig. 4 RT-qPCR validation of expression levels of twelve selected genes in response to LP and HP
2.5 NtPHR2可直接调控钾和镁转运蛋白基因
钾和镁转运蛋白基因是否受NtPHR2直接调控,依次通过酵母单杂、原生质体瞬时转化验证,随后设计生物素标记探针进行凝胶阻滞试验(EMSA),从体外证明NtPHR2能直接结合到钾转运蛋白(K+transporter/evm.TU.HIC_ASM_15.653)和镁转运蛋白启动子 (CorA-like Mg2+transporter protein/evm.TU.HIC_ASM_3.60)(图5)。因此,本研究结果证明,NtPHR2通过结合P1BS顺式元件直接调控钾和镁转运蛋白基因
3 讨论
3.1 缺磷与过量供磷抑制烟株生长和地上部生物量积累
在本研究中,我们发现烟株对供磷水平非常敏感,低磷和高磷处理均显著降低烟株地上部干物质量的累积,但高磷处理时,烟株根系干物质量与对照无显著差异(表1)。正如我们预期,烟株对磷的吸收以及向地上部转运量随供磷水平增加而增加(图2),且过量供磷导致根系磷累积量的增加可能具有降低根系活力的毒性效应[11]。与已有田间试验结果一致,小麦地上部生物量积累随着施磷量的增加而增加,但过量施磷不会导致生物量的进一步增加[14]。
3.2 烟株体内磷养分与其他矿质养分之间存在广泛的交互作用
在此研究中,我们发现随着供磷水平增加,烟株体内磷与其他矿质养分浓度与交互作用随之发生变化。同时,不同供磷水平对不同矿质养分的影响并不一致。
烤烟中钾的含量是衡量烟叶品质的重要指标之一。我们的研究结果表明,高磷条件下烟株叶片中钾浓度高于对照和低磷(图2)。同时,低磷和高磷条件下根系中钾的分配比例变低(表2),表明低磷与过量供磷均会促进钾从根系向地上部转移。此外,烟株中钾转运蛋白基因启动子中具有P1BS顺式调控元件(附表2),同时,其中两个钾转运蛋白基因均上调表达(图4C、D),并有试验证明其中一个钾转运蛋白基因受到NtPHR2的直接调控(图5A)。这些结果综合表明,烟株中钾转运蛋白直接响应磷胁迫,存在较强的交互作用。这与其他作物中的研究结果一致,包括水稻中钾转运蛋白基因受到低磷胁迫的强烈诱导[7],以及烟株中磷转运蛋白基因在缺钾条件下显著上调,包括PHO1、PHT1;8、PHT1;9和PHT4;5[8]。
与钾的研究结果一致,高磷条件下的烟株叶片中镁浓度高于对照,低磷条件下烟株叶片中镁浓度最低。此外,我们筛选到11个镁转运蛋白基因具有P1BS顺式调控元件(附表2),同时,RT-qPCR分析验证其中两个镁转运蛋白基因,分别在低磷或高磷处理时,表达量上调(图4F、G),其中一个镁转白蛋白基因受到NtPHR2的直接调控(图5B),进一步说明磷和镁之间存在直接的交互作用。磷和钙是不相容离子,钙可与磷及其衍生物形成不溶性化合物参与协调磷胁迫反应。前人研究发现,施用钙肥会促进烟株叶片中钙浓度升高,但会导致烟株中磷由根部向地上部叶片中的分配降低[10–11]。与此研究结果一致,本研究结果显示低磷胁迫降低烟株根部和上部叶片中钙浓度,并促进钙从根部向地上部转移(图2和表2)。同时,高磷处理也降低烟株体内上部叶片的钙浓度(图3)。其次,我们也筛选到14个钙转运相关基因具有P1BS顺式作用元件,并验证其中钙转运蛋白基因(evm.TU.HIC_ASM_20.3333)在低磷和高磷条件下显著上调(图4E),综合表明磷和钙相互作用调节养分水平参与烟株发育过程。实际上镁作为几种激酶的激活剂,能激活大部分涉及磷酸盐转移的反应[24]。并且从植物营养学角度看,镁从根部到地上部的转移依赖磷的供应[25]。研究也表明大豆中磷能促进镁的吸收,磷镁存在互作,并受到大豆的基因型影响[26]。花生中的研究也表明,磷钙合理配施可提高花生磷钙吸收效率[27]。因此,在农业生产中,进行磷肥、镁肥和钙肥的合理配合施用,更有利于烟草高产高效的栽培。

图5 NtPHR2直接结合于钾和镁转运蛋白基因启动子中P1BS元件Fig. 5 NtPHR2 directly binds toP1BS in the promoter of K and Mg transporter genes
值得关注的是,不合理的供磷量也会显著影响烟株体内微量元素的浓度。在小麦、玉米、大豆、棉花和番茄的相关研究结果中显示,施磷量与磷浓度呈正相关,但与地上部锌浓度呈负相关[12–15]。但研究结果也显示,在不同物种不同生育期养分之间的交互作用表现并不完全相同。在本研究中,铁、锌和锰养分在地上部组织器官中受不同供磷水平影响表现相似。与对照相比,低磷和高磷处理的烟株上部叶片中锌和锰浓度均显著降低(图3)。低磷胁迫促进锌和锰由根部向地上部转运(表2)。同时,我们筛选到13个锌转运蛋白基因具有P1BS顺式作用元件(附表2),并通过实验验证其中两个锌转运蛋白基因受到低磷与高磷的显著调控(图4K、L),进一步说明烟株中磷与锌元素间存在交互作用。前人在大麦的研究中发现,缺锌会诱导低磷和对照条件下的磷转运蛋白基因的上调表达,从而促进地上部磷累积[16]。在番茄的研究中发现施磷会促进锰的吸收[12],这与我们研究结果相反,再次表明各元素间的交互作用存在物种特异性。此研究结果将提示我们,与其他物种的响应不同,烟草中磷与锰元素存在拮抗作用,所以在烟草种植过程中,提高磷施用量可能会降低烟株锰的吸收。此外,我们的研究结果发现,与对照相比,低磷和高磷处理的烟株上部叶片的铁浓度降低(图3)。我们鉴定到4个铁转运蛋白基因具有P1BS顺式调控元件(附表2),并通过实验验证两个铁转运蛋白基因,在低磷和高磷处理时,表达量显著上调(图4H、I)。这些结果说明磷和铁在烟株中存在强烈的交互作用,磷养分失调将导致烟株缺铁,可能促进铁转运蛋白基因表达量上调。但在拟南芥和水稻幼苗期,缺磷会导致铁养分的显著累积[8,17–18]。此外,研究也发现缺磷胁迫条件下,铁转运蛋白基因AtIRT1表达下降,通过生理数据分析发现这与缺磷植株中铁浓度增加有关[28]。因此,烟株种植过程中,磷肥正常施用范围内,可促进铁的吸收,过量供磷胁迫可能对铁吸收利用造成干扰,将导致烟株出现铁吸收下降的现象。最后,我们发现,与对照相比,低磷处理的烟株地上部叶片的铜浓度降低(图3),且发现部分铜转运蛋白基因具有P1BS顺式调控元件(附表2)并受到低磷和高磷的差异调控(图4J)。与此结果一致的是缺磷增加了大豆中铜转运蛋白基因的表达[19]。
4 结论
我们的研究结果证明,除钾和镁外,烟株上部叶片中矿质养分的吸收受到过量供磷的负面影响,这些元素的调控基因对缺磷和磷过量均有一定的响应。结合已有的转录组数据,我们采用筛选顺式调控元件(P1BS)和RT-qPCR验证,鉴定到受NtPHR2基因直接调控的钾转运蛋白和镁转运蛋白。因此,磷对其他矿质营养的吸收利用的影响不仅限于土壤和根系。
附表 1 本研究中使用的引物序列Supplyment table 1 Primers used in this study

附表 2 含有P1BS顺式调控元件并参与矿质营养物质吸收与转运相关基因Supplyment table 2 List of genes harboredP1BS motif and involved in uptake and translocation of the mineral nutrients

续附表 2 Table 2 continued

