螯合–缓冲营养液培养条件下添加外源锌对小麦幼苗生长和TaZIPs基因表达的影响
李广鑫,赵 鹏,睢福庆,刘红恩,秦世玉,段 然,杨艳征,王 云,李 畅
(河南农业大学资源与环境学院/河南省土壤污染修复重点实验室,河南郑州 450002)
锌(Zn)是动植物所必需的微量营养元素,在生长发育、生殖遗传等生理过程中能够激活促进与生长和代谢相关的酶,并产生在DNA复制和转录中发挥重要作用的含锌金属蛋白,从而控制相关基因的表达[1–2]。锌通常以二价离子的形式被植物所吸收,外源供锌可以有效提高作物的产量和锌含量[3–4]。锌缺乏和锌过量的生理范围较窄,一般茎叶中的锌含量在 10~100 mg/kg,当超过 300 mg/kg 时,锌的毒害作用较为明显[5–6]。Broadley等[6]研究发现小麦中的锌浓度会随锌供应的增加而显著提高,过多的锌致使大量的重金属离子进入植物的原始平衡系统,导致代谢紊乱。侯雷平等[7]研究发现缺锌或高锌均会导致番茄叶片的叶绿素含量下降,而适量供锌可促进植株根系伸长,根系活力增强;同时还可提高剑麻叶片叶绿素含量,增强光合作用,促进碳水化合物的合成和代谢[8]。
研究表明,植物本身为获得适当的锌营养也进化出了复杂的感知和响应机制[9],如调节根对锌的吸收,以减轻锌有效性的变化[10]。植物体内的Zn2+平衡与锌转运蛋白基因家族密不可分,而ZIP转运蛋白被认为是植物适应土壤中锌有效性低和变化的关键基因[11–12]。植物的生长发育过程受到基因表达方式的严格调控。某些基因在植物生长的各个阶段持续表达,其基因表达水平几乎不受外界环境的影响,这类基因表达称为组成型表达;与之相对的是一些基因表达极易受环境变化的影响,在特定的环境信号刺激下,这些基因被激活,基因表达产物增加,这种表达方式称为诱导性表达。有报道称,在中国春小麦(Triticum dicoccoides-nudigl)中,TaZIP3、TaZIP6、TaZIP7、TaZIP9和TaZIP13基因的表达受缺锌诱导(也称诱导性表达)[13],这些基因的表达在一定程度上均会对作物的锌肥利用率产生影响,但关于其受锌影响的变化和作用机制尚不十分明确。
因此,本试验通过采用螯合–缓冲营养液培养来模拟土壤缺锌环境,研究不同供锌水平对小麦的生长、光合作用、离子平衡以及ZIP转运蛋白基因表达的影响,从生理和分子水平上揭示小麦植株体内锌离子平衡的作用机制,以期为农业生产中锌肥的平衡施用提供理论支撑。
1 材料与方法
1.1 供试材料和试验设计
供试小麦品种为‘百农207’。试验选取颗粒饱满、大小一致的种子,在10% NaClO溶液中浸泡消毒5 min,用自来水冲洗干净后,再用蒸馏水和去离子水各清洗3次后,在去离子水中浸泡24 h,将吸胀后的种子放置在湿润的棉纱上进行催芽。供试营养液为螯合–缓冲营养液[14],其基本配方为:1.5 mmol/L KNO3、0.6 mmol/L NH4H2PO4、0.25 mmol/L MgSO4·7H2O、1.0 mmol/L Ca(NO3)2·4H2O、2.56 mmol/L MES (pH 为 6.1)、20 μmol/L EDTA-Fe、12.5 μmol/L H3BO3、3.0 μmol/L MnSO4、0.1 μmol/L H2MoO4、0.1 μmol/L NiSO4、2.8 μmol/L CuSO4·5H2O、50 μmol/L K3-HEDTA,营养液 pH 为 6.1。
试验共设置5个营养液供Zn水平:0、0.05、0.25、1.0、2.5 mg/L,相当于 Zn 0、0.76、3.82、15.30、38.23 μmol/L,以 ZnSO4∙7H2O 形式加入,各处理营养液要保持pH一致(通过NaOH和HCl调节pH)。选择长势一致的幼苗移栽到含有2 L螯合-缓冲营养液的黑色塑料容器中,每个塑料容器中种植10棵小麦苗。试验在温湿可控的人工光照培养室中进行,温度为25℃±5℃,湿度75%±1%,光照/黑暗时间分别为14 h/10 h。待幼苗长至一叶一心时,首先使用1/4和1/2的螯合-缓冲营养液分别培养3天后,再选择全营养液进行培养,同时进行供锌处理,每个处理重复4次,每3天更换1次营养液。在配制锌溶液时,要求ZnSO4∙7H2O与等物质的量的K3-HEDTA混合平衡后使用。
试验在锌处理3周后收获取样,采集测定小麦植株长度、生物量、光合参数、锌铁等金属离子含量等指标,部分样品经液氮冷冻后保存于-80℃超低温冰箱中。选择0、0.25、2.5 mg/L供锌处理下的小麦幼苗进行基因表达分析。
1.2 测定指标与方法
1.2.1 根系形态及幼苗生长 处理14天时,每个处理随机选取 4 株完整的小麦植株,采用根系扫描仪 (V700PHOTO, Epson, Japan)和数据分析软件 Win RHI-ZO Version 2009 PRO (Regent Instruments,Quebec City, Canada)分别对根系总长 (RL)、根系表面积(RSA)、根体积(RV)和平均根直径(RAD)进行扫描分析,测定根系形态。
在供锌处理21天时,用刻度尺测量幼苗茎基部至顶端叶尖的长度,即为株高,根尖到幼苗茎基部的长度即为根长。将小麦植株在105℃下杀青30 min,70℃下烘干至恒重后,地上部和根部分开称重。
1.2.2 光合参数 处理14天时,选取小麦幼苗完全展开的倒二叶,用便携式光合测定系统(LI-6400XT, USA)测定叶片面积,根据叶面积换算得出小麦叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。
1.2.3 微量元素含量 将小麦地上部和根部粉碎后,采用 HNO3∶HClO4(87∶13,V/V)混酸提取,石墨消解炉 (EHD36,Lab Tech Ltd, USA)消解,原子吸收分光光度法 (ZEEnit 700;Analytik. Jena AG,Germany)测定小麦Zn、Cu、Fe、Mn含量。
1.2.4 RNA 提取及实时荧光定量 PCR (qRT-PCR)用Trizol试剂(Invitrogen, USA)提取小麦根部和地上部的总RNA,去除基因组DNA后,使用 M-MLV逆转录酶(Fermentas,USA)和dT18寡核苷酸引物将 RNA 反转录为 cDNA。使用 ABI Quant Studio 3 实时荧光 PCR 系统和 SYBR Green Kit (Takara)进行实时 qRT-PCR。PCR 条件为预变性 95℃ 30 s,40 个循环 95℃ 10 s,60℃ 30 s,融解曲线 95℃ 15 s,60℃60 s,95℃ 15 s。3 个生物重复被用于转录分析,每个cDNA 样本进行了3次技术重复。相关基因的引物序列见表1。

表1 引物序列与相关信息Table 1 Sequences and related information of primers used in this study
1.3 数据统计与分析
所有试验均采用完全随机设计,重复4次。试验数据使用Microsoft Excel进行统计,采用SPSS 22.0 (Chicago, USA)软件进行方差分析和差异显著性分析,采用单因素方差分析(one-way ANOVA)和LSD法进行多重比较(P<0.05),使用Sigmaplot 10.0作图。
2 结果与分析
2.1 不同供锌水平对小麦幼苗生长的影响
由图1可知,随着供锌浓度的增加,小麦幼苗的根长和株高呈先升后降的趋势,以Zn0.05处理的小麦幼苗的根长和株高最大,分别为46.18和35.47 cm,是Zn0处理的1.24和1.22倍;随着供锌浓度的进一步增加,小麦幼苗的根长和株高呈下降趋势,但仍高于Zn0处理,其中,Zn0.05与Zn0.25处理的根长无显著性差异。

图1 不同供锌水平下小麦幼苗的生长情况Fig. 1 Growth of wheat seedlings under different Zn levels
2.2 不同供锌水平对小麦幼苗生物量的影响
由图2可知,无论供锌水平如何,小麦幼苗的地上部干重均高于根部。小麦幼苗的干重在Zn0.05处理时达到最大,随着供锌浓度的进一步增加,呈下降的趋势。与Zn0处理相比,供锌后(Zn0.05、Zn0.25、Zn1.0、Zn2.5)的小麦幼苗根部干重分别提高了35.91%、20.19%、–1.05%、–13.89%,地上部干重分别提高了34.39%、16.66%、–2.55%、–8.08%。随着供锌浓度的进一步提高,小麦幼苗干重呈下降趋势,且对根部干重影响较大。缺锌(Zn0)和高锌(Zn1.0、Zn2.5)处理下小麦幼苗的生物量较Zn0.05处理下降了25.6%~31.6%。可见,常规供锌浓度(0.05、0.25 mg/L)可以显著促进小麦幼苗的生物量累积,而高锌则会显著抑制小麦的生长发育,这与锌对小麦幼苗根长和株高的影响基本一致。

图2 不同供锌水平下小麦幼苗的生物量Fig. 2 Biomass of wheat seedlings under different Zn levels
2.3 不同供锌水平对小麦幼苗根系形态的影响
如表2所示,小麦幼苗的根部总根长、表面积、体积和平均直径均随着供锌水平的提高呈先增后降的趋势,小麦幼苗的总根长在Zn1.0处理最大,根表面积、根体积、根平均直径均在Zn0.25处理下达到最大。常规锌(Zn0.05、Zn0.25)处理下根系形态指标较Zn0处理增加了0.30%~27.0%。而Zn0以及Zn2.5处理下根系形态指标较Zn0.25处理下降了1.3%~21.2%,显著抑制了幼苗的根系形态发育,影响到了地上部的生长。

表2 不同供锌水平下小麦幼苗的根系形态Table 2 Root morphology of wheat seedlings under different Zn levels
2.4 不同供锌水平对小麦幼苗锌含量和锌累积量的影响
由图3可知,小麦幼苗的锌含量和锌累积量均随供锌水平的升高而增加。Zn0.05、Zn0.25、Zn1.0、Zn2.5处理的小麦幼苗根部的锌含量较Zn0处理分别增加了125.01%、138.32%、533.99%、1047.97%,地上部分别增加了170.54%、226.27%、491.26%、656.44 %;同样,根部锌累积量较Zn0处理分别增加了213.40%、188.34%、538.59%、1015.01%,地上部分别增加了219.08%、280.40%、474.14%、614.39 %。小麦幼苗锌含量和锌累积量均表现为根部>地上部。

图3 不同供锌水平下小麦幼苗各器官的锌含量和锌累积量Fig. 3 Zn content and accumulation in the roots and shoots of wheat seedlings under different Zn levels
小麦幼苗体内的锌转运系数在Zn0.25处理下最高,为Zn0处理的1.37倍(图4)。高锌(Zn1.0、Zn2.5)处理下,转运能力显著低于常规供锌(Zn0.05、Zn0.25)处理,缓解了对地上部的毒害作用。

图4 不同供锌水平下小麦幼苗体内的锌转运系数Fig. 4 Zn translocation factor in wheat seedlings under different Zn levels
2.5 不同供锌水平对小麦幼苗体内Cu、Fe、Mn吸收的影响
如图5所示,小麦幼苗体内的Cu、Fe、Mn含量显著受到供锌浓度的影响。Zn0处理下小麦体内的Cu、Fe、Mn吸收最高,随着供锌浓度的增加,Cu、Fe、Mn吸收呈下降趋势。小麦幼苗根部的Mn吸收较Zn0处理降低了19.13%~49.14%,地上部降低了6.70%~18.92%;根部Fe吸收降低了50.49%~78.66%,地上部降低了14.32%~34.01%;根部Cu吸收降低了34.21%~44.33%,地上部降低了19.80%~32.12%。可见,在小麦幼苗的体内,金属离子Cu、Fe、Mn与Zn之间存在着拮抗作用,且Zn对Fe的拮抗能力显著强于对Cu和Mn。
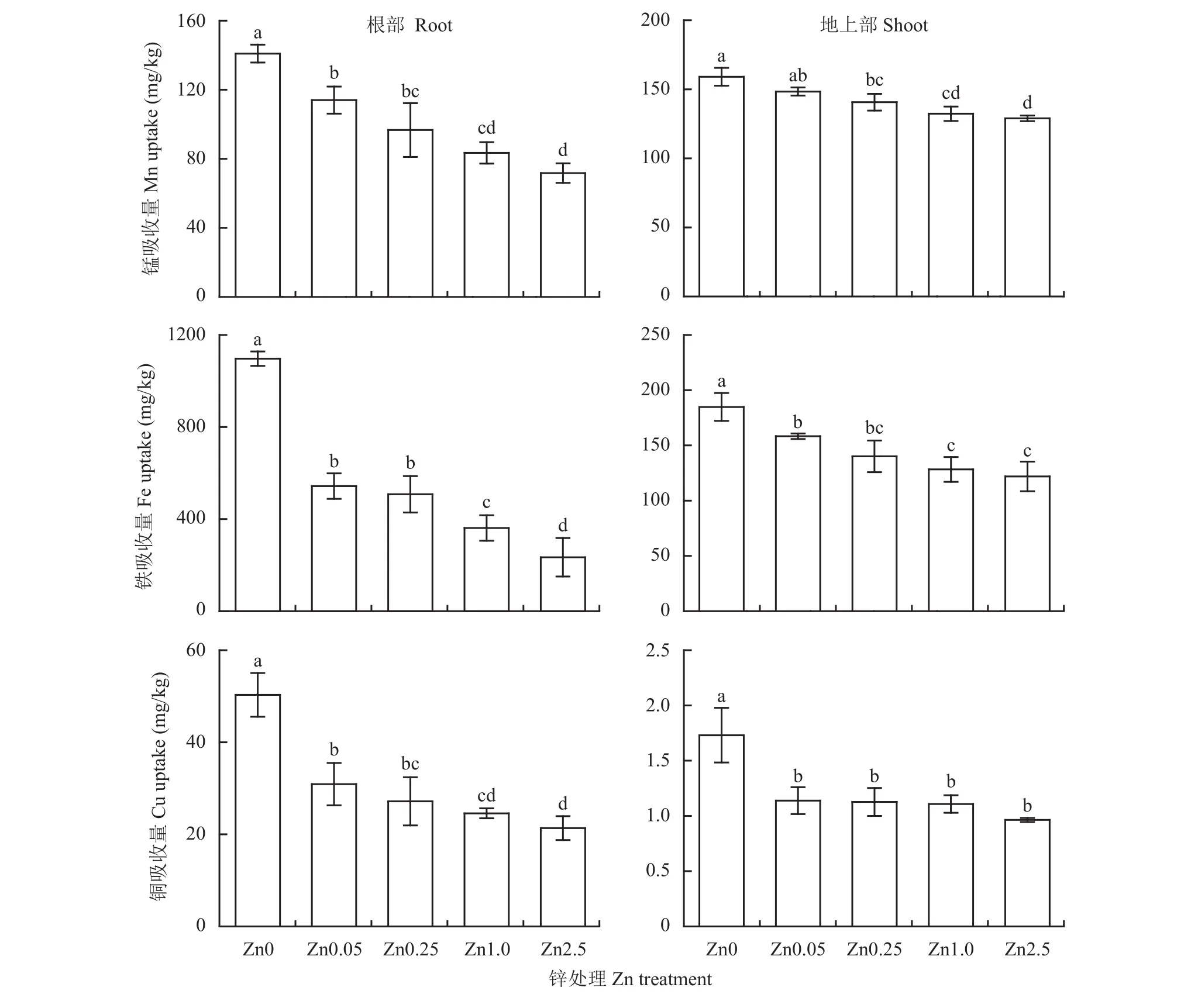
图5 不同供锌水平下小麦幼苗根部和地上部Cu、Fe、Mn吸收量Fig. 5 Cu, Fe, and Mn uptake in roots and shoots of wheat seedlings under different Zn levels
Zn含量与Cu、Fe、Mn含量之间存在负相关关系(表3)。根系Zn含量与Cu、Fe、Mn含量的相关系数(r)分别为–0.73、–0.74、–0.79,均达到0.05水平,而地上部之间的相关系数分别为–0.66、–0.81、–0.85,与Cu含量之间的相关性不显著,而与Fe和Mn的负相关性达到0.01水平。这些结果进一步证明了在小麦幼苗体内Zn与某些金属离子之间存在着拮抗机制。

表3 不同供锌水平下小麦根部和地上部锌与铜、铁、锰含量之间的相关性分析Table 3 Correlation of Cu, Fe, and Mn content with Zn content in the root and shoot of wheat seedlings
2.6 不同供锌水平对小麦幼苗叶片光合参数的影响
由图6可知,小麦幼苗的光合参数随供锌浓度的增加呈先增后降的趋势,且均在Zn0.25处理达到最大。随着供Zn浓度的增加,叶片气孔导度(Gs)和蒸腾速率(Tr)较Zn0处理分别提高了42.86%~58.11%、40.39%~55.40%;常规供锌(0.05、0.25 mg/L)水平时,胞间CO2浓度(Ci)和净光合速率(Pn)较Zn0处理分别提高了3.55%~8.66%、10.07%~15.97%。而高 Zn (1.0、2.5 mg/L)供应后,叶片的光合参数 (Gs、Tr、Ci、Pn)较Zn0.25处理分别下降了6.22%~9.64%、5.00%~9.66%、14.07%~16.69%、8.15%~10.51%。由此可知,适量的供锌浓度有利于提高小麦幼苗的光合能力,促进干物质重的累积,但并非越高越好。

图6 不同供锌水平下小麦幼苗叶片的光合参数Fig. 6 Photosynthetic parameter of wheat seedlings under different Zn levels
2.7 锌对小麦幼苗体内Zn2+平衡关键基因表达的影响
根据小麦相关生理指标结果的分析,选用0、0.05、2.5 mg/L这3个供锌浓度测定小麦根部和地上部TaZIP3、TaZIP5、TaZIP6、TaZIP7和TaZIP13的基因表达量(图 7)。可知,TaZIP3、TaZIP5、TaZIP7和TaZIP13在根系和地上部的基因表达量均在Zn0时最高,在Zn2.5时最低,TaZIP7和TaZIP13在地上部的基因表达趋势与根系一致,而TaZIP3和TaZIP5在地上部的表达几乎不受锌浓度变化的影响。表明这些基因显著受缺锌信号调控,缺锌诱导了小麦上调这些基因的表达量。TaZIP6在根系中呈组成性表达,其相对表达量几乎不受供锌浓度的影响,而在地上部的相对表达量则随供锌浓度的提高而增加,表明其主要作用与其他几个基因不同,可能主要参与了锌的转运。

图7 不同外源供锌水平下小麦幼苗根部和地上部Zn2+平衡关键基因的相对表达量Fig. 7 Relative expression of genes related to Zn2+ homeostasis in the roots and shoots of wheat seedlings under different exogenous Zn supply levels
3 讨论
锌的缺乏和过量都会影响植物的生理代谢[15],降低作物幼苗的生长速率和干重[16]。本试验中,无外源锌处理(Zn0)和高锌处理(Zn1.0、Zn2.5)下,小麦幼苗生长、根系发育以及干物质重均低于常规供锌水平(Zn0.05、Zn0.25)处理,显示了一定的抑制效果,这与邢飞等[17]、闫志刚等[18]、韩金玲等[19]研究结果相一致。多项研究表明,施锌能明显提高小麦植株中的锌含量,促进锌在植株中的积累[3–4, 7, 16]。姜丽娜等[20]研究发现,外源锌供应能够明显提高小麦幼苗根和芽中的锌含量和锌累积量;汪洪等[21]也发现施锌提高了玉米植株中的锌浓度和吸收量,促进了锌向地上部的转运。本研究证实了供锌可以明显提高小麦幼苗根部和地上部的锌含量和锌累积量,这一结果与Cherif等[22]在番茄上的研究结果相一致。同样,有研究表明,植株地上部的锌含量通常在10~100 mg/kg,且含量超过300 mg/kg时,作物会出现毒害症状[6]。而在本研究中,小麦幼苗地上部锌含量在高锌(2.5 mg/L)水平下达到了364.17 mg/kg,但未表现出明显的毒害症状,这可能与根系作为植物贮藏器官的作用有关[23],导致大量锌在根部累积,减轻了地上部的锌毒害。
锌、铜、铁、锰是植物必需的微量元素,它们在植物体内的稳态具有十分重要的作用[24]。本研究中,Zn与Cu、Fe、Mn的吸收在小麦苗期存在着明显的拮抗作用,随着施锌浓度的增加,小麦幼苗体内的锌含量和累积量显著提高,但Cu、Fe、Mn的吸收显著减少,以往研究也发现在大多数作物中Zn与Cu、Fe、Mn的吸收存在着相互拮抗作用[25–26],而这种拮抗的产生可能是由于Zn和其他金属离子与氨基酸结合于同一位点上[27]。高锌供应会干扰植物体内其他金属离子的吸收、转运和分配,影响植株体内离子的平衡系统[28]。在本研究中,锌供应后,小麦幼苗根部的Mn、Fe、Cu含量较Zn0处理显著下降,且Fe含量的下降幅度最大。这可能是由于“稀释效应”,施锌促进了干物质的大量累积,从而进一步导致了其他必需微量营养元素含量的下降[29]。
光合参数是植株生长发育的基础,锌的缺乏和过量均会破坏叶肉细胞从而引起光合系统的氧化损伤,导致光合能力下降[30]。光合速率和蒸腾速率是衡量光合作用能力和蒸腾作用强弱的重要指标,其中,胞间CO2浓度(Ci)直接关系到光合速率的变化,而气孔导度(Gs)会直接影响到蒸腾速率。锌缺乏或锌过量均会导致植物体内碳酸酐酶和羧化酶的活性降低,产生,光氧化伤害加重,导致细胞内CO2浓度下降和叶片气孔导度降低,引起植物的光合能力下降[31]。本试验中,常规锌供应后增加了胞间CO2浓度(Ci),提高了光合速率,叶片的气孔导度(Gs)也有所升高,导致叶片的蒸腾速率提高,这一结果与杜新民等[32]在小白菜上的研究结果和Sagardoy等[33]在甜菜上的研究结果相一致。
本研究中,小麦对锌素的缺乏和过量都显示了一定的反应。锌缺乏条件下,小麦的生长发育没有受到明显地抑制,可能是由于处理的时间较短(21天)以及小麦籽粒中本身含有锌,对外源锌的供应需求较小。此外,锌缺乏显著提高了小麦幼苗体内ZIP基因 (TaZIP3、TaZIP5、TaZIP7、TaZIP13)的表达,促进了锌的吸收利用和转运(图7)。目前,在六倍体小麦中共鉴定出了14个TaZIPs基因,而受缺锌诱导的TaZIPs基因表达结果表明ZIP成员可能在锌的吸收和转运中发挥着重要作用[13]。其中有许多作物中的ZIP转运蛋白已经被证明参与了植物体内的锌离子平衡,如:水稻[34]、拟南芥[35]、大麦等[36]。ZIP3、ZIP5、ZIP6、ZIP7和ZIP13属于已经被证实来自拟南芥、水稻和大麦的锌转运ZIP基因系统发育的主要分支,但在小麦中几乎还未被研究[13]。在本研究中,TaZIP3、TaZIP5、TaZIP6、TaZIP7和TaZIP13的基因表达在小麦幼苗的根系和地上部均被检测到,且缺锌显著诱导了TaZIP3、TaZIP5、TaZIP7和TaZIP13在小麦体内的高表达,表明这些基因受到缺锌信号的显著调控,其主要功能可能参与植物养分供应不足时锌的吸收过程。有研究发现,在水稻中,OsZIP3在薄壁细胞和木质部转移细胞中表达,可能负责锌在水稻发育组织中的优先分配[37],而OsZIP4在根和茎中都有表达,可能参与了锌的转运和再分配[38];在大麦中,HvZIP3和HvZIP5的转录水平受到锌缺乏所诱导[39];在野生二粒小麦中,TdZIP1(TaZIP3同源)会在缺锌条件下高度表达[40]。TaZIP7与AtZIP4、AtZIP9、OsZIP7和OsZIP7a密切相关[13],其中,AtZIP4在拟南芥的根和茎中都有表达,然而它的表达没有逆转锌在酵母突变体中(ZHY3和DEY1453)的活性[41],而OsZIP7和OsZIP7a在水稻的茎中受到缺锌诱导,可能参与了锌的转运过程[42]。TaZIP13与HvZIP13、OsZIP8属于最接近的同源基因[13],其中OsZIP8参与水稻中锌的吸收和分配[43],而HvZIP13可能直接参与大麦中锌的运输或在低锌条件下被诱导[44]。本研究中,锌供应降低了TaZIP3、TaZIP5、TaZIP7和TaZIP13在小麦中的表达量。TaZIP6在根系中呈组成性表达,几乎不受外界锌含量变化的影响,而在地上部,其表达量随供锌水平的提高逐渐升高,表明其可能主要参与了锌的转运过程(图7)。Evens等[13]也发现TaZIP6和TaZIP13在小麦根系和茎中的表达模式完全相反。由此可知,TaZIPs基因对于维持小麦植株体内锌离子平衡稳态方面发挥了关键的作用。结合供锌对小麦幼苗各部位离子含量与锌转运系数的影响,表明植物通过调控TaZIPs基因的表达进而调控锌的吸收以及向地上部的转运,从而改变了锌在植株体内的分布,保证了植物的正常生长发育。
4 结论
适量供锌明显改善小麦的光合作用、根系形态以及离子平衡等,从而促进小麦的生长发育,积累更多的干物质。缺锌与过量均会抑制小麦幼苗的生长发育,但小麦适应缺锌与过量的机制不完全一致。缺锌会上调小麦体内锌离子相关基因的表达量来提高对锌的吸收利用和转运;锌过量会减少小麦对Fe、Mn、Cu等微量元素的吸收,以维持小麦体内膜内外的离子平衡,同时,减少了锌向地上部的转运,缓解了锌的毒害。

