竹炭和竹炭包膜复合肥对毛竹林土壤磷有效性的影响及其微生物学机理
朱青和,马 壮,裘 立,董 达*
(1 浙江农林大学环境与资源学院,浙江杭州 311300;2 浙江传超环保科技有限公司,浙江杭州 311122;3 浙江玉禾相约农业开发有限公司,浙江杭州 311300)
磷是植物生长发育所必需的营养元素,参与植物体内的各种生物化学过程,对植物的生长发育和新陈代谢起着不可替代的作用[1]。为了促进作物生长,保障粮食安全,化学肥料特别是磷肥被大量使用。据世界粮农组织(FAO)“展望2030世界肥料趋势”报告指出,2019年全球磷肥消耗量为5135万t,并且以每年2%的速度增长。但是,磷在土壤中极易被固定,向土壤中施加的磷会与土壤矿物结合,造成作物对磷利用率的降低,通常土壤中磷的当季利用率只有10%~25%[2–4]。此外,磷肥的大量使用也极易增加土壤磷素流失风险,造成目前日益严重的水体富营养化问题[5–7]。
土壤中的磷素转化过程主要由微生物介导,涉及多种功能基因,包括参与无机磷溶解和有机磷矿化基因,磷吸收和转运的基因和磷饥饿反应调节的基因[8]。土壤中大量的有机磷只有当其被酶矿化成无机磷后,才能被植物吸收和利用。酶主要由土壤微生物分泌,在土壤磷元素代谢过程中起着非常重要的作用。含有编码碱性磷酸酶基因(phoD、phoA和phoX)和C-P裂解酶基因(phnGHIJLM)的微生物具有矿化土壤有机磷的能力[9]。与phoD相比,我们对phoX和phoA了解并不多[10]。其中,phoD基因被认为是土壤中最重要的磷酸酶基因,在酸性、碱性和中性土壤中均可以被检测到[10–12]。因此,phoD基因常被选择作为研究土壤磷酸酶状况的功能基因。微生物同化无机磷也需要相应的功能基因参与。其中,含有编码磷吸收和转运蛋白酶的pst和pit分别可以在低磷和富磷条件下同化无机磷[13]。参与磷饥饿反应调节基因(phoU、phoR和phoB)使微生物能够利用外部磷源[8]。这些基因,在pst基因的调控下紧密相连,并控制碱性磷酸酶基因(phoD)的表达[14]。
毛竹是我国栽培历史最为悠久、面积最广和经济价值最高的亚热带主要林分,广泛分布于我国长江流域和南方各省区。然而,南方丘陵地带土壤普遍缺磷少钾[15]。大部分农林土壤中有效磷的含量仅为10 mg/kg,远低于世界农林土壤的平均水平。为了提高我国农林土壤的磷素水平,在毛竹林的经营过程中往往采用集约化的经营管理模式[16]。竹林生态系统中有效磷含量已成为制约毛竹增产的主要限制因子。生物炭是植物生物质在完全或部分缺氧的条件下,经热解炭化产生高度芳香化的固态物质,具有高度的稳定性,巨大的比表面积和孔隙率等特性,在改良土壤、固碳减排和缓解土壤养分流失等方面具有巨大的潜力,已成为国内外研究的热点[17–19]。但是,生物炭单独施用,养分供应不足,与常规肥料相比存在作物减产的风险[20–21]。因此,以常规肥料为基质,采用生物炭包膜制备而成的生物炭包膜肥应运而生。生物炭包膜肥施入土壤后可以使肥料养分缓慢释放,具有改善土壤理化性质[22],提高作物养分利用率[23]和减少土壤氮磷流失[24]的作用,已引起了科学界的关注。但是,目前有关生物炭和生物炭包膜肥输入对毛竹林土壤phoD功能菌和磷循环功能基因的研究还鲜有报道。
因此,本研究通过野外林地实验,研究竹炭和竹炭包膜复合肥施用对土壤磷素有效性的影响。在此基础上,通过Miseq和宏基因组测序技术,研究其施用对毛竹林土壤phoD功能菌群落结构和磷循环功能基因相对丰度的影响,从而为竹炭和竹炭包膜复合肥在林业中的大规模应用提供理论支撑。
1 材料和方法
1.1 试验点概况
试验点位于浙江省杭州市(30°14'N、119°42'E),属亚热带季风气候,四季分明,年平均气温16.4℃,降雨量1629 mm,全年日照时数1847 h。土壤类型为红黄壤,基本理化性质如下:容重1.18 g/cm3、pH 5.03 (土水比 1∶5)、有机碳 20.13 g/kg、总氮 1.61 g/kg、总磷 0.51 g/kg、有效磷 5.87 mg/kg。
1.2 试验设计
本试验设3个处理,分别为单施复合肥(CK)、竹炭包膜复合肥(BF)和复合肥+竹炭(SC)。每个处理3次重复,共计9个小区。每个小区面积为100 m2(10 m×10 m)。竹炭、复合肥和竹炭包膜复合肥均匀撒入各试验小区,翻入0—20 cm土壤中。供试复合肥 (15–15–15)施用量为 300 kg/hm2,竹炭包膜复合肥 (9–9–9)添加量为 490 kg/hm2,CK 和 BF 两个处理施磷量基本一致。竹炭包膜复合肥的包膜材料由竹炭、腐殖质、膨润土和改性淀粉制成,膜材料中竹炭的添加量为25%,肥芯为复合肥。SC处理竹炭添加量为5 t/hm2。在施肥后的第30和100天,测定土壤pH、容重、总碳、总氮、总磷和有效磷含量。在施肥后100天,采集土壤使用Miseq扩增子测序技术测定毛竹林土壤中phoD功能菌的群落结构。在此基础上,采用宏基因组技术测定土壤磷循环功能基因的相对丰度。
1.3 测定方法
1.3.1 土壤理化性质测定 土壤pH采用玻璃电极法测定,土水比为1:5。
土壤研磨过0.15 mm筛,土壤全氮、全碳含量使用元素分析仪 (Flash EA1112, Thermo Finnigan,Italy)测定,全磷采用氢氧化钠熔融—钼锑抗比色法测定[25],有效磷采用盐酸–氟化铵提取—钼锑抗比色法测定。
1.3.2 土壤DNA提取和高通量测序 土壤总DNA 使用 Fast DNA Spin Kit for Soil (MP Biomedicals,USA)试剂盒提取。采用添加了不同标签(barcode)的phoD基因特异性引物ALPS-F730(5′–CAGTGGG ACGACCACGAGGT–3′)和 ALPS-1101(5′–GAGGC CGATCGGCATGTCG–3′)[26–28]进行 PCR 扩增,纯化产物使用Illumina MiSeq-PE250平台进行测序分析。同时,对获取的DNA样品直接使用Illumina NovaSeq高通量测序平台进行宏基因组测序。
1.3.3 数据处理和分析 使用QIIME 2软件,调用USEARCH工具,对phoD基因的原始测序数据,进行质控、去噪、拼接和去嵌合体。在97%的序列相似度水平聚类,得到操作分类单元(OTU),将OTU代表序列在NCBI数据库中进行比对注释,得到OTU的分类学信息。对于宏基因组的数据,首先对质控后的序列采用Megahit软件进行拼接,对不小于200 bp的Contigs序列,采用MetaGeneMark软件进行基因预测,并获得对应的蛋白序列。然后,使用Diamond软件将获得的蛋白序列集与KEGG数据库比对并获得功能基因注释信息,阀值设置为0.00001。最后,参照Dai等[8]和Liu等[29]方法筛选出与磷循环相关的功能基因,并使用Salmon软件计算各功能基因的相对丰度。phoD功能基因扩增子和宏基因组原始测序数据已上传至NCBI数据库,生物项目编号分别为PRJNA746410和PRJNA775002。
1.4 统计分析
使用SPSS 20.0软件对竹炭和竹炭包膜复合肥添加对毛竹林土壤理化性质的影响进行LSD单因素方差分析(α=0.05)。以phoD功能菌抽平后的OTU数据,使用R软件中Stats包计算Bray-Curtis距离矩阵,并进行层次聚类分析。使用R软件绘制毛竹林土壤phoD功能菌属水平和磷循环功能基因的相对丰度水平。利用Heatmap的颜色梯度来反映其微生物和功能基因的丰度差异,绿色越深代表丰度越大,咖啡色越深代表丰度越小。采用Canoco 5.0软件,将土壤phoD功能菌相对丰度作为响应变量,土壤理化性质作为环境因子进行冗余分析,并绘制相应的分析图。
2 结果与分析
2.1 竹炭和竹炭包膜复合肥添加对毛竹林土壤理化性质的影响
由表1可知,在施肥后的第30和100天,与CK相比,SC处理显著增加了毛竹林土壤的pH、总碳和有效磷的含量,降低了土壤的容重。SC处理虽然一定程度上增加了土壤总氮和总磷的含量,但是均没有达到显著性差异水平(P>0.05)。与CK相比,竹炭包膜复合肥的添加对土壤pH、容重、总碳、总氮、总磷和有效磷含量均没有显著的影响(P>0.05)。
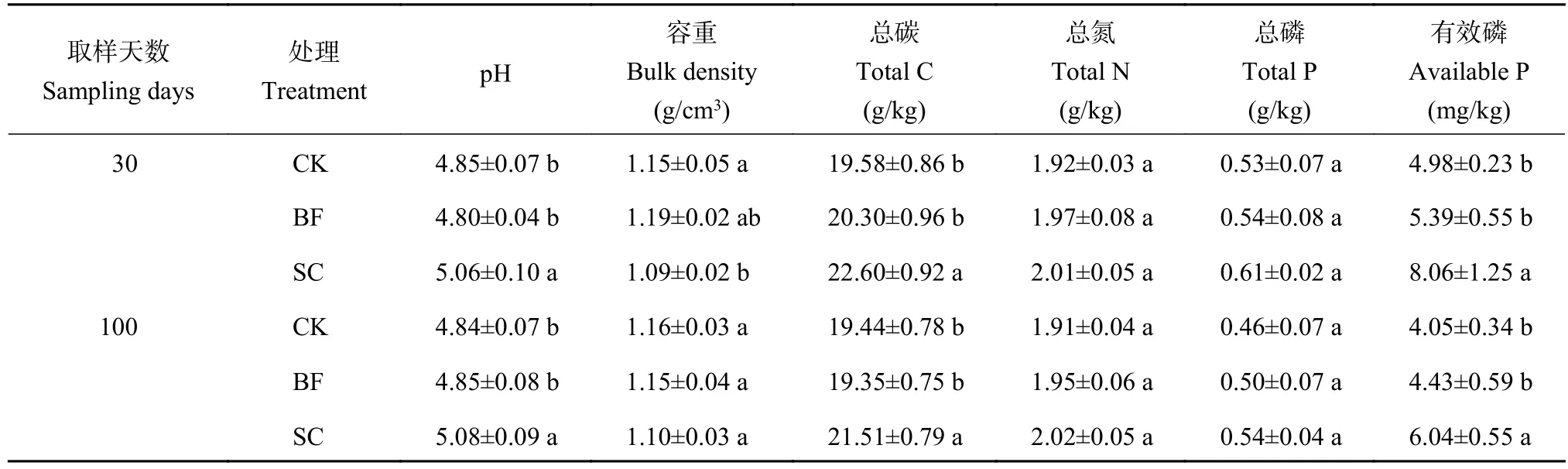
表1 竹炭和竹炭包膜复合肥添加后第30和100天毛竹林土壤的理化性质Table 1 Soil properties as affected by biochar and biochar-coated slow-release fertilizer at 30 and 100 days after application
2.2 竹炭和竹炭包膜复合肥施用对phoD功能菌多样性和组成的影响
采用Miseq测序技术对毛竹林土壤phoD功能菌进行测序分析,不同样品获得有效序列47350~93883条,分布于4个门7个纲,覆盖度>99% (表2),样品测序深度满足要求。从Venn图(图1)可知不同处理共有phoD功能菌OTU数目为1312个,其中CK处理的独有OTU数目最多(491个),而BF处理的独有OTU数目最少(446个) 。在此基础上,对毛竹林土壤phoD功能菌进行alpha多样性分析,分析发现BF和SC处理对phoD功能菌Chao1、Simpson和Shannon指数均没有显著性的影响(P>0.05)。
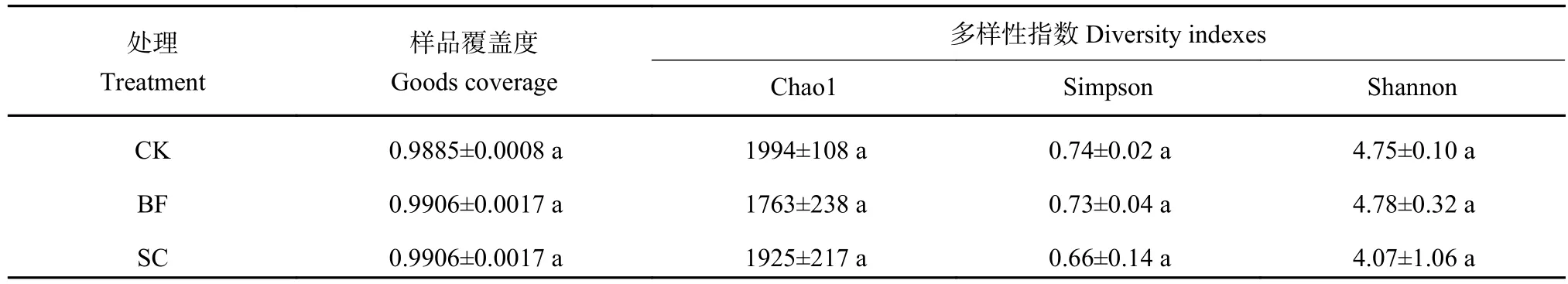
表2 不同处理土壤phoD功能菌多样性指数Table 2 The diversity indices ofphoD functional bacteria in soil under different treatments
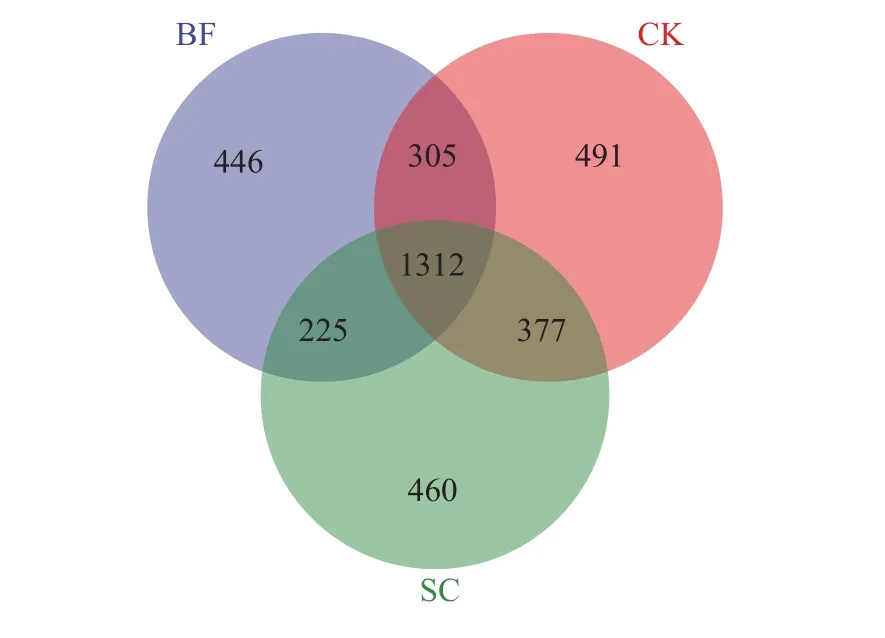
图1 不同处理毛竹林土壤phoD功能菌共有和独有OTU数目Fig. 1 Shared and unique OTU numbers ofphoD functional bacteria in Moso bamboo forest soil under different treatments
由图2可知,毛竹林土壤中phoD功能菌优势菌科为 Bradyrhizobiaceae (慢生根瘤菌科)、Bukholderiaceae (伯克氏菌科)、Labilitrichaceae、Hyphomicrobiaceae (生丝微菌科)和 Oxalobacteraceae (草酸杆菌科) (图2)。此外,相对丰度较低的科为Phyllobacteriaceae (叶杆菌科)、Halomonadaceae (盐单胞菌科)、Methylobacteriaceae (甲基杆菌科)和 Rhizobiaceae (根瘤菌科)等。与CK相比,SC处理显著增加了毛竹林土壤Bradyrhizobiaceae,显著降低Bukholderiaceae的相对丰度(P<0.05)。BF处理则显著增加了Labilitrichaceae和Hyphomicrobiaceae的相对丰度(P<0.05)。层次聚类分析则表明,SC或BF处理可以改变土壤的phoD功能菌群落结构组成。

图2 phoD功能菌层次聚类分析Fig. 2 Hierarchical cluster analysis ofphoD functional microorganisms
进一步分析表明,毛竹林土壤共测得23个属,百分含量较高的为α-变形菌纲中的Bradyrhizobium(慢生根瘤菌属)、Mesorhizobium(中慢生根瘤菌属)、Pseudolabrys(假双头斧形菌属)、Sinorhizobium(中华根瘤菌属)、Rhodoplanes(红游动菌属)、Methylobacterium(甲基杆菌属),β-变形菌纲中的Ralstonia(罗尔斯顿菌属),δ-变形菌纲中的Labilithrix,以及放线菌纲中的Streptomyces(链霉菌属)、Micromonospora(小单孢菌属)和Saccharopolyspora(糖多孢菌属)。其中,Bradyrhizobium、Mesorhizobium、Labilithrix和Sinorhizobium是毛竹林土壤中主要的phoD功能菌属,占了7.5%以上的注释微生物。由图3可知,BF处理明显增加了Micromonospora、Methylobacterium和Streptomyces的相对丰度,降低了Rhodoplanes的相对丰度,对Bradyrhizobium和Labilithrix影响不明显。SC处理则增加了Bradyrhizobium属的微生物。但是,与对照相比,SC处理降低了Mesorhizobium的相对丰度,对Sinorhizobium的影响不明显。
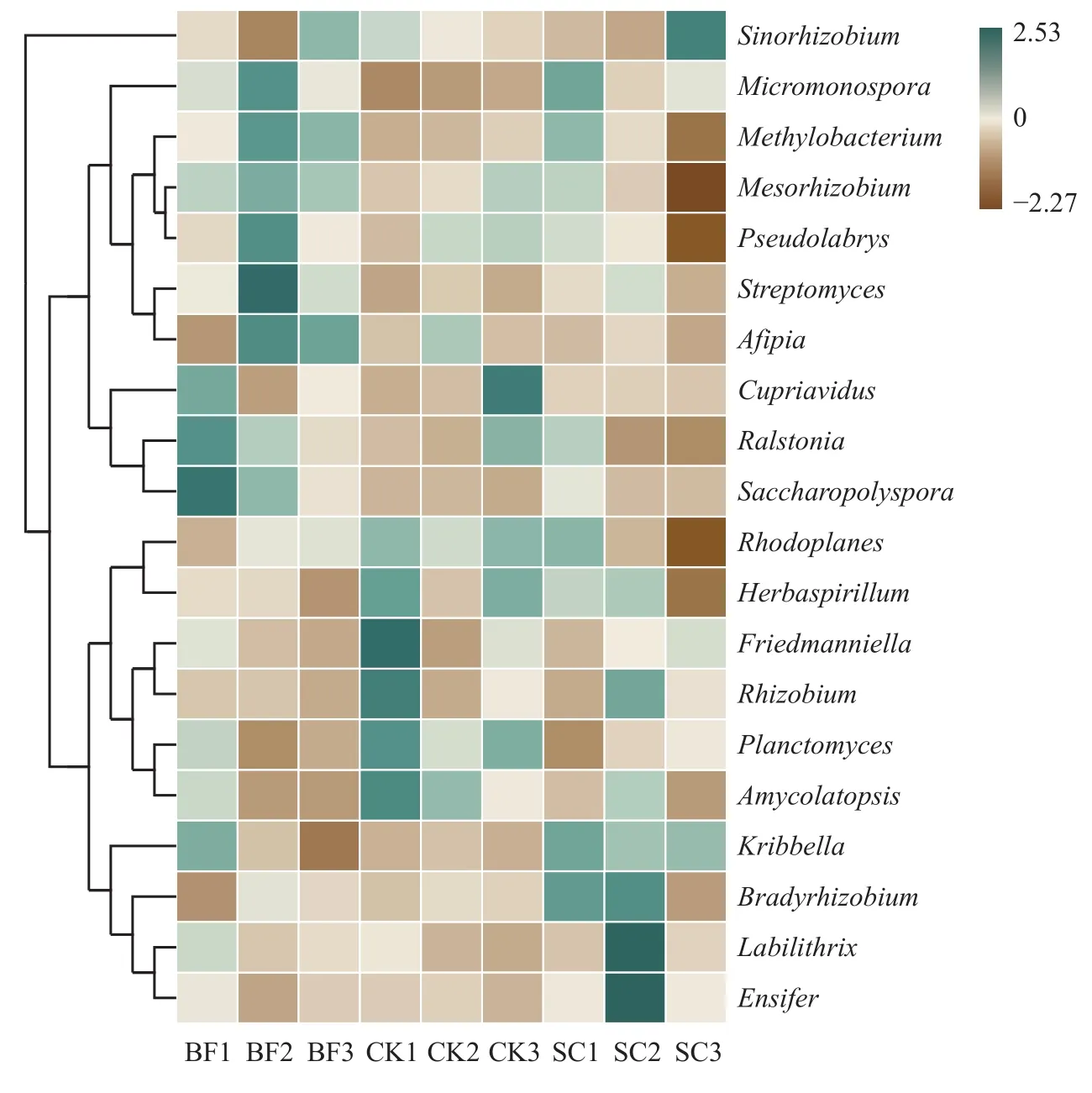
图3 不同处理下毛竹林土壤phoD功能菌属水平的相对丰度Fig. 3 The relative abundance ofphoD functional microorganisms at genus level in Moso bamboo forest field as affected by different treatments
在此基础上,将土壤phoD功能菌相对丰度作为响应变量,土壤理化性质作为环境因子进行RDA分析。结果表明,各处理均有较好的聚类表现(图4)。pH对phoD功能菌的相对丰度的解释度最高为43.7% (P=0.026)。其次分别为总氮(9.7%)和总磷(8.4%),但是均没有达到显著性的水平。其中,第一标准轴(RDA1)和第二标准轴(RDA2)分别解释了土壤phoD功能菌相对丰度变化的71.8%和15.8%。
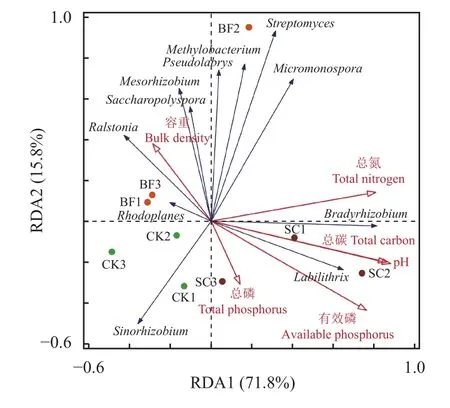
图4 不同环境参数与毛竹林土壤phoD功能菌RDA分析Fig. 4 RDA analysis of different environmental parameters and soilphoD functional microorganisms in Moso bamboo forest soil
2.3 竹炭和竹炭包膜复合肥施用对磷循环功能基因的影响
通过宏基因组测序共获得15.1亿条Reads,平均每个样品1.67亿条。经序列组装后,每个样品的平均Contigs数为453.7万条。其中,涉及到磷循环功能基因占总Contigs数的0.57%~0.70%,包含了编码无机/有机磷酸盐特异转运酶的基因,三磷酸甘油脱氢酶的基因,C-P键裂解酶基因,以及碱性磷酸酶和酸性磷酸酶的功能基因等。由图5可知,与对照CK相比,SC处理显著增加了毛竹林土壤三磷酸甘油脱氢酶单元(ugpAEC)、C-P键裂解酶(phnGHIJL)、有机磷酸盐特异转运蛋白(phnCD)、无机磷酸盐特异转运蛋白(pstCAB)和碱性磷酸酶(phoA和phoD)基因的相对丰度(P<0.05)。但是,BF处理仅显著增加了ugpE、pstA和phoD基因的相对丰度。SC处理对土壤酸性磷酸酶基因具有不确定性。与对照CK相比,酸性磷酸酶基因(phoN)在SC中得到了富集 (P<0.05),但是酸性磷酸酶基因(aphA和alpA)在SC中显著下降。此外,与对照CK相比,SC处理增加了磷酸转运系统调控蛋白(phoU)、组氨酸蛋白激酶(phoR)和磷酸盐调控反应因子基因(phoB)的相对丰度,但是没有显著性的影响(P>0.05)。
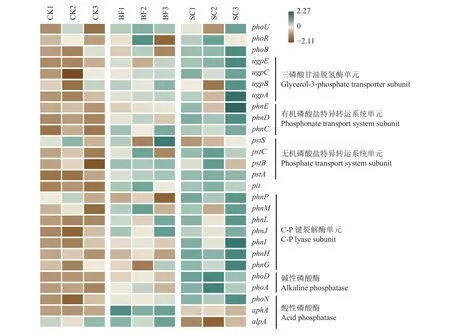
图5 毛竹林土壤磷循环功能基因的相对丰度热图Fig. 5 The heatmap of the relative abundance of phosphorus cycling genes in Moso bamboo forest soil
3 讨论
3.1 竹炭和竹炭包膜复合肥施用对土壤理化性质的影响
生物炭作为一种高效的土壤改良剂,施入土壤后会显著改变土壤的理化性质[30–31]。本研究发现,竹炭的输入显著增加了毛竹林土壤的pH、总碳和有效磷的含量。该研究结果与王典等[32]和陈心想等[33]研究结果基本一致,即施用生物炭还有助于提高土壤pH和有效磷的含量。生物炭表面含有丰富的碱性基团,内部含有丰富的矿质元素形成的碳酸盐,其在土壤老化过程中会逐步释放碱性物质[34–35],增加土壤的pH。施用竹炭增加土壤有效磷的含量可能主要有以下3方面的原因:1)竹炭自身携带的磷素可以直接提高土壤有效磷的含量[36];2)土壤中Al3+、Ca2+、Mg2+和Fe3+等离子可能被竹炭表面官能团吸附,从而减少了矿物离子对磷的吸附固定[37]。3)竹炭的输入可以通过影响土壤磷循环功能基因的丰度来促进土壤有效磷含量的增加[38]。此外,竹炭的输入降低了土壤容重,这主要是由于竹炭的密度较小,孔隙较多。然而,与对照相比,竹炭包膜复合肥的输入对毛竹林土壤各理化性质均没有产生显著的影响。这可能是因为该包膜肥中竹炭的添加量较少。当然,竹炭包膜复合肥添加对毛竹林土壤理化性质的影响还需要进一步研究。
3.2 竹炭和竹炭包膜复合肥施用对毛竹林土壤phoD功能菌的影响
由图2和图3可看出,Proteobacteria (变形杆菌门)中根瘤菌包括Bradyrhizobium(慢生根瘤菌属)、Mesorhizobium(中慢生根瘤菌属)和Sinorhizobium(中华根瘤菌属)是毛竹林土壤中最为重要的phoD功能菌。Ragot等[39]测定了澳大利亚和瑞士6种不同气候条件下的土壤性质,发现Rhizobiales是土壤phoD功能菌的优势菌目,占18%~27%。这一方面可能与固氮菌具有较强的解磷能力[40],毛竹林等低磷土壤中有利于其生长;另一方面固氮微生物具有较强的耐酸性[41–42],有利于其在南方酸性的毛竹林土壤中生长。Luo等[28]研究也发现,长期施肥的稻田中最重要的phoD功能菌为Micromonospora、Streptomyces(链酶菌属)、Bradyrhizobium、Burkholderia和Lysobacter。其中,Bradyrhizobium占了phoD功能菌的50%以上。有研究也发现,phoD功能菌在提高土壤有效磷的同时,也有助于土壤根瘤菌的生长[43]。
此外,土壤环境条件的改变也可能会影响phoD功能菌的群落结构。Wang等[44]通过对不同土壤中生长的小麦根际微生物的研究发现,土壤pH是phoD功能菌群落的重要驱动因素。本研究RDA分析结果也揭示了环境参数pH与土壤phoD功能菌之间具有显著的相关性(P<0.05)。方差分析表明,pH解释了43.7%的群落变异度。如图4所示,pH值与土壤Bradyrhizobium和Labilithrix具有正相关关系,与Ralstonia、Mesorhizobium和Saccharopolyspora具有负相关关系。该研究结果与Luo等[28]和Ragot等[39]的研究一致,即土壤pH驱动着土壤phoD功能菌群落。但是,总磷与土壤phoD功能菌相关性不明显,仅解释了8.4%的群落变异度。这可能与毛竹林的磷素大部分为难溶性的无效磷,难以被微生物利用有关。Jorquera等[45]观察到,在智利Andisol牧场,单独施用磷肥不会影响phoD功能菌群落结构,而氮磷联合施用才会改变phoD功能菌群落结构。本研究中,竹炭或者竹炭包膜复合肥的添加也确实没有显著影响土壤总氮含量(P>0.05) (表1)。此外,与CK相比,Micromonospora、Methylobacterium和Streptomyces在BF处理中具有较高的相对丰度。相关机理有待进一步研究。
3.3 竹炭和竹炭包膜复合肥添加对磷循环功能基因的影响
微生物介导的磷素转化过程主要包含三类微生物基因群,即无机磷溶解和有机磷矿化基因,磷的吸收和转运基因,以及磷饥饿反应调节基因。在土壤中,尤其在磷素缺乏的土壤中,无机磷素转运基因(pstSCAB)非常重要,因为它们允许微生物和植物的竞争中夺取生物有效磷[46–47]。Bergkemper等[48]研究发现缺磷的森林土壤中pstSCAB基因具有较高的丰度。本项目研究中也发现,与CK相比,添加竹炭的处理有助于增加无机磷转运基因(pstCAB)的相对丰度。这可能是由于竹炭的添加增加毛竹林根系的生物量,增强根系与微生物对无机磷的竞争,从而提高了毛竹林土壤中无机磷素转运基因(pstCAB)的相对丰度[8]。竹炭的添加也有助于增加毛竹林土壤中phoU、phoR和phoB基因的丰度。这些功能基因参与了P-饥饿反应调节,并且与无机磷转运基因(pst)密切相关[14]。现有的研究已经表明,phoR和phoB双组分系统有效调控无机磷转运基因(pstSCAB)的表达,使其在低磷条件下有效利用磷源[49]。此外,竹炭也可调控毛竹林土壤有机磷的矿化和转运。无论是土壤三磷酸甘油脱氢酶单元(ugpAEC),C-P键裂解酶基因(phnGHIJL),还是有机磷酸盐特异转运蛋白(phnCDE)在SC处理中均有较高的相对丰度。这可能与竹炭的添加提高了土壤的pH有关。Dai等[8]的研究也发现,土壤pH与磷素的溶解、矿化、吸收和转运等基因具有显著的正相关关系。长期施用氮肥降低了土壤pH,影响了土壤磷酸单酯和磷酸二酯的潜在矿化作用。这可能是竹炭包膜复合肥添加对土壤磷循环功能基因的影响不明显的原因。进一步分析还发现,同时添加复合肥和竹炭提高了土壤碱性磷酸酶(phoA和phoD)基因的相对丰度。这一方面是由于竹炭含有较高的C和N,其输入提高了土壤的C/P和N/P化学计量比,增加了土壤微生物对土壤无机磷的需求;另一方面,竹炭可以促进土壤微生物的生长,从而提高了土壤碱性磷酸酶基因的丰度。
4 结论
同时施用竹炭和复合肥可显著增加毛竹林pH、总碳和有效磷含量,降低了土壤的容重。但是,将竹炭作为包膜材料制备成竹炭包膜复合肥施入土壤后,其有益效果不再显著。pH是毛竹林土壤phoD功能菌的重要驱动因素。因此,施用竹炭改变了土壤中phoD功能菌的群落结构,提高了参与毛竹林土壤磷素溶解、矿化、吸收和转运功能基因的相对丰度。从土壤磷的有效性及相关微生物基因的表达角度,竹炭不宜作为包膜材料施用。

