以呼吸系统症状首诊的继发性肺淋巴瘤临床特征研究
巨 清,吴 蕾,宋 征,赵 峰,周 英
(1.空军军医大学西京医院呼吸与危重症医学科,陕西 西安 710032; 2.空军军医大学西京医院病理科,陕西 西安 710032)
淋巴瘤为起源自淋巴组织及淋巴结的免疫系统肿瘤,常累计部位为包括淋巴结、扁桃体、脾脏、肺及骨髓等,主要的临床表现为进展性无压痛性淋巴结肿大及局部肿大。根据病理类型分为霍奇金淋巴瘤(Hodgkin lymphoma,HL)及非霍奇金淋巴瘤(Non-hodgkin lymphoma,NHL)。肺是淋巴瘤常见的易受累部位之一,根据侵犯方式不同,分为原发性肺淋巴瘤(Primary pulmonary lymphoma,PPL)及继发性肺淋巴瘤(Secondary pulmonary lymphoma,SPL)[1]。根据GLOBOCAN 2018年统计数据,淋巴瘤在全球当年1810万新发肿瘤中占到了3.2%(其中0.4%为HL,2.8%为NHL),死亡患者占到当年960万死亡患者的2.9%(其中0.3%为HL,2.6%为NHL),该数据较2012年有明显的增长[2]。由于SPL临床症状、实验室检查及影像学特征缺乏特异性,很难与其他呼吸道常见疾病相鉴别,极易误诊误治。本文回顾性分析了本科室12年间通过微创肺活检确诊的12例SPL患者临床资料,描述其诊断过程,积累经验,以期减少误诊。
1 资料与方法
1.1 一般资料 收集空军军医大学西京医院呼吸与危重症医学科2008年1月至2020年12月经肺部病理确诊的SPL患者12例。病例纳入标准:①首诊于外院或我院呼吸与危重症医学科;②病理证实肺淋巴瘤。排除标准:①既往有恶性肿瘤或肿瘤家族史;②原发性肺淋巴瘤(PPL)[3]。在此时间段,我科共收治经病理确诊淋巴瘤患者19例,剔除1例既往有恶性肿瘤病史,6例原发性肺淋巴瘤,共入组SPL患者12例。本研究12例患者中,男7例,女5例,年龄25~66岁,平均50.08岁;黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(Mucosa-associated lymphoid tissue,MALT)、霍奇金淋巴瘤(Hodgkin lymphoma,HL)、NK/T细胞淋巴瘤(NK/T cell lymphoma,NKTCL)、弥漫大B细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)各2例,T淋巴母细胞性淋巴瘤(T lymphoblastic lymphoma,T-LBL)、浆细胞样分化的淋巴瘤、浆细胞瘤、淋巴瘤样肉芽肿(Lymphomatoid granulomatosis,LYG)各1例。本研究已获得空军军医大学西京医院伦理委员会批准。
1.2 研究方法
1.2.1 检索住院病历,分析12例经肺部病理确诊的SPL患者一般资料,描述年龄、性别、临床表现、血清指标、胸部CT、微创肺活检、病理特点及治疗方案。
1.2.2 所有病例均于我院行胸部CT,由两位具有6年肺部影像学经验的放射科医师回顾性分析所有患者胸部CT图像,观察者对临床和病理诊断均不知情。
1.2.3 病理科医师主要通过形态学和免疫组化诊断淋巴瘤,对于诊断困难者行基因重排,所有患者均有肺部组织学及细胞学标本,由一位具有10年淋巴瘤病理学经验及一位具有10年肺部疾病病理学经验的医师分析所有患者病理特点。
2 结 果
2.1 临床表现 12例患者均因呼吸系统症状首诊于外院或我院呼吸与危重症医学科。临床表现为气短7例,胸闷、干咳各5例,高热、咳痰各4例,体重下降2例,背痛、声音嘶哑、头晕、双下肢乏力、脓涕各1例。见表1。
2.2 血清学指标 乳酸脱氢酶(Lactate dehydrogenase,LDH)、铁蛋白(Serum ferritin,SF)、β2微球蛋白(β2microglobulin,β2-MG)超过一半患者均有不同程度升高,分别为7例(58.33%),7例(58.33%),8例(66.67%),见表1。
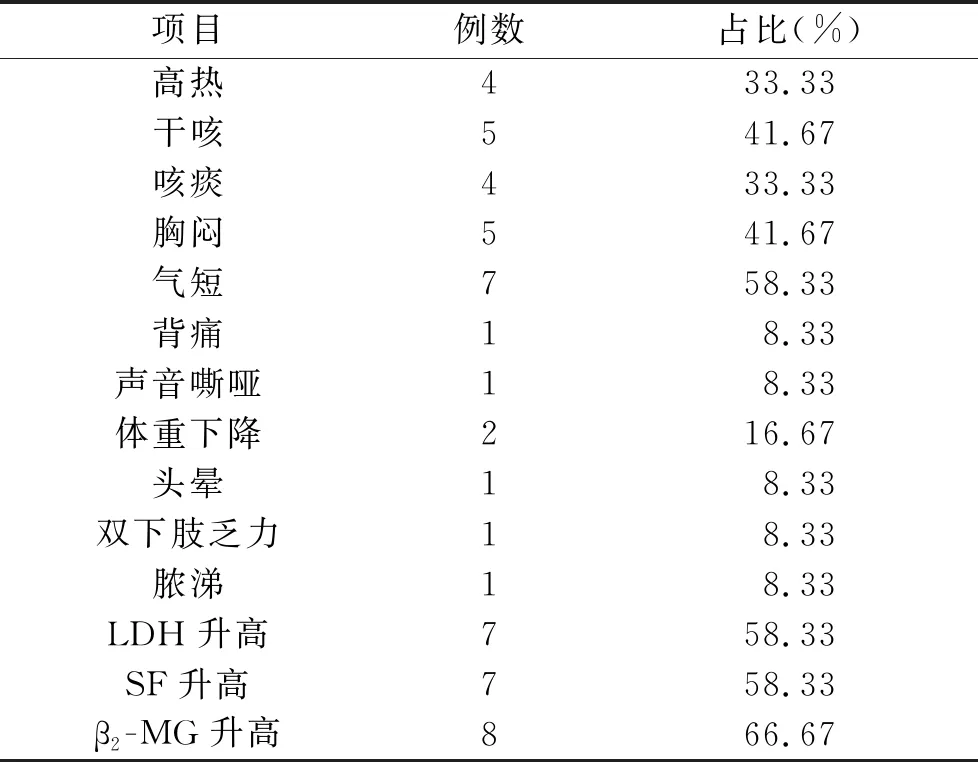
表1 12例SPL患者临床症状及血清指标分析
2.3 胸部CT表现 12例患者入院前均于我院行胸部CT,均为多发病灶。多位于双肺各叶段(Bilateral lung,BL)及右下叶(Right lower lobe,RLL),分别5例及4例,其次右上叶(Right upper lobe,RUL)及左下叶(Left lower lobe,LLL)各3例,右中叶(Right middle lobe,RML)及左上叶(Left upper lobe,LUL)各2例,单肺多发病灶各1例,纵隔肿块2例,胸膜多发结节1例,7例合并胸腔积液,仅2例伴纵隔淋巴结肿大。见表2。
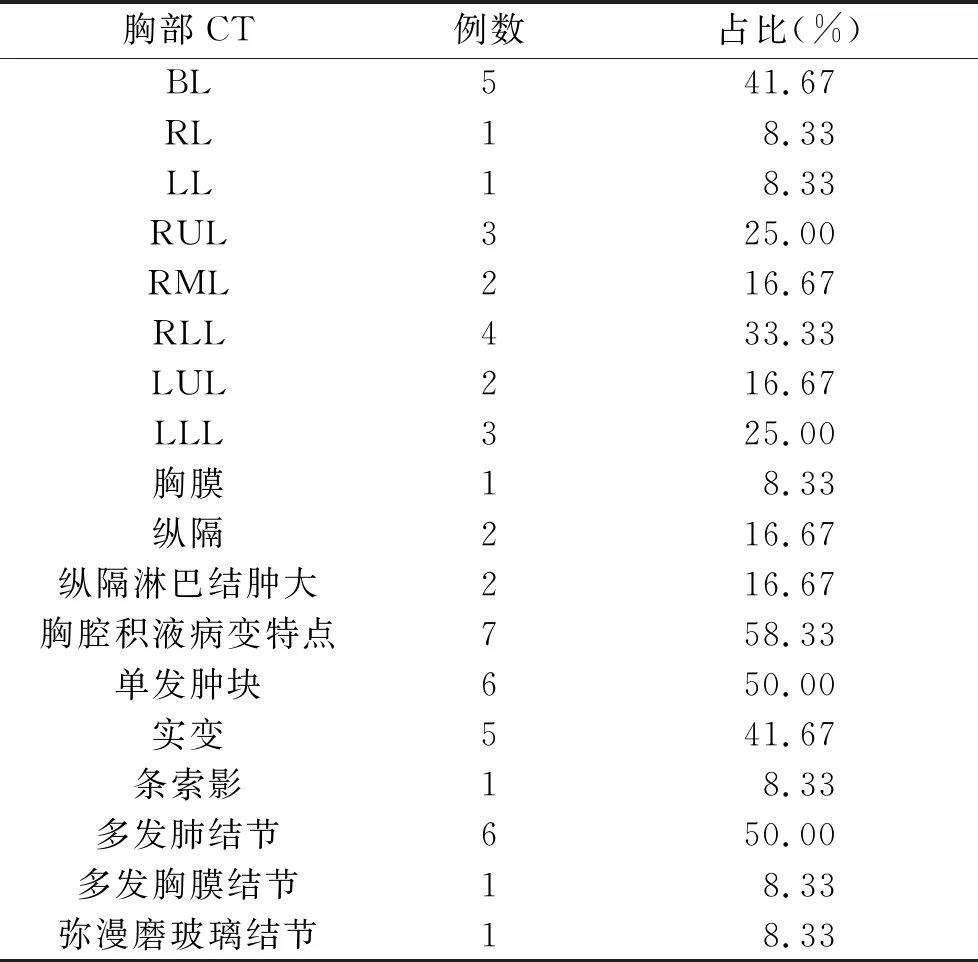
表2 12例SPL患者胸部CT特征
单发肿块伴多发肺结节伴实变影伴胸腔积液2例(图1A),单发肿块伴实变影伴胸腔积液1例(图2A、B),实变影伴多发肺结节伴胸腔积液1例(图3A),单发肿块伴多发肺结节1例(图4A),单发肿块伴胸腔积液1例,索条影伴多发肺结节1例(图5A、B),双肺弥漫磨玻璃结节伴胸腔积液1例(图6A),多发胸膜结节伴胸腔积液、仅表现为单发肿块、仅表现为实变影、仅表现为多发肺结节各1例。见表2。
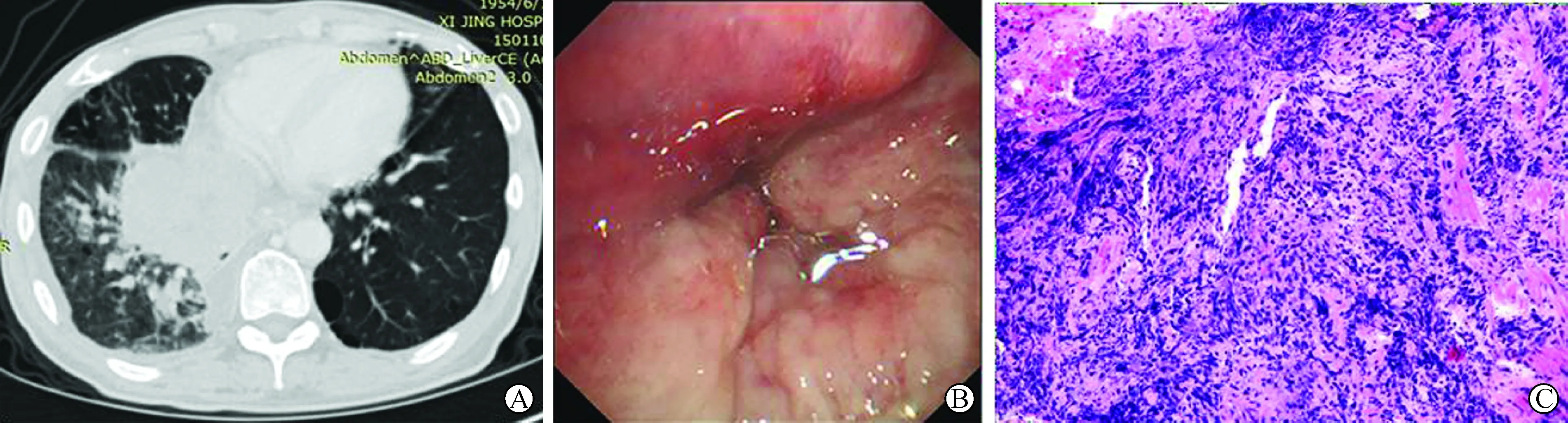
A:右肺门占位,右肺斑片状高密度影,左肺上叶小结节;B:支气管镜见右肺中间段支气管黏膜水肿并嵴性隆起,致管腔基本闭塞;C:光镜下见异型细胞呈片状排列,细胞核染色质细腻,挤压变形(HE染色,×200)
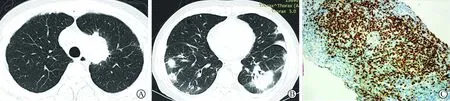
A~B:左肺上叶4.9 cm×2.3 cm软组织肿块影,双肺散在实变影;C:Pax-5(+)(免疫组化染色,×200)
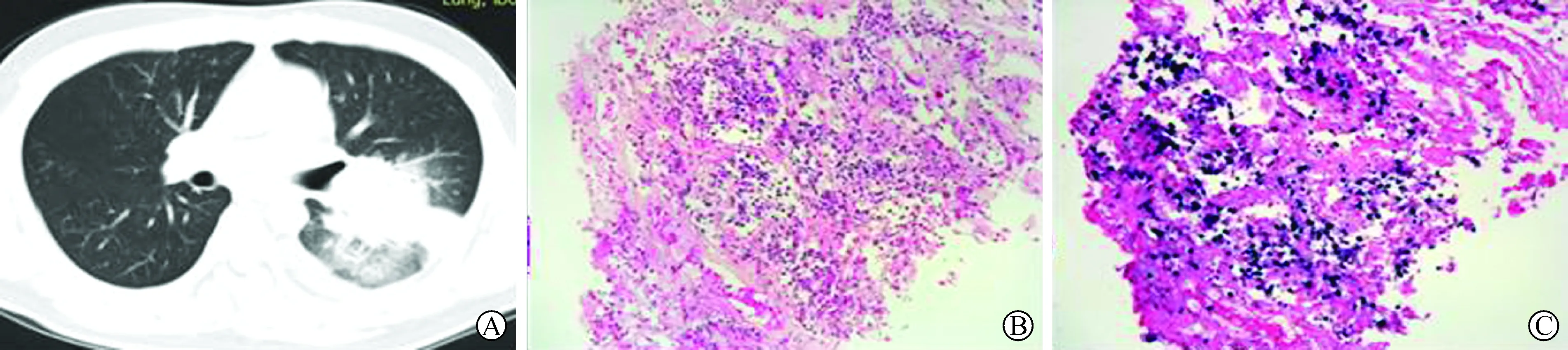
A:左肺上叶实变影,双肺上叶多发小结节,左侧胸腔积液;B:光镜下见肺组织及黏膜内淋巴细胞、浆细胞及中性粒细胞浸润,大片坏死(HE染色,×200);C:EBER(+)(免疫组化染色,×200)

A:右肺中上叶支气管周围团块状高密度影,临近肺门及纵隔淋巴结肿大,双肺散在小结节灶;B:光镜下见淋巴结结构消失,嗜酸性粒细胞浸润,大细胞及RS样细胞(HE染色,×200);C:CD30(+)(免疫组化染色,×200)
2.4 微创肺活检 本研究所有患者均未行开胸或电视辅助胸腔镜(Video-assisted throracoscopic surgery,VATS)肺内病变切除术及尸检,均经过1~3次不等的微创肺活检。经皮肺穿刺活检术(Percutaneous transthoracic needle biopsy,PTNB)9例,经支气管镜肺活检术(Transbronchial lung biopsy,TBLB)2例(图1B),内科胸腔镜2例,超声内镜引导下的经支气管针吸活检(Endobronchial ultrasound-guided transbronchial needle aspirate,EBUS-TBNA)1例。见表3。
2.5 病理表现及分型 1例光镜下(胸膜)异型细胞核大,深染,胞浆稀少,浸润性生长,经免疫组化确诊T-LBL。1例光镜下见(胸膜)大量纤维组织增生,期间较多浆细胞及组织细胞浸润,免疫组化支持浆细胞样分化的淋巴瘤。1例光镜下见纤维组织之间淋巴细胞、浆细胞弥漫浸润,大量Dutcher小体,常围绕血管分布,局部坏死,免疫组化支持浆细胞瘤。2例光镜下见小细胞片状排列,浸润性生长,免疫组化支持MALT(图2C)。2例光镜下见淋巴结结构消失,纤维组织将其分割为结节状,可见胞浆淡染的大细胞及RS样细胞,可见嗜酸性粒细胞浸润,免疫组化支持HL(图4B、C)。2例光镜下见肺组织及黏膜内淋巴细胞、浆细胞及中性粒细胞浸润,部分肺泡上皮增生,大片坏死,EBER原位杂交(+),支持NKTCL(图3B,C)。2例光镜下见异型细胞呈片状排列,细胞核染色质细腻,挤压变形,免疫组化支持DLBCL(图6B、C)。1例光镜下见纤维组织增生,慢性炎细胞浸润,期间散在少许大细胞成分,细胞胞浆丰富,核形不规则,免疫组化支持LYG(图5C)。

A、B:双肺多发条索影,右肺上叶小结节;C:光镜下见纤维组织增生,慢性炎细胞浸润,期间散在少许大细胞成分,细胞胞浆丰富,核形不规则(HE染色,×200)。
2.6 治疗情况 3例患者确诊后放弃治疗,1例患者确诊后住院期间死亡。8例患者转入血液科给予化疗,于我院末次住院期间病情稳定。
3 讨 论
肺淋巴瘤根据原发病灶及侵犯位置不同可分为PPL及SPL。SPL较PPL更为常见,在临床中发生率为10%~20%,国外研究中SPL在HL中约占38%,高于在NHL中的24%[4]。
SPL临床症状无特异性,除呼吸道症状外,肺外症状也较常见,例如浅表淋巴结肿大,发热,乏力等[5]。本组患者临床症状以气短、干咳、胸闷为主,分别为58.33%,41.67%及41.67%的患者,咳痰及高热各4例(33.33%)。单纯从临床症状上鉴别,与肺炎、肺结核、结核性胸膜炎、肺癌等呼吸系统常见疾病相似,因此临床易误诊,故需要结合后续的胸部影像学及病理学的支持。
SPL在肺内的表现多种多样,主要的病理基础有[6]:①肺门及纵隔的淋巴结直接蔓延侵及肺部,形成边缘清楚或模糊的结节或肿块,可有分叶。②肿瘤细胞延血管或淋巴管播散,侵及肺间质,致小叶间隔增厚或支气管血管束增粗,最终形成间质性病变。③肿瘤组织逐步浸润,使肺泡间隔遭到破坏,肺内出现实变及渗出。④弥漫性肺浸润时,亦可出现类似于粟粒性肺结核样的微小结节。
正是依据以上的病理生理基础,故SPL的胸部影像学表现出多样性,很少出现典型的特征。既往研究报道SPL影像学表现包括[6-9]:结节影(磨玻璃结节、粟粒样结节或弥漫性网状结节)、肿块影(单发或多发)、实变影(斑片状)。同时还可伴有支气管通气征、胸腔积液、结节或肿块内坏死空洞影、支气管血管束增厚、小叶间隔增厚等。
本研究表现有肺结节的患者6例(50.00%),肺肿块影的患者6例(50.00%),肺实变患者5例(41.67%),其中9例(75.00%)患者为多种影像学表现混合,与既往研究相符,提示多样性为SPL的影像学特点之一。仅3例患者为单一的结节或肿块或实变影,同时58.33%的患者合并胸腔积液。综合以上SPL影像学特点可见,当肺部出现单发肿块和或多发结节和或实变阴影,病灶进展缓慢,肺体积无缩小,伴或不伴胸腔积液,经抗感染及其他常规治疗效果不佳时,应考虑到SPL的可能。
SPL实验室检查也缺乏特异性,本研究显示,超过一半的病人血清LDH、SF、β2-MG升高。SF升高见于某些感染性疾病、风湿性和或炎症性疾病及恶性肿瘤[10-11]。β2-MG是一种小的多肽轻链,是主要组织相容性复合体(Major histocompatibility complex,MHC)Ⅰ类抗原的一部分[12],由所有有核细胞分泌,通常通过肾小球从血液中滤出,被肾小管上皮细胞重吸收和降解[10],正常人β2-MG合成与释放相当恒定,具有显著肿瘤负荷的、高细胞转化率、高侵袭力的淋巴恶性肿瘤患者β2-MG可升高。多项研究表明血清β2-MG可作为DLBCL[13]及MALT[14]预后指标。宋为娟等[15]则认为SF、LDH、β2-MG可以作为恶性淋巴瘤的有效辅助诊断指标。本研究中上述指标在不同SPL患者中有不同程度的升高,提示在SPL的早期诊断中其升高应引起充分重视。
SPL的病理诊断通常很棘手,主要取决于取样的标本及病理诊断水平。淋巴瘤继发的病变(如肉芽肿)范围远远大于肿瘤本身的病变范围。与上皮性肿瘤相比,淋巴瘤更难区分是淋巴瘤细胞,还是宿主对肿瘤的反应细胞[16]。美国癌症学会(American Cancer Society,ACS)建议应根据形态学、表型、基因型、分子特征和分期进行淋巴瘤早期诊断和亚型分类,因此诊断SPL需要获取充足的组织标本。通过有创检查如VATS、开胸肺内病灶切除术获取足够的组织标本是肺淋巴瘤诊断和分类的基础[17]。
然而这些有创检查费用高、术后并发症多,术后恢复时间较长[17-18]。微创手术如TBLB及EBUS-TBLB、CT引导下PTNB、超声引导下PTNB已成为一种更有效、安全、经济的替代方案[19-20]。EBUS是近年来的一项技术革新,不仅能检查支气管黏膜,还能检查支气管周围组织[21]。Zhan等[22]通过Meta分析显示EBUS-TBLB诊断周围型肺癌敏感度为0.69,低于CT引导下PTNB的敏感度0.94,其优势在于安全性高。在目前的实践中,CT引导下PTNB是诊断胸部病变的经典方法,其简单、快速,不需要全身麻醉,减少了侵入性手术的实施[23]。在我们的研究中,所有患者均是通过1~3次不等的微创肺活检最终确诊SPL,其中75%经PTNB确诊。
综上所述,本文对我科收治SPL患者临床特征进行分析,提示胸部CT表现的多样性为SPL的影像学特点,根据淋巴瘤多形态、多部位、多病灶等特点,当与临床表现不一致时应当考虑SPL,同时结合血液LDH,SF,β2-MG等指标异常,协助诊断。最终确诊,还需要足量的组织病理支持。

