慢性血栓栓塞性肺动脉高压:构建动物模型的研究进展
胡美曦 黄志华 柳志红 赵智慧 罗勤 赵青
(中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院,北京100037)
慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)是一种罕见的、危及生命的肺栓塞并发症。CTEPH定义为机化的血栓长期阻塞肺动脉导致血流重新分布和肺微血管床重构的一种疾病,属于肺动脉高压的第四大类别,重症患者可导致右心衰竭和死亡[1]。CTEPH的诊断标准为:经过3个月的规范抗凝治疗后,影像学证实肺动脉存在慢性血栓,且静息状态下右心导管检查测定的肺动脉平均压≥25 mm Hg(1 mm Hg=0.133 3 kPa),肺动脉楔压≤15 mm Hg。传统观念普遍认为,CTEPH是急性肺血栓栓塞症的远期并发症,即急性肺血栓栓塞症的血栓未能及时完全溶解,反复发生血栓栓塞,血栓机化堵塞肺血管床,从而导致肺动脉压(pulmonary arterial pressure,PAP)升高。越来越多的研究表明,即使PAP未达到25 mm Hg的临界值,仍会出现与CTEPH患者相似的症状,此部分患者可能患有慢性血栓栓塞性疾病[2-3]。事实上,栓塞后静息时PAP>19 mm Hg与长期的死亡率增加相关[4-5]。CTEPH的特定影像学诊断标志包括通气/灌注扫描上不匹配的充盈缺陷和多探头CT血管造影、磁共振成像或常规肺神经血管造影显示的环样狭窄、网状征、线状征或慢性完全闭塞等。
有3%~4%的患者在急性肺栓塞后发生CTEPH,有10%的复发性肺栓塞患者发生CTEPH[2]。在CTEPH中,肺血管阻力最初由于较大的肺动脉阻塞而增加,但通过肺微血管重构进一步升高[2,6],除压力的增加外,血流还被重新分布到肺血管系统的通畅部分,导致剪切应力的局部改变。剪切应力的改变联合全身的危险因素导致内皮功能障碍、炎症、血管收缩和血管舒张受损等病理过程[7]。此外,这些过程促进了阻塞和通畅的肺血管的结构重构。这种重构导致肺血管阻力增加,进而增加右心室的后负荷,从而导致右心室扩张和右心室肥大[8]。
肺动脉内膜切除术可在一定程度上消除肺血管的阻塞,达到短期治愈。然而,一些无法到达的远端肺阻塞和/或相关的远端肺血管病变可诱发持续性肺动脉高压,这也是术后的主要并发症。与此同时,无条件进行肺动脉内膜切除术的患者可在有经验的肺血管中心进行肺动脉球囊扩张成形术。因此,提高对CTEPH的认识可改善未来的医疗管理策略。目前,已有部分动物模型为CTEPH的病理生理学和发病机制提供了参考。现回顾目前广泛应用的动物模型(见表1),以提高对CTEPH的理解,为后续相关基础和临床研究提供理论参考依据。

表1 各类动物模型优劣势对比
1 啮齿类动物的CTEPH模型
由于经济及简便,便于进行大规模独立实验操作,啮齿类动物的CTEPH模型仍是多项研究中应用最多的。小体型动物中,大鼠血压和人接近,对急性缺血和低氧的耐受性强,易饲养,经济适用,取材容易,无须多人合作,便于进行病理生理学机制及药物治疗的大规模样本研究。小鼠具有完备的基因组和蛋白质组数据库,便于今后基因和蛋白质方面的研究,通过基因敲除小鼠可深入探讨疾病的病因。还有研究[9]显示,兔的纤溶系统与人类较接近,兔的肺组织结构以及肺段分布和血管形态也与人类相似,且兔性情温顺,体积适中,利于做肺动脉造影等影像学检查,也是较理想的实验动物。
1.1 大鼠的CTEPH模型
建立大鼠CTEPH模型常用的方法是自体血栓注射,如Wu等[10]在探究CTEPH大鼠模型的炎症作用中采用的方法(图1):麻醉前1 d,使用玻璃毛细管从眼眶静脉采血,置于无菌培养皿中过夜。在实验的第1天,用生理盐水将过夜的血液凝块从玻璃毛细管中冲出,然后在栓塞当天修剪到约1.1 mm×3.0 mm大小的凝块。用10%水合氯醛(通常0.3 mL/100 g)麻醉大鼠,在无菌条件下暴露左颈外静脉,继而将已制备的血凝块以大约0.5 mL/min的速度注射到左颈静脉,栓塞后,如果大鼠出现发绀以及呼吸加速,则停止注射。第一次栓塞后第4和11天,在相同条件下重复手术,腹腔注射氨甲环酸(200 mg/kg)抑制内源性纤溶系统。最后一次栓塞3周后,对大鼠进行血流动力学分析(通常进行右心导管检查测量肺动脉平均压)。随后立即用水合氯醛麻醉对大鼠实施安乐死。根据不同的研究目的,进行相应的取材,然后进行后续的组织病理或相关分子分析(图2)。

注:图A为经颈静脉注射自体血栓,图B为每日腹腔注射氨甲环酸200 mg/(kg·d),图C为多次肺血栓栓塞症诱导形成CTEPH模型。
然而,由于血栓栓塞模型中会出现自发血栓溶解而导致PAP增高不可持续或不一致,报告的CTEPH动物模型具有广泛的异质性。因此最近的研究开始对CTEPH模型中的许多变量进行修改和调整,包括栓塞材料(如葡聚糖微球、陶瓷微球和空气)、栓塞操作的频率(如连续/每日、每周和每两周),以及实验条件(通气量和氧合水平等)[11-14]。最近,Karpov等[12]通过反复静脉注射部分生物可降解的海藻酸钠微球建立大鼠CTEPH模型,其特征是特异性肺血管重塑,运动耐量降低,右心室收缩压持续升高,此模型有望用于相关药物的临床前测试。
关于小鼠的CTEPH模型,目前国内外无详细报道,可能是小鼠对栓塞的耐受性相对较差,实验操作难度较高,且小鼠PAP测定的相关操作难度较大,因此有关小鼠CTEPH 模型的建立与应用进展相对缓慢。
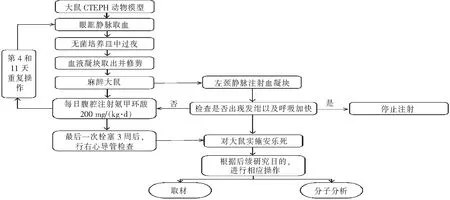
图2 自体血栓经颈静脉注射法建立大鼠CTEPH动物模型流程图
1.2 兔的CTEPH模型
与兔CTEPH模型相关的国内外研究较少,通常也是采用经颈静脉反复多次自体血栓栓塞的方法:对于麻醉后的家兔,常规颈部备皮和消毒,切开皮肤,暴露颈外静脉,经颈外静脉插入中心静脉导管,插入深度约3 cm,经导管缓慢注射制备好的血栓3~5条后,经导管推注生理盐水10 mL,再进行缝合。第一次注入血栓后2、4、8周,重复上述麻醉和实验步骤[15-16]。
2 大动物的CTEPH模型
目前,已在大型动物模型中进行了多项CTEPH的病理生理学研究。对于猪、羊和犬使用了不同的栓塞方案和材料,包括空气、自体血凝块和葡聚糖凝胶珠等。这些模型中使用到的测量方法包括使用留置导管或Swan-Ganz导管测量PAP,以及使用Swan-Ganz导管、长期植入的流量探头或通过超声、心脏磁共振扫描或压力-容积环路导管测量心输出量和每搏量。压力-容积环路导管还可测量右心室-肺动脉耦合,测量右心室如何应对增加的后负荷[17]。尽管栓塞后PAP急剧增加,很少有研究者在长期随访期间成功建立CTEPH模型[17]。理想情况下,自体血栓能诱导CTEPH,并模拟血栓释放的潜在因子以及与血栓相互作用的细胞对这一过程的影响。然而,用自体血栓诱导CTEPH的研究很大一部分失败了,这最初被归因于动物体内存在比人类更活跃的纤溶系统[2,18]。因此应用氨甲环酸抑制动物体内的纤溶系统就显得尤为重要。研究发现,用氨甲环酸抑制纤溶系统并在犬体内成功建立CTEPH模型[19]。描述CTEPH动物模型的建成通常包括三个主要终点:(1)肺血流动力学的功能评估;(2)右心室的功能评估;(3)肺血管疾病和右心室重塑的组织学和分子特征。在这方面,对于大动物模型可使用临床相关诊断工具进行全面的评估,如右心导管插入术和先进的成像技术,以及组织学和分子水平的表征,且便于对新的诊断工具以及新的治疗策略进行最佳评估。
2.1 猪的CTEPH模型
在目前的大量研究中,一种方法是通过对猪进行左肺动脉结扎和右下肺节段动脉的进行性栓塞,以模拟血栓栓塞引起的近端阻塞[20-23]。另一种方法是使用较小的微球来阻塞肺血管系统,通过比较注入微球的数量与肺血管床中存在的相同大小的血管分支的数量,可估计肺血管系统阻塞的相对数量。在这些研究中,PAP和肺动脉阻力在栓塞过程中下降,但随着时间的推移而缓慢但渐进地增加,并在停止栓塞后仍然升高。有研究[24-26]表明,由于肺循环储备较大,成功诱导CTEPH的先决条件包括重复栓塞操作要达到40%~60%的肺血管系统阻塞。在猪的体内,尽管有大量的栓塞,但只有当栓塞联合慢性抑制内皮型一氧化氮合酶时才会发生持续的CTEPH[22],这也表明,CTEPH的发展有赖于内皮功能障碍。这些发现与Rothman等[22]的一项研究一致,后者使用了大小类似的陶瓷珠,但未能在猪身上成功诱导持续的CTEPH。相反,当在犬中使用类似的方案时,在未抑制内皮型一氧化氮合酶的情况下成功诱导了CTEPH[13]。
猪体积大,且实验操作相对方便,对有创操作耐受性较好,其肺叶、肺小叶的分界以及肺动脉的解剖与生理都与人类相似,因此为较理想和常用的大动物模型。
2.2 犬的CTEPH模型
通常,会应用自体血栓注射,联合氨甲环酸抗纤溶系统建立犬的CTEPH模型,如唐春香等[27]在一项犬CTEPH模型及双能计算机断层扫描和单光子发射计算机断层扫描的比较性研究中,采集犬15 mL新鲜血液制成的自体血栓经右侧股静脉导管注入股静脉,并于栓塞前及栓塞后l h分别行相应的影像学检查。术后连续3 d每餐喂食氨甲环酸(110 mg/kg),抑制其自身纤溶系统。每隔2周重复穿刺、测量、栓塞、扫描、测压及喂药过程,直到PAP达到犬的肺动脉高压标准值(收缩压>30 mm Hg,舒张压>15 mm Hg,或肺动脉平均压>20 mm Hg),然后处死动物[27]。另一种常用方法是向犬的右颈静脉注入陶瓷微珠,建立犬的CTEPH模型。通常使用的陶瓷微珠直径为3 mm,而PAP和肺动脉阻力在每次注射后1周内常恢复正常,因此需在第一次栓塞后的第2、4、8周分别重复进行栓塞,以维持PAP的稳定上升[28]。而当使用0.1~0.3 mm的微球时,需60 d的重复栓塞以增加PAP。60 d后,PAP出现稳定升高,但无支气管动脉肥大、高流量血管病变或近端血管阻塞[29]。然而随着疾病的进展,当肺毛细血管床损伤>50%时,静息状态下肺动脉平均压会>25 mm Hg。虽然犬性情凶猛,且实验成本较高,但犬的血管明显易找,具有独立的肺循环和体循环系统,能模拟研究机体对血栓的反应,血流动力学、凝血和纤溶系统的变化情况以及机体神经体液及炎症因子的变化等,同时也可用于评估常用的临床影像学诊断方法[14,27]。
3 展望
虽然目前已进行了多项CTEPH动物模型相关的研究,但要建立完全模拟人类CTEPH的动物模型仍较为困难,理想的CTEPH动物模型需包括:血栓持续存在并伴肌化、肺动脉高压的持续存在、因血管内血栓未溶解产生的慢性肺动脉阻塞、非阻塞部位肺微小血管病变以及右心室结构重建。在具体的实验研究中需根据实验目的选择适当的实验动物及相应的建模方法,以便取得最佳的实验结果。CTEPH动物模型可广泛用于描述CTEPH的发生和发展以及干预过程中可能存在的性别差异[30],以及进一步阐明心肺运动试验在慢性血栓栓塞性疾病和CTEPH患者中的重要性。未来,CTEPH动物模型的应用将更加广泛,可在啮齿类动物或小动物中进行电生理学机制的研究,同时可在大动物模型中进行新型抗心律失常药的研究[31](表2)。

表2 CTEPH相关动物实验