生物肥对螺蛳养殖稻田底泥微生物数量的影响
郑炳言,李威锋,罗福广,王志强,李艳和
(1.华中农业大学水产学院/水产养殖国家级实验教学示范中心,武汉 430070;2.广西柳州市渔业技术推广站,广西 柳州 545006)
近年来,广西壮族自治区柳州市的“网红美食”螺蛳粉暴红,螺蛳粉的热潮瞬间席卷了全国各地。螺蛳粉食品产业的飞速发展也进一步带动了其上游产业螺蛳养殖业的发展。然而在螺蛳养殖业不断发展的同时,还存在一定的问题,如大规模螺蛳养殖少、养殖技术条件落后、养殖户思想观念跟不上等[1],导致螺蛳出现供不应求、质量低等现象。而螺蛳产量与质量一般会受其养殖环境的影响,如何改善螺蛳养殖环境受到养殖户们的高度重视。螺蛳是一种底栖动物,其生命活动与土壤有着直接的联系,所以改善土壤的环境能够直接地影响到螺蛳的生长状态[2]。微生物是土壤生态系统中一个重要的组成部分,作为分解者,微生物参与了生态系统中的能量流动和物质循环关键的一环,其生命活动也影响了土壤的肥力和生产力[3,4]。土壤中细菌可以将一些有毒害作用的物质转为含氮有机质等有用物质,同时将一些不可利用的物质分解为可利用物质等[5,6]。土壤中的放线菌和真菌可以分解纤维素、木质素和果胶等物质,分解的产物同样也参与到土壤的物质循环中。放线菌和真菌的大量菌丝也可以松动土壤改善土壤的性质和土壤里的氧气环境,促进植物根系对氧气和营养物质的吸收[7]。土壤中的微生物对土壤环境的变化尤为敏感,所以其数量变化可以直观地反映土壤环境和理化性质的改变。但是目前有关螺蛳养殖环境中微生物的数量和群落结构的研究不够充分,了解螺蛳养殖稻田底泥微生物的数量变化和群落结构,对实际生产中掌握底泥生产力和肥力以及养殖动物的产量有着重要的意义。
本研究利用稀释涂布平板法调查分析了养殖螺蛳稻田在施肥前后底泥微生物的数量变化及种类鉴定情况,为养殖螺蛳稻田生物肥的进一步施用提供前期数据和改进意见,为评价螺蛳养殖稻田底泥微生物状况及为水产养殖有益优势菌的应用提供参考。
1 材料与方法
1.1 采样
底泥样品来自里高镇的养殖稻田。里高镇位于广西壮族自治区柳州市柳江区西南部。采集样本的稻田有7块,每块稻田的面积为667 m2,在7块稻田中(编号为1号、8号至13号试验田),1号为不施生物肥,只投喂饲料,3 d喂1次,每次20 kg;8号至10号只施生物肥,首次施肥6 000 kg/hm2(2020年11月2日),其后每半个月追肥1 650 kg/hm2;11号至13号施生物肥,首次施肥6 000 kg/hm2,其后每半个月追肥1 650 kg/hm2(与8号至10号稻田施肥时间一致),且额外投喂饲料,3 d喂1次,每次300 kg/hm2。
每块养殖稻田取新鲜表层底泥500~600 g,每块稻田分5个点均匀取样,采集后置于无菌封口袋中混匀、封口、贴好标签,于泡沫盒中加冰冷藏保存。采样次数为10次,采样时间点分别是首次施肥后0、3、7、14、21、28、59、90、118、149 d。
1.2 样品处理
从底泥样品中均匀称取0.4 g底泥置入5 mL EP管中,在超净工作台内,向其中加入3.6 mL ddH2O,在快速混匀器上振荡使底泥充分溶解,使底泥均匀分散成为底泥悬浮液,在28℃、140 r/min条件下于振荡培养箱振荡20 min;静置待混合液完全分层后在无菌条件下吸取1 mL上清液移入2 mL EP管中,此时的微生物悬浮液的稀释倍数是101,静置1 h;待悬浮液完全分层后吸取上清液0.2 mL至新的2 mL EP管中,加入1.8 mL ddH2O充分混合,此时的微生物悬浮液的稀释倍数是102;摇匀,吸取0.2 mL于新的2 mL EP管中并加入1.8 mL ddH2O,以此类推至稀释倍数为105。将上述不同稀释倍数的菌悬液分装好并置于4℃冰箱保存,做好标记,密封保存。
1.3 微生物分离与计数
土壤微生物数量测定采用平板菌落计数法。细菌采用牛肉膏蛋白胨培养基,真菌采用马丁-孟加拉红培养基,放线菌用高氏一号培养基。细菌、真菌、放线菌分别取10-3、10-1、10-2的浓度梯度[8]。全程在无菌环境下进行,向培养基中加入菌液后用涂布棒均匀涂布。接种完成后,用封口膜将培养皿密封,使用北京林帆康达仪器设备有限公司的SPX-150B智能型生化培养箱,在28℃恒温下倒置培养(细菌24 h、真菌96 h、放线菌144 h)。培养完成后观察分离菌株的菌落形态、大小、颜色、边缘形态、是否隆起、光泽等特征,对单菌落进行计数、拍照并于4℃下进行封口冷藏保存。统计菌落数,并按下列公式计算活菌数量(CFU/g)。

1.4 微生物DNA提取与扩增
采用Lysis Buffer法提取菌株的DNA,对菌株的DNA进行PCR扩增,PCR反应体系为25μL:正反引物各1μL,PCR Mix 2.5μL,ddH2O 17.25μL,dNTPs 1μL,Taq酶0.25μL,DNA模板2μL。细菌、放线菌采用原核生物16SrRNA通用引物(27F:AGAGTTTGATCCTGGCTCAG;1492R:GGTTACCTTGTTACGACTT);真菌采用真核生物ITS序列引物(ITS1:TCCGTAGGTGAACCTGCGG,ITS4:TCCTCCGCTTATTGATATGC)。PCR反应条件:94℃预变性5 min;95℃变性30 s,50℃退火30 s,72℃延伸90 s,32个循环;72℃终延伸10 min;4℃保温。通过琼脂糖凝胶电泳观察扩增结果。PCR扩增产物直接送武汉擎科生物科技有限公司进行测序。
1.5 系统进化分析
根据16SrRNA序列(细菌、放线菌)、ITS序列(真菌)相似性分析和系统发育关系分析,鉴定该菌株所属的种属。从GenBank选取相近菌株的序列与测序序列用MEGA7.0软件使用比邻法构建菌株系统进化树,对被鉴定菌株的分类地位进行进一步的分析。
1.6 数据分析与处理
采用Excel 2016软件绘制微生物数量随采样时间变化的折线图,采用SPSS23.0软件对指标进行相关性分析和系统聚类分析。
2 结果与分析
2.1 稻田底泥微生物培养计数结果与数量变化
细菌的数量占有明显的优势,平均占比达97.32%。从图1可以看出,第一次施肥过后(2020年11月2日),除1号稻田外各稻田底泥中的细菌数量有了明显提升,1号稻田细菌反而减少了73.15%,而8号、9号、12号、13号稻田的菌落数分别上升了273.14%、307.73%、463.06%和63.00%,其中12号稻田的细菌数量上升幅度最为明显(图1,第2次采样)。10号稻田细菌数量的增加滞后于其他稻田(图1,第3次采样)。施肥一段时间后,各稻田细菌数量出现一定的下降。在追肥后,各稻田的细菌数量大幅度增加,除8号稻田外均出现了最大值,1号稻田细菌数量最大值为2.19×107CFU/g,9号、10号稻 田 细 菌 数 量 最 大 值 分 别 为3.15×107、3.92×107CFU/g,11号、12号、13号稻田细菌数量最大值分别为3.20×107、2.47×107、3.84×107CFU/g(图1,第5次采样)。相比于前7次采样的底泥细菌数量来说,后3次采样底泥细菌的数量明显减少,维持在较低水平,在一个较小的范围内波动并趋于稳定。

图1 施肥后各稻田底泥细菌的数量变化
真菌占稻田底泥微生物总数的0.82%,在第一次施肥之前,土壤中供真菌吸收的营养物质不足,而新的养分还未添加到稻田中,此时真菌数量处于一个较低水平。第一次施肥后除了9号、10号、12号稻田真菌数量增加以外,其他稻田的真菌数量均下降,涨幅最大的是9号稻田(图2,第2次采样),随后1号稻田的真菌数量出现短暂的上升,其他稻田的真菌数量变化不大(图2,第3次采样)。在第一次追肥之后除1号、11号和13号稻田的真菌数量下降外,各稻田的真菌数量均增加,并出现了最大值,其中8号稻田的真菌数量上升最大,出现了峰值,达1.33×105CFU/g,其次是9号稻田的4.95×104CFU/g和10号稻田的4.49×104CFU/g(图2,第5次采样)。在追肥一段时间后,第6次采样时各稻田的真菌数量出现下降,最后趋于平稳。

图2 施肥后各稻田底泥真菌的数量变化
放线菌占稻田底泥微生物总数的1.86%。由图3可以看出,第1次采样时,放线菌数量最多的是13号稻田,为8.75×104CFU/g,其次是12号稻田的3.75×104CFU/g,说明这2块稻田底泥中的初始放线菌数量较多。在第一次施肥后,1号、8号、10号稻田的放线菌数量出现了一定的增加,其中1号稻田放线菌数量增幅最大(图3,第2次采样)。相反,11号、12号、13号稻田的放线菌数量相较于施肥前出现了下降,但在施肥一段时间后缓慢上升(第3次采样)。在追肥后除了1号和13号稻田的放线菌数量有所上升外,其他稻田的放线菌数量均出现了下降(图3,第5次采样)。但在追肥一段时间后(第6次采样时),除13号稻田外,各稻田放线菌数量均上升,其中12号稻田放线菌数量上升至最高,为6.75×104CFU/g,其次是11号稻田的5.50×104CFU/g。在第7次采样后,放线菌的数量变化与细菌、真菌数量变化趋势相同。

图3 施肥后各稻田底泥放线菌的数量变化
2.2 稻田底泥微生物数量的系统聚类分析
将7块稻田的底泥微生物总数进行系统聚类分析,由聚类谱系(图4)可以看出,7块稻田可被分成2类,一类是10号稻田,另一类是1号、8号、9号、11号、12号、13号稻田;进一步细分成了3类,8号、9号、11号、12号、13号为一类,1号、10号稻田各为一类。
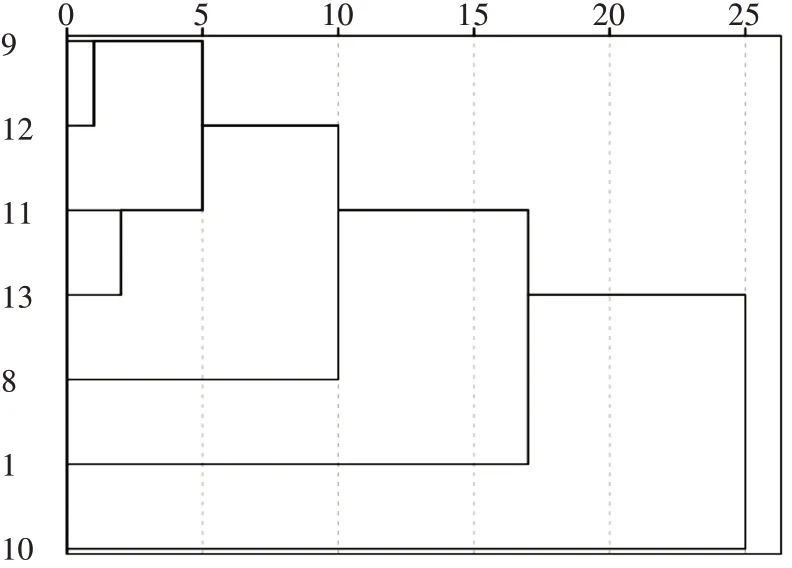
图4 使用组间联接的7块稻田底泥微生物总数量的系统聚类谱系
2.3 稻田底泥微生物的鉴定
通过形态特征,结合分子手段,将培养出来的微生物进行鉴定分析。分析结果(图5)显示,鉴定出的细菌主要包括2个门,其中数量较少的一类是厚壁菌门(Firmicutes),多数为革兰氏阳性菌,属于G+C含量较低的一类细菌;共鉴定出属于厚壁菌门的细菌有芽孢杆菌属(Bacillus)、假芽孢杆菌属(Fictibacillus)、葡萄球菌属(Staphylococcus)3个属。其中数量较多的一类细菌是变形菌门(Proteobacteria),这是一类革兰氏染色呈阴性的细菌,因其形态变化多样而得名,大多数营兼性或者专性厌氧及异养生活;其中包含假单胞菌属(Pseudomonas)、希瓦氏菌属(Shewanella)、沙雷氏菌属(Serratia)、不动杆菌属(Acinetobacter)、食酸菌属(Acidovorax)5个属。真菌鉴定出1门(图6),为子囊菌门(Ascomycota),这些真菌由于有性阶段形成子囊和子囊孢子而得名,其中含1科丛梗孢科(Moniliaceae)1属曲霉属(Aspergillus)。
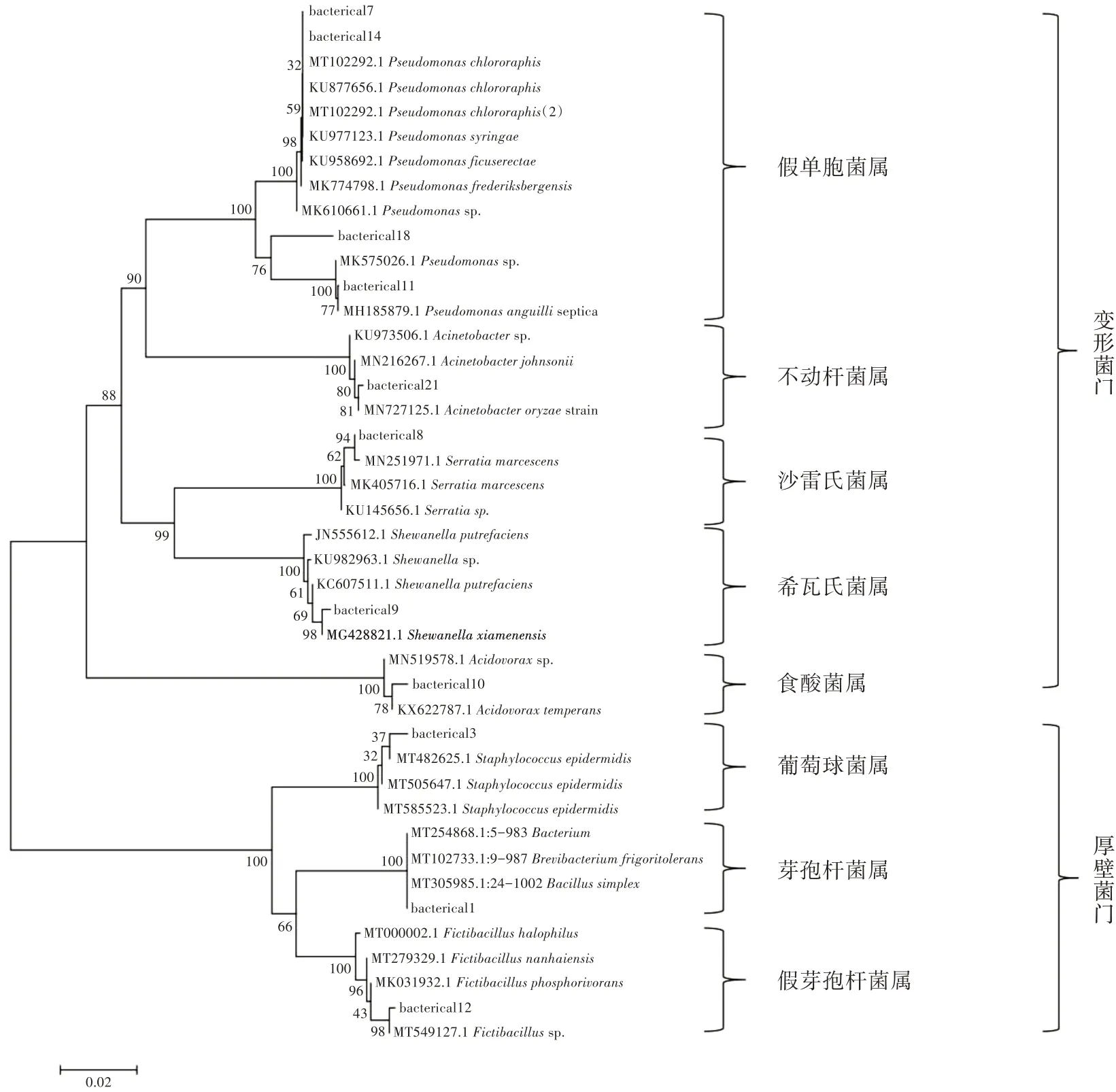
图5 基于分离菌株的16Sr RNA基因序列同源性构建的系统发育树

图6 基于分离菌株的ITS序列同源性构建的系统发育树
如表1所示,鉴定出的细菌中,优势菌种为芽孢杆菌属(56%~99%)和假单胞菌属(15%~64%)。芽孢杆菌在培养基上呈现白色、圆形、有光泽、凸起的菌落形态,而假单胞菌呈现黄色、圆形、有光泽、凸起的菌落形态。真菌主要是曲霉,在培养基上呈辐射状生长,中间呈黑色,周围长出放射状的类似毛玻璃的孢子群,且3个曲霉之间会形成明显的分界线,不会发生重叠。放线菌从上方看主要是呈现粗糙、干燥的圆形菌落,中间凹、周围凸。

表1 螺蛳养殖稻田底泥微生物鉴定分类
3 讨论
3.1 施生物肥对稻田底泥微生物数量的影响
施肥是农业生产中的一个重要的措施,通过施肥可以使得肥料中的物质与土壤成分相互作用,改善土壤生态环境和理化性质,促进作物的生长。土壤是一个复杂的生态系统,其中充满着各种有机质、无机质、土壤酶以及土壤微生物,其中,微生物是一个非常重要的活性成分,土壤微生物的群落结构又可以间接反映土壤的肥力以及致病能力[9]。在土壤微生物中,细菌占有绝对的数量优势,放线菌在土壤中的数量普遍也多于真菌,成为土壤微生物中的第二大类。本研究中,稻田底泥细菌的数量超过了稻田底泥微生物的97%,占绝对的优势,这与曹延珺等[10]和谭宏伟等[11]以及Debosz等[12]的研究结果一致。大量研究表明,增施肥料是提高土壤肥力的主要途径,施肥是通过改变土壤的理化性质,影响微生物的生存环境,从而提高了微生物的数量和活性[13-15]。罗莉等[16]研究发现施肥后土壤细菌和放线菌数量随着处理时间的变化先升高后降低,而真菌则是呈逐渐降低的趋势。本研究发现,在施肥后微生物数量总体上呈先迅速增加后缓慢减少的变化规律;在后期随着每半个月一次的追肥,施肥对微生物的影响已经很小,微生物数量保持在较低水平,分析可能与生物肥的肥效和试验后期土壤肥力等指标的变化有关。可以通过增加追肥频率或者增加追肥量或者提高肥料中营养物质的比例来提高肥力。
通过相关性分析发现,稻田底泥细菌数量与真菌数量存在低度的线性正相关,推测可能是稻田里微生物的生长与真菌的生长有一定的耦合关系,细菌的某些代谢产物可能被真菌利用,这个推测与Mackie等[17]的研究相符合。而细菌与放线菌、放线菌与真菌之间的相关性很小,但由于本研究是采用实验室培养基法分析微生物种类,其种类不能完全反映底泥里的所有微生物种类,因此,细菌与放线菌、放线菌与真菌之间的相关性是否确实很小有待进一步研究。
系统聚类分析结果的3类与稻田的施肥处理类别的3类出现了一定的差异,可能与各稻田微生物基数大小和对施肥的反应存在一定的关系。分析稻田的微生物数量可以发现,1号稻田仅投喂饲料,虽其底泥微生物的基数很大,但后续由于没有进行施肥,微生物的数量相比于其他施肥的稻田较少。8号稻田在施肥前,底泥中的真菌较多,而细菌和放线菌较少,但是施肥后,细菌生长迅速占据了主导地位,一定程度上限制了其他2种菌的生长。10号稻田的微生物基数最小,且通过微生物数量变化趋势可以看出,每次施肥后,10号稻田微生物数量的增长相对于其他稻田有一定的延迟,且试验后期也一直维持在较低水平,明显低于其他施肥处理的稻田,这也与10号稻田微生物基数小有一定的关系。而11号、12号、13号3个稻田的微生物基数较大,对施肥和投喂饲料的反应也较快。9号稻田的微生物基量虽不大,但是对施肥的反应较好;分析认为可能是肥料中的微生物有利于改善9号稻田的微生态环境,能够促进稻田中原有的有益微生物生长,帮助创造一个更适合微生物生长的环境。
3.2 稻田底泥微生物的种类鉴定与优势种
通过分子生物学的方法鉴定出了厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的11种细菌以及子囊菌门(Ascomycota)的4种真菌,未能鉴定出放线菌。程莹寅等[18]直接分析草鱼养殖池塘底泥细菌的DNA,鉴定了变形菌门、厚壁菌门、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)以及未知菌。Jangid等[19]通过高通量测序鉴定出不同耕作类型土壤中的细菌,发现变形杆菌的数量最多,占30.6%~43.2%,其次是酸杆菌,占17.1%~26.2%。这些研究证明,变形菌门和厚壁菌门的种类是土壤中常见的细菌,其中一些种类也在水产养殖生产中起到十分关键的作用。根据实验室测定的螺蛳测产数据可以发现,12号稻田的螺蛳生长情况最好,其增产率为57.86%。而11号稻田螺蛳的生长情况较差,并出现大量死亡。微生物培养结果表明,12号稻田芽孢杆菌的数量明显处于优势,可能是螺蛳养殖稻田的有益优势菌占比大的原因,而11号稻田里出现了表皮葡萄球菌,推测可能是螺蛳的致病菌,或者其破坏了螺蛳健康稳定的生长环境进而导致螺蛳的死亡。因此,在实际生产中可以在生物肥中额外添加芽孢杆菌等有益菌类,通过施肥改善螺蛳养殖稻田底泥微生物的群落结构,以达到螺蛳养殖更高产的目的。有研究者将枯草芽孢杆菌(Bacillus subtilis)作为水质改良剂添加到池塘中,发现养殖水体中的氨氮、亚硝酸盐氮和硫化物的浓度有明显的减少,水体的pH也出现了下降[20,21]。同时可以通过监测螺蛳养殖有害菌的存在与生长情况而及时预防与控制螺蛳养殖病害问题。
王继伟等[22]研究甘肃小陇山日本落叶松人工林土壤优势真菌时发现,青霉属(Penicillium)和曲霉属(Aspergillum)是该土壤的优势真菌。本研究鉴定出的真菌都是曲霉属的真菌,分析曲霉可能是土壤中较为常见的真菌,是优势真菌之一,其对土壤腐殖质的形成具有推动作用,能够增加土壤肥力,改善环棱螺生产环境[23]。因此本研究鉴定出的细菌以及真菌,可能对水产养殖中的水质和底质改良具有潜在的功能,随着微生态制剂和生物肥的研究和发展,将本试验鉴定出的菌种作为添加剂的一部分是一种可行的方案。
4 小结
施肥可以明显提高螺蛳养殖稻田底泥中微生物的数量,施肥后底泥中3类微生物的数量都是随着时间的推移先迅速上升然后缓慢下降。施基肥和第一次追肥后微生物数量上升很快,且在第一次追肥后达到了最高值。分析鉴定了对螺蛳生长可能有益的微生物种类如芽孢杆菌,为后续在螺蛳养殖生产中可以通过施肥、添加微生物制剂等措施改善稻田底泥环境提供参考价值。

