红藻门仙菜科Ceramiaceae的分类现状与展望*
丁兰平,刘美媛,闫盼竹,王艺晓,王雪聪,黄冰心
(天津师范大学生命科学学院,天津动植物抗性重点实验室,天津 300387)
仙菜科Ceramiaceae隶属红藻门Rhodophyta仙菜目Ceramiales,作为红藻门中的重要类群,由Dumortier[1]于1822年建立。仙菜科海藻广泛分布于世界各地海岸,大部分属暖温带海域[2],仅有少数几个种分布于淡水生境[3,4]。仙菜科海藻多生长于低潮线附近的岩石上或珊瑚上,或附生、缠绕于其他海藻藻体上,或与其他海藻混生,其也是浮动码头上污损生物群落的主要组成部分[5]。仙菜科海藻具有良好的应用价值,其含胶丰富,可制琼胶,如三叉仙菜Ceramiumkondoi可用于制造低凝固点琼胶[6],钩凝菜Campylaephorahypnaeiodes和波登仙菜Ceramiumboydenii也是制作琼胶的良好辅助材料,且可供食用,钩凝菜还具有良好的药用价值[2]。
仙菜科海藻藻体大多数为单轴型,少数为多轴型,多为丝状,皮层有或无;生长点在藻体顶端,顶端细胞分化形成一列中轴细胞;皮层的发生最初在节部产生一圈围轴细胞。仙菜科部分藻类的围轴细胞不再分裂;部分分裂并延伸至节间,使节部和节间均包裹皮层。仙菜科海藻进行无性生殖可产生四分孢子或多分孢子等,四分孢子囊无柄或有柄;部分可进行有性生殖,有性生殖中精子囊常生于特殊的分枝上,成簇或散生于皮层内;果胞枝由4个细胞组成,受精后,由支持细胞或其他相关细胞形成辅助细胞,产生产孢丝,再由产孢丝产生果孢子囊,成熟的囊果裸露或被藻丝总苞包围[2]。
有关该科的分类研究,如Hommersand[7]、Abbott[8]、Itono[9]、Huisman & Kraft[10,11]、Huisman[12]、Ballantine & Wynne[13]、Stegenga[14,15]、Searles & Schneider[16]、Stegenga & Bolton[17]、Abbott & Norris[18]等,先后发表了该科的新属和新种。然而,随着研究的深入,新方法、新观点等不断涌现,新的鉴定特征被采纳,导致仙菜科的分类系统随之变化。因此,其科级以下分类系统、系统演化和物种数目在不同历史时期的变化比较大,存在许多争议。本文介绍目前国际上仙菜科分类学上的各种变动,为学术研究与教学提供参考依据。
1 分类学研究现状
1.1 国际仙菜科分类、系统变迁与争议
1.1.1 国际仙菜科系统变迁与争议
最早对仙菜科开展研究的主要有Dumortier[1]、Nägeli[19,20]、Nägeli & Cramer[21]等。Dumortier[1]于1822年建立了仙菜科。Nägeli[20]于1861年描述了23属18亚属,最早提及红藻初生纹孔栓(Pit plugs)和仙菜科的果胞丝(系)(Procarps),但他忽视了分类等级[22],目前,他描述的亚属至少有2个被提升为属级,他描述的另外几个属被划入顶丝藻目和杉藻目。其后,Bornet & Thuret[23,24]、Schmitz[25]、Zerlang[26]、Phillips[27,28]和Oltmanns[29]等学者认识到果胞丝(系)在红藻分类中的重要性,并对其展开详细研究。
仙菜科比较现代的分类研究是由Schmitz[30]于1889年进行的,他划分了15群(Family)及1个位置未定群(非正式,偶尔使用“Gruppe”)40属,但Choi等[31]于2008年将其划分为14群39属。Schmitz & Hauptfleisch[32]于1897年仍沿用Schmitz的系统,但Athanasiadis[4]写成25群40属、Choi等[31]写成24群40属。De Toni[33]沿用Schmitz的15个已知分类等级,但把“群”作为“亚科”处理,仍使用“ieae”作为后缀。Kylin[34]不太关注“群”,而是把仙菜科分为2个进化支。第1进化支,果胞丝(系)生长在不定生轴上,包括Crouanieae、Wrangelieae和Ceramieae;第2进化支,果胞丝(系)仅生长在定生轴上,包括Spermothamnieae、Griffithsieae、Monosporeae、Callithamnieae和Ptiloteae。他发现在第1进化支中存在螺旋分枝,并认为螺旋分枝上的果胞枝(carpogonial branch)可作为进化的过渡标志。Feldmann-Mazoyer[35]在采纳Kylin仙菜科分类系统基础上把Schmitz的“群”作为“族”(tribes)处理,并增加4个新族;在Kylin的第1进化支中增加Callithamnieae、Dohrnielleae、Ptilocladiopsideae和Spyridieae 4个族,维持第2进化支Spermothamnieae、Griffithsieae和Ptiloteae 3个族,并增加Compsothamnieae和Sphondylothamnieae 2个族,但与Kylin的一样,仅限于地中海的分类群;在Crouanieae族中保留对丝藻属Antithamnion,并把之前认为是对丝藻属、拟对丝藻属Antithamnionella和扁丝藻属Pterothamnion(=Platythamnion)的物种归入其中。Itono & Tanaka[36]建立了Crouanieae的第4个属,巴里藻属Balliella。现在,这4个属各自归入不同的独立族[3]。
Kylin[37]又使用了“Gruppe”的称谓,列出11群61属,并增加8个位置未定的属。他坚持了Feldmann-Mazoyer的大Crouanieae族(Kylin称之为“群”)的观点,包括12属,但他认为对丝藻属、拟对丝藻属和扁丝藻属在遗传上具有特殊性。
然而,Hommersand[7]指出,果胞丝(系)的位置高度可变。基于营养枝类型、果胞枝的特定细胞排列和受精后的发育模式,他把仙菜科分为两个亚科:(1)Crouanioideae (包括Callithamnieae、Crouanieae、Spyridieae和可能的Wrangelieae 4个族)和(2) Ceramioideae [包括Antithamnieae(新建立)、Ceramieae、Compsothamnieae、Dasyphileae、Dohrnielleae、Griffithsieae、Ptiloteae和Spermothamnieae 8个族]。在新族Antithamnieae中,包括之前属于Crouanieae族的9个属,即端枝藻属Acrothamnion、对丝藻属、拟对丝藻属、Ballia、Bracebridgea、Heterothamnion、扁丝藻属、羽枝藻属Ptilocladia和Warrenia。他也认为松节藻科Rhodomelaceae、红叶藻科Delesseriaceae和绒线藻科Dasyaceae作为独立进化枝(并系)产生于Antithamnieae。
Wollaston[38-54]显著地扩大了人们对印度-太平洋Crouanieae、Antithamnieae、Dasyphileae族成员的认识,并新建立了Heterothamnieae族,描述了几个新属。之后许多世界同行跟随了她的研究[9,14,55-58]。
Itono[9]也强调了果胞丝(系)和受精后的发育特征,但他把仙菜科划分为3个亚科:(1)Antithamnioideae,包括Antithamnieae、Ceramieae、Crouanieae、Delesseriopseae、Dohrnielleae、Heterothamnieae、Spyrideae、Warrenieae和Wrangelieae 9个族;(2) Callithamnioideae,仅包括Callithamnieae族;(3) Compsothamnioideae,包括Compsothamnieae、Dasyphileae、Griffithsieae、Ptiloteae、Spermothamnieae和Sphondylothamnieae 6个族。然而,Moe & Silva[55]认为仙菜科的物种都来源于一个共同的祖先,因此他们拒绝采纳亚科的分类等级,主张自然地划分为18族。
之后,仙菜科(或仙菜目)增加了几个新的分类群,如新族Liagorothamnieae[59]、新属Inkyuleea[60]、Irtugovia[61]和Elisiella[62],以及对丝藻属、拟对丝藻属和Perithamnion属中报道的几个新种。
根据系统发育分析,Athanasiadis[3,4]建议仙菜科按Itono的3亚科[Antithamnioideae(Athanasiadis认为是Ceramioideae)、Callithamnioideae和Compsothamnioideae]处理,并增加1个未定位置的亚科级分类单位。支序分析表明,仙菜亚科Ceramioideae存在几个单系群(过去的独立族),支持Hommersand关于仙菜目3科(松节藻科、红叶藻科和绒线藻科)与仙菜科并系发生的进化观点[3]。
根据上述基于形态的意见和建议,仙菜科超过180属890余种(包括几个淡水种),是仙菜目的第二大科(第一大科为松节藻科),在红藻门中也是比较大的科。
仙菜目中科的起源问题,早期有些不同意见,有人认为绒线藻科、红叶藻科和松节藻科来源于单个共同祖先[63],也有人认为它们来源于该科的独立进化支[7,37]。但随着系统发育分析方法的介入,多数分类学家接受绒线藻科Dasyaceae、红叶藻科Delesseriaceae、松节藻科Rhodomelaceae和Sarcomeniaceae (DDRS)都起源于仙菜科的观点。
仙菜科早期的分子系统发育分析(主要使用rbcL、SSU rDNA、LSU rDNA和COX2-3)主要目的是用来研究各级分类系统及进化关系,但结果往往相互矛盾[60,64-70]。Freshwater等[64]的研究属于分子数据中比较早的文献,其结果不支持上述的仙菜目进化观点。Saunders等[65]的研究结果却支持了Athanasiadis[3]的观点。Saunders等[65]的研究结果又与Jong等[66]部分不一致,但后者的研究结果支持了仙菜目的科级系统可分成2大类群(Callithamnioideae和Ceramioideae)且该目中较早的松节藻科、绒线藻科和红叶藻科均来源于仙菜科。Choi等[60]的研究结果表明,Inkyuleea在仙菜目中的位置较远,但其研究缺少Callithamnioideae的物种数据支持。Harper & Saunders[69]也利用LSU rDNA研究仙菜科的关系,但仅有3个属(扁丝藻属、纵胞藻属Centroceras和篮子藻属Spyridia)的3个种。这些研究仅包括来自于仙菜科的有限物种,且它的亚科和/或族之间的系统关系并没有得到恰如其分的评价,无法对DDRS复合体的大多数类群做精确定位。
Choi等[31]利用分子数据,研究仙菜科部分物种的进化关系,把过去主要以形态学特征为基础的仙菜科划分为5个科,结果见表1。

表1 Choi等(2008)的仙菜科分类系统
其他还有一些学者以经典分类学[71-81]和/或分子辅助的分类学方法[82-87]研究仙菜科不同类群的物种。其中,Secilla[79]以“广义”和“狭义”来区分仙菜科分类系统,主要以形态学特征为基础的称为“广义仙菜科”(Ceramiaceae sensu lato),主要以分子数据为基础的称为“狭义仙菜科”(Ceramiaceae sensu stricto)。因此,广义仙菜科即为与DDRS并列的科,狭义仙菜科仅含5个族及1个未定位置族。但Secilla在自己的著作中使用了广义仙菜科,将巴西的仙菜科划分为16个族,却没有采纳亚科的概念。Mateo-Cid等[81]赞同仙菜科存在亚科和族的划分,并介绍仙菜科共有24族120属,显然他也接受了广义仙菜科的观点,因为狭义仙菜科目前只有14个确定的有属的族。
Guiry & Guiry[88]在AlgaeBase中综合之前学者的意见,列出了狭义仙菜科分类系统,结果见表2。
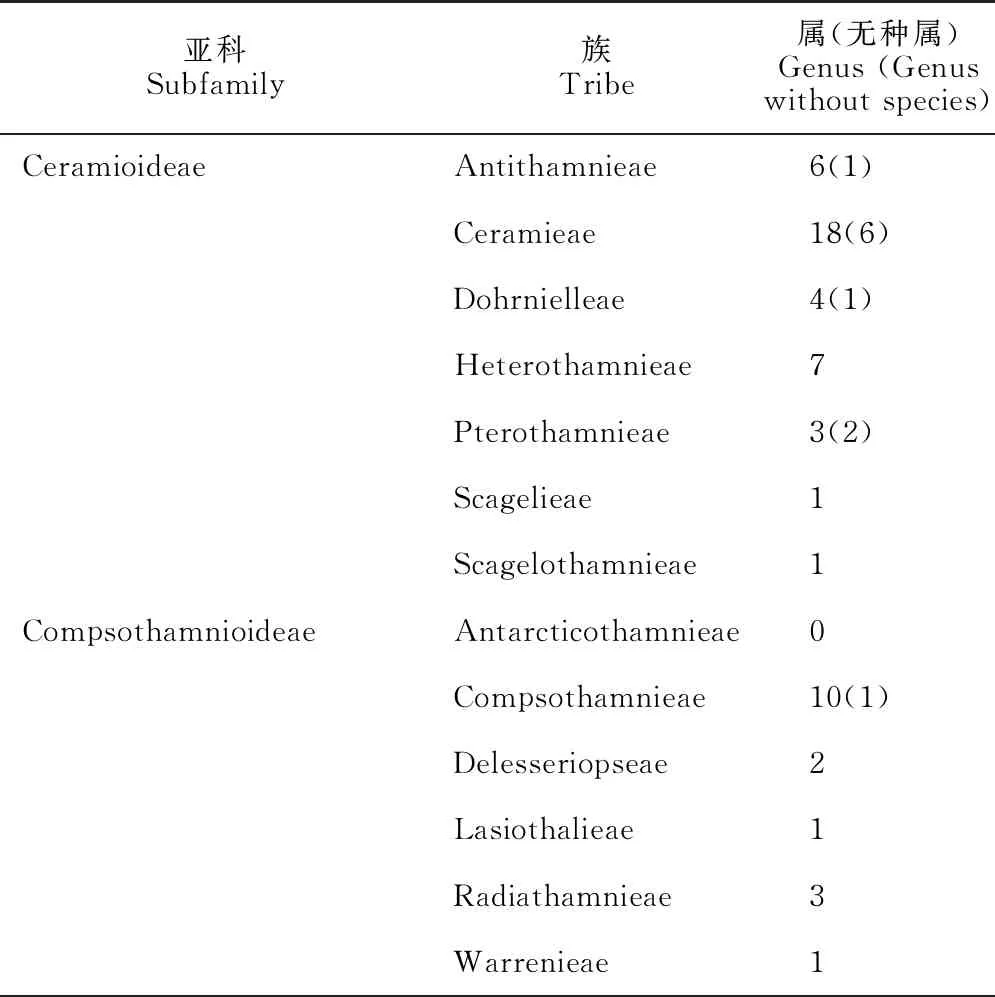
表2 狭义仙菜科Ceramiaceae sensu stricto的分类系统[88]
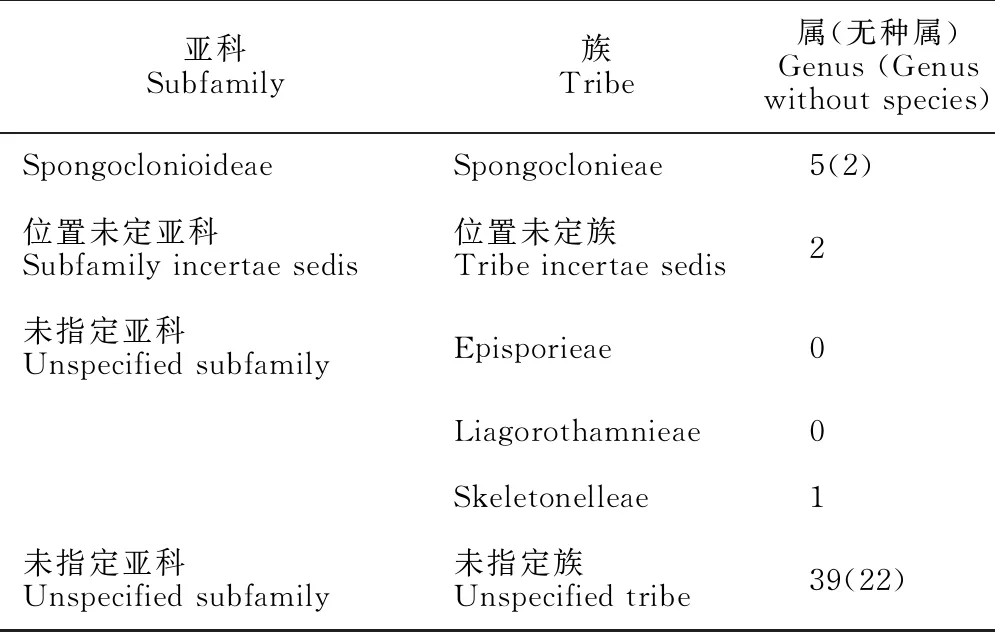
续表
很明显,若选用狭义仙菜科系统(表2),过去的广义仙菜科系统就被大大缩减(表1)。但从文献报道来看,利用分子方法仍无法有效解决科下类群的划分[88](表1,2),体现了该方法的局限性。
1.1.2 国际仙菜科中属种分类现况
仙菜科建立以来的近200年里,不断有新属和新种被报道,也不乏有研究对特定地区仙菜科物种进行归纳。其中仙菜属Ceramium是仙菜科中最大的属[89],广泛分布于热带至极地海岸[90-92]。近20年来,该属常有新种被报道[89,90,93-95]。目前,北太平洋地区已报道的仙菜属物种约60种[84,93,96]。表3和表4分别总结了国外仙菜科海藻部分研究报道及仙菜科中和我国相关的23个属的物种数目。
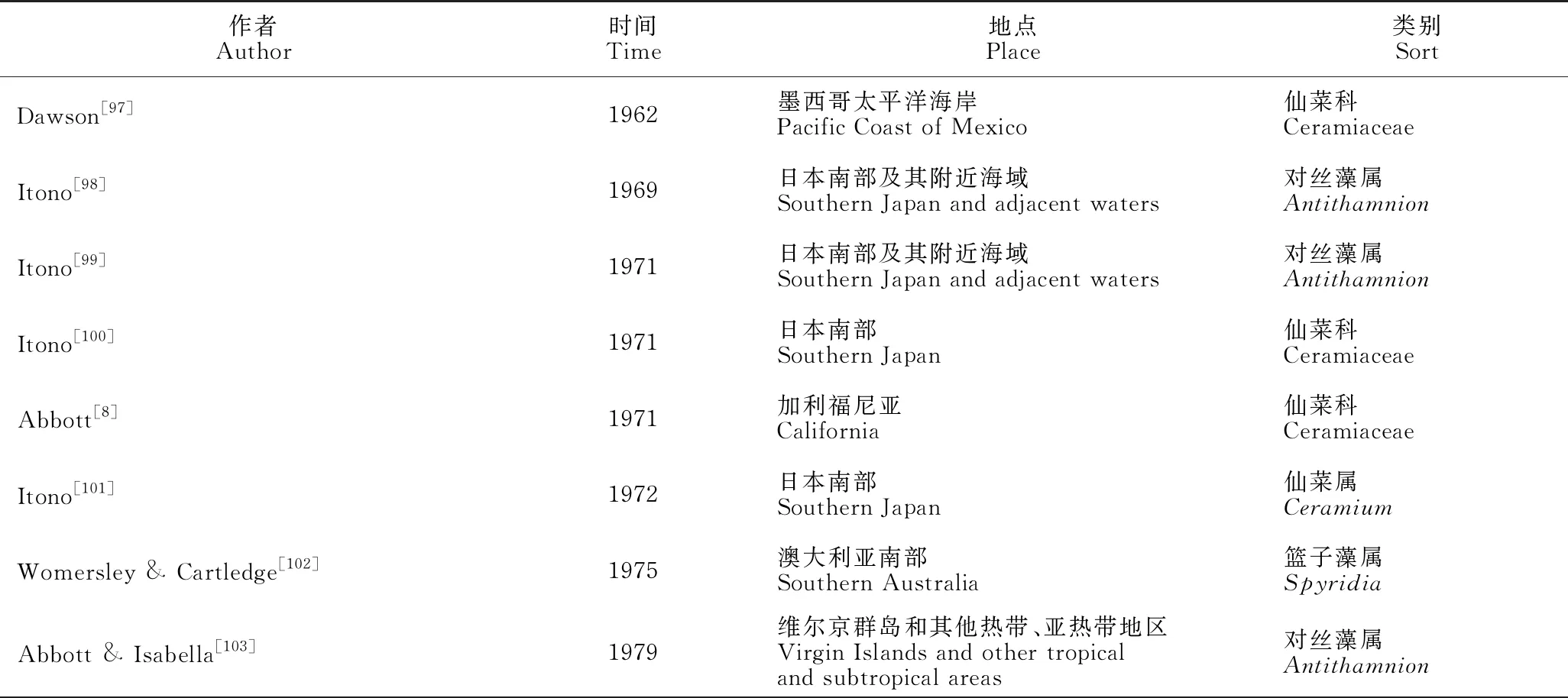
表3 国外仙菜科海藻部分研究报道

续表

表4 仙菜科中与中国相关的23属[91]物种数目统计[88]

续表
1.2 我国仙菜科分类学研究现状
我国目前已报道仙菜科共23属[2,113-117](表4)。其中仙菜属海藻25种[2,113,114,117,118](表5),其他属在我国均较少报道,大多数的属仅有1-3种,最多5或6种[2,113-119],且具有参考价值(含藻体特征描述)的少。近年来,笔者报道了艳丽藻属Gayliella5个种[91,120],分别是分布于西沙群岛的短毛艳丽藻Gayliellafimbriatum,台湾的优美艳丽藻G.flaccidum,西沙群岛的泰式艳丽藻G.taylorii,汕头的马沙艳丽藻G.mazoyerae和汕头的横轴艳丽藻G.transversalis,其中前3个种是从仙菜属归并至艳丽藻属的。这是近来年我国仅有的研究报道。
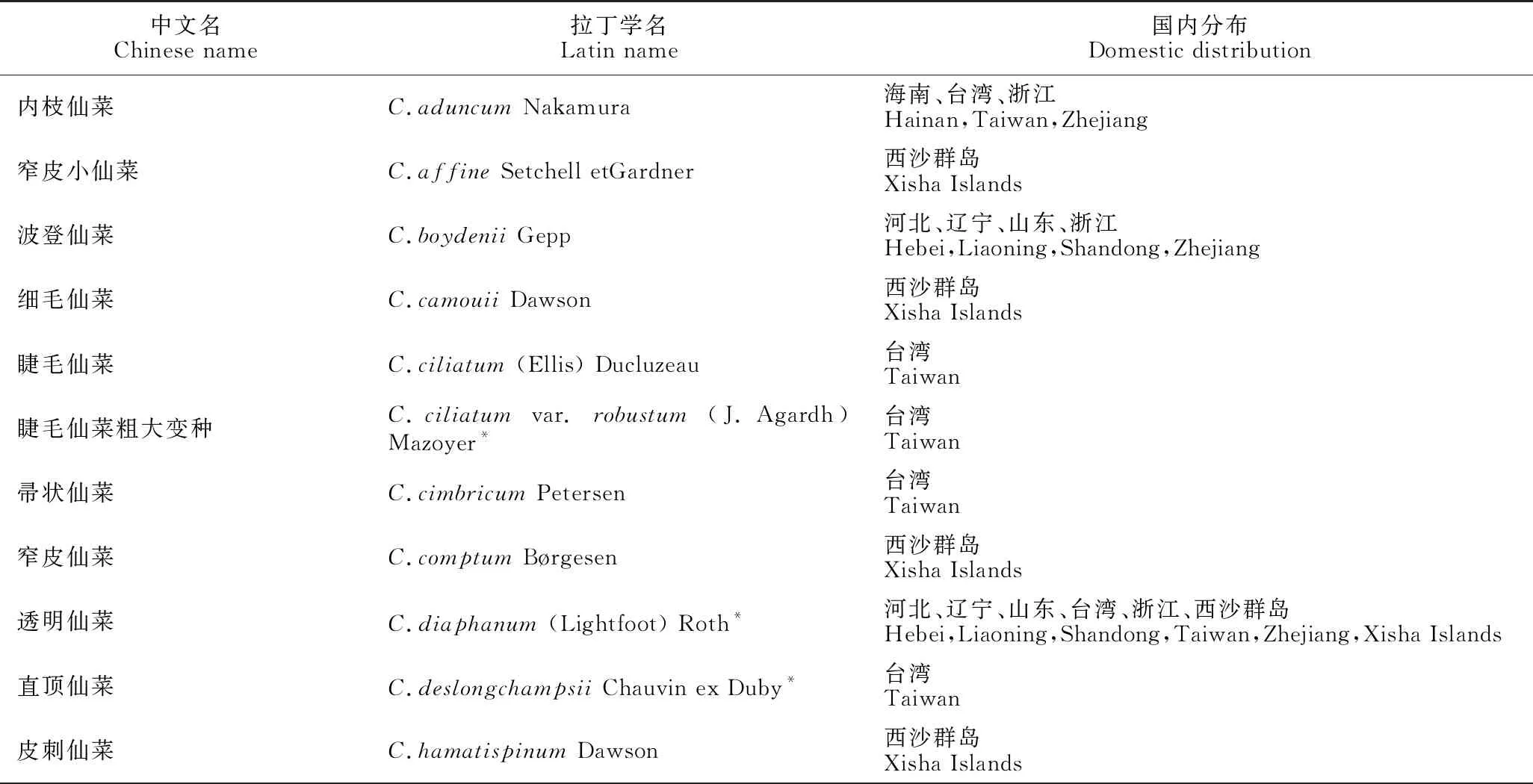
表5 中国仙菜属物种地理分布

续表
2 存在的问题
2.1 国际仙菜科分类系统研究存在的问题
2.1.1 分类问题
由于不同学者所持学术观点不同,仙菜目中科级划分也有不同。如在《中国海藻志》中仙菜目(Ceramiales)分类系统依据Kylin的DieGattungenderRhodophyceen和Yoshida的《新日本海藻志》编排,分为仙菜科、绒线藻科、红叶藻科和松节藻科4个科[2,89];而Schneider & Wynne[121]把仙菜目分为仙菜科、红叶藻科、Sarcomeniaceae、绒线藻科和松节藻科5个科;Choi等[31]从仙菜科中分离出Callithamniaceae、Inkyuleeaceae、Spyridiaceae和Wrangeliaceae 4个科;根据Díaz-Tapia & pasella[122]的观点,目前有9个被承认的科,其中Ceramiaceae、Wrangeliaceae和Rhodomelaceae已确定,而其他6个科需要重新分类,并且提出一个新目Inkyuleeales。
另外,虽然仙菜科是仙菜目中地位稳定且物种数目最多的科,但是由于科级分类单元的划分差异、分子系统学探讨的不断深入、同物异名和错误鉴定等,仙菜科下属级分类单元的划分也存在很大争议。根据Wynne & Schneider[123]的分类系统,过去属于仙菜科的一些属被重新归入新科,如丽丝藻属、绢丝藻属和短丝藻属3属被列入Callithamniaceae;冠毛藻属、喜毛藻属、小柯达藻属、凋毛藻属、毡藻属、多孢藻属和软毛藻属7属被列入Wrangeliaceae;篮子藻属被列入Spyridiaceae。还有一些属因科的重新划分位置尚不确定[123]。除此之外,如上文所述,仙菜科物种起源、分子系统发育分析部分相悖及仙菜科分类系统分为狭义和广义两种、部分分类内容不统一等问题,都为该类群的分类、类群划分以及物种数量统计带来了困难。
2.1.2 仙菜科物种鉴定问题
由于仙菜科大部分物种藻体微小、柔弱且形态多变[90],其属间和属内物种的分类还缺乏令人满意的界定[124]。其中有些报道只列出了物种的学名,缺乏具体的特征描述,此类报道的准确性还有待验证。Wollaston等[43]根据藻体小枝及腺细胞等特征,将对丝藻属的一些物种移至拟对丝藻属,这些特征能否支撑物种的属名重置有待检验。Cho等[125]指出优美仙菜复合体(Ceramiumflaccidumcomplex)(包括短毛仙菜C.fimbriatum、优美仙菜C.flaccidum、横列仙菜C.gracilimum和泰式仙菜C.taylorii4个物种)可能是一种新组合,但没有一个通用的名称来命名。Cho等[126]提出的艳丽藻属,目前已被国际主流学术界所接受[120]。虽然他们选用了目前国际上比较通用的分子标记用于系统发育分析,但这些分子标记并不是物种鉴定的关键特征标记,其研究结果还需要更多的证据支持[127,128]。
另外,物种的同物异名及物种原变种与变种的区分不明显、错误鉴定等对仙菜科物种鉴定也产生了较大影响。针对爱尔兰西海岸的C.gracillimum[129]、佛罗里达的C.byssoideum[130]和百慕大的C.transversale[131],Bφrgesen[132]认为C.byssoideum和C.transversale是C.gracillimum的同物异名,Feldmann-Mazoyer[133]认为C.byssoideum是C.gracillimum的变种C.gracillimumvar.byssoideum。墨西哥太平洋海岸的C.masonii[134]与C.gracillimum相似,且在营养藻体结构上与欧洲C.transversale的相同,但四分孢子囊却在节部规则地轮生,而欧洲种的四分孢子囊则1-2个偏生于节部一侧。Taylor[135]仍把C.masonii作为C.byssoideum处理。
除了上述两大类问题,仙菜科海藻的地理分布特点也有待研究与探讨。Won[136]认为在诸多研究中仙菜科海藻虽然被称作是“世界性”的物种,但实际上其地理分布是有限的,而其他物种则具有更广泛的分布模式。
2.2 我国仙菜科分类系统研究存在的问题
2.2.1 分类系统问题
关于仙菜科的分类系统,国际上存在科属分类不明确、分类系统不统一等问题。我国对该类群的深入研究较少,仅为学者根据个人判断或观点取舍,部分学者采用分子系统发育学为主,部分支持以传统形态学为主,影响了我国该门类物种的准确归类,其分类系统的分类界限有待细化。
梁成伟等[137]利用rbcL基因序列分析了烟台和威海的柔质仙菜,吴菲菲[138]利用 COI、UPA 和 LSU 基因序列分析了山东半岛潮间带仙菜属的透明仙菜、日本仙菜、三叉仙菜、柔质仙菜和绢丝藻属的绢丝藻Callithamnioncorymbosum等海藻。近十年,国内主要有笔者课题组对仙菜科展开的分类学研究,将原归于仙菜属的短毛仙菜、优美仙菜、泰式仙菜归并至艳丽藻属[120],并发现了3个我国新纪录种,即周锥仙菜Ceramiumpericonicum、温氏仙菜C.womersleyi和盖斯纵胞藻Centrocerasgasparrinii[91,120]。但也仅对三叉仙菜、波登仙菜、纵胞藻等进行分子及形态结合鉴定,因为仙菜科物种个体较小且柔弱,样品保存困难、DNA易降解,DNA序列扩增不易成功等问题,所以也为分子系统发育分析带来了困难。
2.2.2 鉴定问题
仙菜科的藻体细小,有的属间或种间差异极小,如凝菜属与仙菜属在外形上的不同之处仅为基部固着器的细胞组成,而赫勃对丝藻Antithamnionhubbsii与日本对丝藻A.nipponicum的差别为第一回羽状枝的细胞数目和第二回对生枝的对数。同一物种也可能因环境不同或成熟度不同而出现不同的形态特征,如株高、细胞大小等[2,9],都可能造成同物异名、错误鉴定等问题。我国报道的横列仙菜,也把Ceramiumgracillimumvar.byssoideum、C.byssoideum和C.transversale作为其异名处理[2]。目前认为这个种广泛分布于世界各地,但历史上命名混乱。这些问题对物种鉴定和数量统计等相关研究工作带来极大困难。由于该科海藻在我国海藻区系中分布广泛[2],也给物种地理分布特点研究及多样性研究增加巨大的工作量。另外,取样困难、生境恶化、人才流失、研究手段冲突落后、研究者知识掌握不全面等问题,均给该科海藻分类研究造成极大阻碍[139]。
2.3 分子标记在仙菜科系统发育分析中存在的问题
系统发育分析采用特定算法计算生物间的进化关系,其关系用进化树来描述。近年来被广泛用于红藻系统发育的是DNA条形码技术[140]。据报道,利用分子工具结合形态学分析可以解决种、属、科和门等几乎所有水平的分类问题[141]。目前,被用于仙菜科分类学的分子标记主要有rbcL、rbcS、LSU、SSU和COI等。Cho等[126]利用LSU和rbcL序列分析建立了新属——Gayliella,Lee等[142]利用rbcS对Antithamnion及其近缘属进行了分析,Kostrezwa 等[143]分析了对丝藻Antithamnionsp.的rbcL和rbcS,Bruce & Saunders[144]对Ceramiumsecundatum做了基于COI的群体遗传分析。
然而,通过分析,笔者认为目前国际上推荐的用于系统演化研究的上述基因序列与传统生物分类关键表型不一致,由其构建的系统树无法代表物种树,因为它们几乎都为营养性功能基因,与当前生物学中真实“物种”界定标准(生殖隔离)存在差异[127,128]。随着物种样本数量的增加,其缺陷就会越来越明显。这导致近年来国际上仙菜科的研究出现两个明显的趋势:(1)基于基因型的系统不稳定,全面系统性的研究工作(如著作类)趋向于选取比较稳定的经典分类系统[79,81];(2)基于表型的局限性,属、种等热点研究趋向于选取分子辅助的形态分类学方法(MAAT),这也是当前国际上红藻门的最新分类研究趋势[82,85-86,145-150]。
3 展望
仙菜科的分类研究,既取得了成绩,也存在许多问题。由于它们自身的独特性,在传统分类(表型分类)方面存在一定的问题,而当分子生物学技术和方法引入后,一些新的问题又相继发生。因此,如何同时从表型与基因型两方面着手,开展相关研究,揭示其真实的物种系统发育关系,是值得探讨的问题。
在形态分类学方面,解决物种样本的采集、储存,关键鉴定特征的具体化,以及生物地理分布特征划分等具有重要意义。同时,具有丰富知识储备及研究经验的高水平研究者必不可少,这也是目前学科最缺乏的资源。
在分子系统发育学方面,关键是要筛选合适的分子标记,构建真实的物种树,这应该是学科探索的主要方向。只有保持与现代生物学中物种(基于进化论的物种)形成一致的分子标记,由其所构建的系统树才最接近物种树,才能更真实地反映形态分类学的分类系统内涵。
相对地,当前的仙菜科系统发育研究仅仅是开始,纠正不足,选用合适的分子标记,开展深入研究正当时。以形态学为基础,辅以关键分子标记的DNA条形码技术,有助于更好地进行物种鉴定、分类系统构建等工作,研究结果将更全面、准确,才能为仙菜科分类学研究提供有力支持。

