体外膜肺氧合治疗对成人暴发性心肌炎患者细胞因子表达谱的影响
刘锋锋,郑建杰,刘淼淼
(西安交通大学第一附属医院心血管外科,陕西 西安 710061)
暴发性心肌炎是由病毒感染、自身免疫性疾病、毒素/药物毒性等原因导致心肌炎性损伤心脏功能受损,是心肌炎中最严重和特殊的类型,起病急骤,进展迅速,患者很快出现血液动力学异常和严重心律失常,早期病死率极高[1-2]。暴发性心肌炎患者出现异常免疫系统激活,导致免疫细胞向多个组织器官募集浸润,细胞因子释放和过度的免疫应答所致的“细胞因子风暴”亦可造成多脏器功能衰竭(如:呼吸衰竭、肝功能衰竭、肾功能衰竭等)[3-4]。以生命支持为依托的综合救治方案是暴发性心肌炎的中心环节[5]。体外膜肺氧合(Extracorporeal membrane oxygenation,ECMO)是重要的呼吸循环支持手段,对暴发性心肌炎的救治中已获得大量临床数据支持[6-7]。但有关ECMO对暴发性心肌炎患者细胞因子表达谱的影响罕见相关报道。因此,本研究首先分析了暴发性心肌炎患者细胞因子表达谱,并观察ECMO治疗对暴发性心肌炎患者细胞因子表达的影响。
1 资料和方法
1.1 一般资料 本研究方案通过西安交通大学第一附属医院伦理委员会审批,入组患者法定监护人、对照者均签署知情同意书。入组2017年4月至2021年6月在我科就诊的成人暴发性心肌炎患者28例,所有患者诊断均符合《成人暴发性心肌炎诊断与治疗中国专家共识》[5]的标准,病例纳入标准:①临床表现包括短时间内发生心慌、心悸、胸闷、胸痛、黑曚、晕厥、呼吸困难等;②心电图检查发现心律失常、ST段改变,心脏彩超检查发现弥漫性室壁运动减低、收缩功能异常;③实验室检查发现多种心肌损伤标志物(包括:肌钙蛋白Ⅰ、脑钠肽、肌酸激酶同工酶MB)急性升高。排除标准:①有其他心脏病史(如:风湿性心脏病、先天性心脏病、心肌梗死等);②恶性肿瘤患者;③合并慢性病毒感染者;④孕产妇。入组同时期在我院体检中心进行健康查体的志愿者19例作为对照组。暴发性心肌炎组28例,男19例,女9例,年龄21~50岁,平均(37.9±8.2)岁。对照组19例,男12例,女7例,年龄19~51岁,平均(36.1±10.7)岁。两组一般情况比较无统计学差异(P>0.05),具有可比性。所有暴发性心肌炎患者均接受ECMO治疗,死亡6例,存活22例,存活率为78.57 %。存活患者ECMO治疗时间为(105.7±11.9)h。在ECMO治疗期间,并发症包括出血3例,肺部感染2例,下肢血栓2例。
1.2 研究方法
1.2.1 主要仪器和试剂:ECMO为德国MAQUET Cardiopulmonary AG产品(型号规格:Rota Flow);低温离心机为美国Sigma公司产品;Luminex 200多功能液相芯片分析平台为美国Millipore公司产品。14种细胞因子Luminex分析试剂盒(Human Cytokine Magnetic Luminex Performance Assay 14-Plex Fixed Panel)为美国R&D公司产品(货号:LKTM011)。
1.2.2 ECMO操作过程:ECMO治疗均选择静脉-动脉(V-A)辅助模式,采用普通肝素进行体外生命支持期间的抗凝控制。同侧股动脉、股静脉穿刺置入动脉插管17Fr和静脉插管21Fr,膜式氧合器套包排气后备用,将动静脉连接管分别与穿刺置入好的股、动静脉插管连接后开始转流。股静脉引出未经氧合的血液,经过离心泵和人工膜肺进行氧合后,经股动脉输入机体。所有患者股动脉插管侧远端置入灌注管,与股动脉插管三通侧枝相连,作为旁路为远端肢体供血,避免同侧下肢远端发生缺血坏死。使用ECMO的前48 h,流量设置为较高水平,辅助泵血流量达到患者理想心输出量的80%,然后根据患者心脏恢复情况和血流动力学水平、心脏超声检测,适当下调泵血流量,达到患者理想心输出量的50%。ECMO撤除前48 h,将泵血流量控制在患者理想心输出量的20%~30%,并根据患者情况调整血管活性药物用量。如心脏超声提示患者心脏功能恢复、血压、心率、及氧合平稳,血管活性药物剂量基本减停,ECMO辅助流量降低至1.3 L/min,维持12 h后,再次检测上述指标平稳后撤除ECMO辅助,继续后期的常规治疗。
1.2.3 血清分离:对照组于清晨空腹、暴发性心肌炎患者入院后和ECMO撤除后采集非抗凝外周血5 ml,静置30 min后于4 ℃、1000 r/min离心15 min,收集上层血清,冻存于-80 ℃备用。
1.2.4 细胞因子检测:使用14种细胞因子Luminex分析试剂盒对血清中细胞因子进行检测,包括:干扰素-α(Interferon-α,IFN-α)、IFN-γ、白细胞介素-1α(Interleukin-1α,IL-1α)、IL-1β、IL-1受体α(IL-1 receptor α,IL-1ra)、IL-2、IL-3、IL-4、IL-6、IL-7、IL-10、IL-15、IL-33、血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)。向平板中加入50 μl稀释的血清样本和标准品,然后加入50 μl微粒鸡尾酒(microparticle cocktail),加盖密封后水平摇床孵育2 h。洗涤3次,加入50 μl生物素抗体鸡尾酒,加盖密封后水平摇床孵育1 h。洗涤3次,加入50 μl链霉素-PE,加盖密封后水平摇床孵育30 min。洗涤3次,加入100 μl洗涤缓冲液,水平摇床孵育2 min,加盖密封后水平摇床孵育1 h。使用Luminex 200多功能液相芯片分析平台读板,根据标准曲线计算血清样本中各种细胞因子水平。
1.3 统计学方法 使用SPSS 23.0统计学软件进行分析,所有数据首先经过Shapiro-Wilk正态性检验,符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验或配对t检验。不符合正态分布的计量资料采用中位数(四分位间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验或Wilcoxon配对检验。受试工作者特征(ROC)曲线分析细胞因子预测暴发性心肌炎患者生存结局。所有检验均为双侧检测,P<0.05为差异有统计学意义。
2 结 果
2.1 暴发性心肌炎患者细胞因子表达谱变化 暴发性心肌炎组和对照组血清中均未检测到IL-3表达。IFN-α、IFN-γ、IL-1α、IL-1β、IL-1ra、IL-4、IL-10、IL-33和VEGF水平在暴发性心肌炎组和对照组之间比较差异无统计学意义(均P>0.05),暴发性心肌炎患者血清IL-2、IL-6、IL-7和IL-15水平均显著高于对照组,比较差异有统计学意义(均P<0.05)。见表1。对暴发性心肌炎组存活者和死亡者血清IL-2、IL-6、IL-7和IL-15进行ROC曲线分析,IL-2曲线下面积(AUC)为0.583,95%可信区间(CI)为0.347~0.820,P=0.538(图1A)。IL-6 AUC为0.871,95%CI为0.740~1.002,P=0.006(图1B)。IL-7 AUC为0.598,95%CI为0.371~0.826,P=0.467(图1C)。IL-15 AUC为0.609,95%CI为0.408~0.811,P=0.417(图1D)。IL-6的生存结局预测效能良好,IL-2、IL-7和IL-15的生存结局预测效能较差。

图1 预测暴发性心肌炎预后的ROC曲线
2.2 暴发性心肌炎存活患者ECMO治疗后血清细胞因子水平变化 22例存活的暴发性心肌炎患者在ECMO撤除后采集外周血,检测血清中IL-2、IL-6、IL-7和IL-15水平。血清IL-2、IL-7和IL-15水平在基线和ECMO撤除后的差异无统计学意义(均P>0.05),血清IL-6水平在ECMO撤除后显著低于基线,差异有统计学意义(均P<0.05)。见表2。
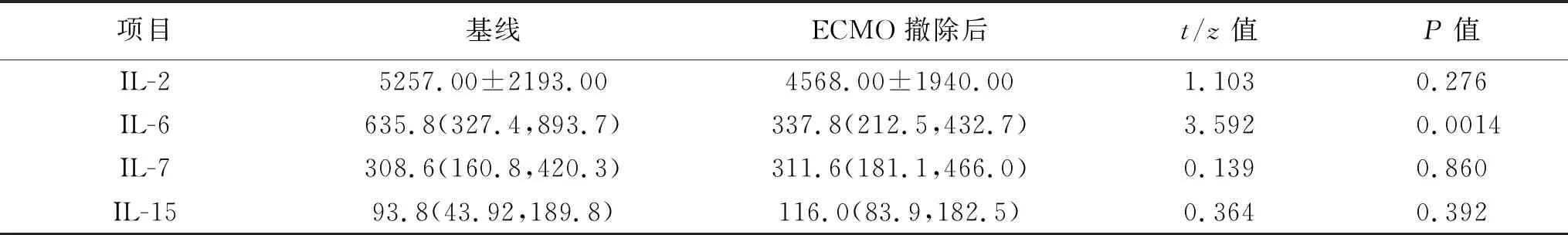
表2 暴发性心肌炎存活患者ECMO治疗后血清细胞因子水平变化(pg/ml)
3 讨 论
成人暴发性心肌炎患者行ECMO治疗的临床效果显著,可使机体组织灌注得到有效改善,提高救治成功率[8-10]。免疫因素参与了暴发性心肌炎等因素诱导的心肌损伤[11],特别是病毒感染、自身免疫等因素造成的多种免疫细胞和免疫分子调控紊乱促进了暴发性心肌炎的疾病进程。部分危重型新型冠状病毒病(Coronavirus disease 2019,COVID-19)患者亦可并发暴发性心肌炎,ECMO治疗可有效降低心肌损伤[12-13]。本研究结果发现,ECMO治疗后暴发性心肌炎患者存活率为78.57 %,与既往报道结果相似[8-10],进一步说明ECMO在暴发性心肌炎治疗中的重要作用。
IL-6是一种多效性细胞因子,主要由活化的T细胞和成纤维细胞分泌,具有调节免疫应答、急性期应答、抗感染免疫等功能,特别是在固有免疫应答中发挥重要作用。柯萨奇病毒B3感染促进IL-6、IL-1β、IL-8等多种细胞因子分泌,促进中性粒细胞向心肌募集浸润,诱导病毒性心肌炎发病[14]。完全弗氏佐剂在免疫应答初期即可促进IL-6分泌,诱导自身免疫性心肌炎发病[15]。在一例COVID-19并发暴发性心肌炎患者中,疾病早期患者血清IL-6水平升高,接受机械通气、抗病毒及免疫调节治疗、连续肾脏替代治疗等综合治疗后患者肺部病变仍然进展,氧合无法维持,IL-6水平进一步升高。使用ECMO治疗72 h后患者循环和氧合均改善,心肌损伤减轻,IL-6水平明显下降[12]。本研究发现,暴发性心肌炎患者血清IL-6水平显著升高,ECMO治疗后IL-6水平显著降低,而IL-6水平升高亦为暴发性心肌炎患者临床预后不良的重要影响因素之一。结合既往发表的结果,这说明IL-6参与了暴发性心肌炎的发病,而ECMO治疗显著降低了IL-6水平,抑制机体免疫应答,促进患者病情恢复。
IL-2、IL-7和IL-15均属于共同γ链细胞因子家族成员,有多种免疫细胞和成纤维细胞分泌,主要发挥促进T细胞、B细胞、自然杀伤细胞、单核巨噬细胞活性的作用,在维持机体免疫稳态、免疫网络平衡中均发挥重要作用[16]。1例转移性肾癌患者接受高剂量IL-2治疗后出现急性进行性呼吸困难、肌钙蛋白水平升高,导致急性心肌炎发生[17],提示IL-2具有心脏毒性。心肌炎患者IL-7受体α链(即CD127)主要表达于巨噬细胞中,IL-7可作为重要的趋化因子,诱导巨噬细胞向心肌募集浸润[18]。IL-15作为促炎因子,可发挥促进自然杀伤细胞功能的作用,在冠状动脉粥样硬化性心脏病促进动脉粥样硬化形成,在心肌炎中则可诱导疾病进展[19]。本研究发现,暴发性心肌炎患者血清IL-2、IL-7和IL-15水平均明显升高,提示共同γ链细胞因子参与了暴发性心肌炎发病,但ECMO治疗对IL-2、IL-7和IL-15水平均无显著影响,而共同γ链细胞因子水平亦不能作为暴发性心肌炎患者的生存结局预测治疗。这可能与暴发性心肌炎患者,特别是病毒感染诱导的暴发性心肌炎患者,经有效治疗后在恢复期仍存在免疫记忆有关[20]。
综上所述,IL-6和多种共同γ链细胞因子参与了暴发性心肌炎的发病。ECMO治疗可有效降低IL-6水平,但对共同γ链细胞因子水平无明显影响,ECMO可能通过降低血清IL-6水平抑制暴发性心肌炎患者炎症应答,促进疾病恢复。

