过表达5-脂氧合酶通路对氧糖剥夺/复氧小胶质细胞增殖、凋亡的影响
周 爽,王 琰,孙光强,史永恒,王 川,王国全,李 敏,王 斌
(陕西中医药大学,陕西 咸阳 712046)
缺血性脑卒中严重危害人类健康,目前使用纤栓剂溶栓是临床首选治疗手段,但重建血流导致再灌注脑损伤,即脑缺血/再灌注损伤(Cerebral ischemic/reperfusion injury,CI/RI),神经保护治疗则成为应用前景。CI-RI是多种机制参与的一种复杂病理生理过程,研究表明,当脑缺血再灌注发生时,在缺血灶局部存在大量炎症因子,炎症反应是引起脑缺血损伤后再灌注损伤的关键原因之一[1]。因此,通过改善炎症损伤来减轻脑缺血损伤,并可调节炎性因子失衡[2],研究引起损伤的炎症反应无论是对缺血性脑卒中还是对之后的CI/RI都有着重要意义。脑缺血损伤发生后花生四烯酸含量增加,5-脂氧合酶(5-Lipoxygenase,5-LOX)作用花生四烯酸代谢衍生白三烯和生物活性物质的产生,这类活性物质将参与中风后的病理生理过程,例如氧化应激和炎症,还可能促成细胞凋亡[3-4]。5-LOX与炎症性中枢神经系统疾病有关,5-LOX的过表达可能促进炎症细胞因子的产生并导致CI/RI后神经元损伤更为严重[5]。
小胶质细胞(Microglia,MG)是脑内的固有免疫细胞,在CI/RI发生后的炎症反应中起重要作用[6]。在脑缺血损伤后期,由于MG被过度激活,激活后的MG表达产生趋化因子和炎性因子,炎性因子聚集在脑缺血损伤部位,进一步加剧脑损伤[7]。随着MG在中枢神经系统中的日益关注,5-LOX通路也被认为参与了中枢神经系统的炎症反应[8-9],MG中5-LOX通路的下调有助于缺血性脑损伤的恢复,但研究5-LOX,其最大的特点是能够在体内外转染分裂和非分裂的细胞,是一种具有自我失活功能、无免疫反应的高效基因传递工具。并且具有容纳外源目的基因,可将所携带的目的基因整合到宿主染色体中并稳定长期表达、随亲本的繁殖将外源基因传递给子代发挥作用等优点[10]。为根据慢病毒载体技术的进展,提高效率和生物安全性的载体设计,进一步研究5-LOX途径在CI/RI中作用机制。通过建立5-LOX过表达氧糖剥夺/复氧(OGD/R)BV2细胞模型,研究5-LOX在脑缺血炎性损伤中神经保护的作用机制。
1 材料与方法
1.1 材 料
1.1.1 细胞与质粒来源:BV2小鼠MG系购自CTCC。pHBLV-CMV-MCS-3flag-EF1-puro质粒和293T细胞购自天津赛尔生物技术有限公司。脂质体Lipofectamine2000 Reagent购自Invitrogen(美国)。
1.1.2 主要试剂与仪器:LB培养基(Sigma,美国),B型质粒小量快速提取试剂盒(博大泰克,北京),XL1-Blue,EB(Ethidium Bromide北京鼎国,北京),限制型内切酶EcoRI,BamHI和dNTP (10 mmol/L)(Takara,日本),T4 DNA ligase(Promega,美国),无血清培养基Opti-MEM(Invitrogen,美国)。L420型台式离心机(长沙湘仪离心机仪器有限公司),PTC-200型热循环仪(Bio-Rad,美国),CO2恒温培养箱(Thermo Forma,美国),5415D型离心机(Eppendorf,德国),DK-8B型电热恒温水槽购自(上海精宏实验设备有限公司),倒置显微镜和96孔培养板(OLYMPUS,日本)。
1.2 研究方法
1.2.1 BV2细胞培养:BV2细胞是小鼠小胶质细胞株,使用DMEM完全培养基(含有10%胎牛血清,100 U/ml青霉素与100 μg/ml链霉素)在二氧化碳培养箱(5%CO2,37 ℃条件)中培养、传代。
1.2.2 BV2细胞感染过表达5-LOX病毒/对照病毒: pHBLV-CMV-MCS-3flag-EF1-puro质粒载体(图1)。将Alox5序列信息序列直接合成至pHBLV-CMV-MCS-3flag-EF1-puro载体上。复苏并培养的293T细胞,给予DMEM完全培养基。在37 ℃、5%CO2的培养箱中培养293T细胞,培养过程中,每24 h换液,传代比例为1∶5~1∶10。将pHBLV-CMV-MCS-3flag-EF1-puro质粒载体转染293T细胞进行慢病毒包装,收集上清液,浓缩制成病毒颗粒,同样方法构建空载体病毒。病毒颗粒感染BV2小胶质细胞,G418进行细胞致死率筛选,挑选稳定转染的单克隆抗体细胞株。我们将G418药物设置4个浓度梯度来细胞致死率的浓度筛选,浓度设置分别为200、300、400 μg/ml、500 μg/ml。细胞大量死亡出现在第3天到第8天中,除去死亡细胞,收集活下来的细胞形成单克隆,并将感染后的细胞转至96孔板,继续培养。

图1 pHBLV-CMV-MCS-3flag-EF1-puro/Alox5质粒
1.2.3 建立OGD/R 5-LOX过表达BV2细胞模型:5-LOX过表达的BV2细胞在完全培养基中培养,收集第三代细胞,胰蛋白酶将BV2细胞从培养瓶中消化下来,BV2细胞制成悬液。调整细胞密度,将细胞再次接种于细胞培养板中,细胞中的完全培养液更换为无糖Earle’s液,利用三气培养箱37 ℃下(94%氮气、5%二氧化碳、1%氧气)建立缺氧缺糖模型。在氧糖剥夺实验中,BV2细胞分为5-LOX病毒过表达组与CON空病毒载体组,氧糖剥夺分别0、1、2、4 h,复氧12 h,根据显微镜下拍摄OGD处理0、1、2、4 h的细胞形态,确立OGD/R 5-LOX过表达BV2细胞模型。
1.2.4 细胞给药及分组:BV2细胞5-LOX过表达组与空载体对照组给予齐留通(Zileuton)、孟鲁司特(Montelukast)、U75302被用来分别阻断5-LOX,CysLTR1和BLT1通路。将细胞分为以下10组,正常组按照常规细胞培养方法,给予完全培养液,并不进行OGD/R的处理。5-LOX过表达组给予5-LOX过表达病毒转染;除空白组外其他组均进行缺糖缺氧/复氧处理,给药组分别给予Zileuton、Montelukast、U75302处理。见表1。

表1 实验分组与给药
1.2.5 MTT检测OGD/R5-LOX过表达BV2细胞的细胞活性:按照实验分组将细胞接种与96孔板上,除空白组外,均进行OGD/R处理细胞,进行细胞活性检验,除设空白孔外,空载体与5-LOX过表达10个分组,分别各设置3个复孔,分别向每孔加入5 mg/ml MTT 20 μl,放置于(37 ℃,5%CO2)培养箱继续培养4 h,弃去培养液,PBS冲洗,每孔加入150 μl DMSO溶解沉淀。酶标仪将波长设置为570 nm,测出各孔的吸光度值。抑制率=[(对照组-实验组)/对照组]×100%。
1.2.6 流式细胞术检测细胞凋亡:将空载体与5-LOX过表达10个分组的各组细胞用0.25%的胰蛋白酶消化,加入10 μl碘化丙啶(PI)染色液混匀,室温避光20 min,将避光后的细胞置于冰水混合物中,使用流式细胞仪进行检测。PI荧光信号值用纵坐标表示,Annexin-V-FITC荧光信号值表示为横坐标。碘化丙啶染色对正常细胞是无法染色的,LR区域属于细胞膜完整,PI染色。UR区域中的细胞膜破裂,PI和Annexin-V-FITC均可染色。
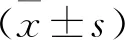
2 结 果
2.1 全基因合成pHBLV-CMV-MCS-3flag-EF1-puro/Alox5质粒测序结果比对 结果显示(图2),Alox5测序结果比对结果显示,pHBLV-CMV-MCS-3flag-EF1-puro/Alox5质粒全基因合成成功。

图2 pHBLV-CMV-MCS-3flag-EF1-puro/Alox5质粒
2.2 5-LOX过表达转染后对BV2细胞形态的影响 细胞形态结果见图3。与空载体对照组氧糖剥夺0 h对比,空载体对照组氧糖剥夺1、2、4 h后细胞数目逐渐减少,细胞形态改变,空白组细胞形态完整,呈现梭形。空载体对照组OGD后细胞逐渐形成“阿米巴状”,5-LOX过表达则增加细胞损伤,给药组分别能减缓细胞的“阿米巴状”。根据前期实验,氧糖剥夺复氧时间,由细胞生长状态改变,我们选取缺氧4 h复氧12 h为脑缺血体外模型。

图3 缺氧不同时间各组细胞形态(PI染色,×200)
2.3 OGD/R 5-LOX过表达对BV2细胞增殖影响 缺氧2 h复氧12 h处理条件下,检测5-LOX过表达的小胶质细胞活力,实验分组同1.2.4。第1组和第6组是未经过OGD/R处理的空白对照组,第2组是空载体OGD/R模型组,第7组是5-LOX过表达OGD/R模型组。空载体对照病毒OGD/R组与空白组相比活力降低,空载体对照组给予Zileuton(第3组)、Montelukast(第4组)、U75302(第5组)后,与OGD/R空载体对照组对比,给通路阻断剂后,细胞活力较对照组有一定提高,且U75302活性优于Montelukast。病毒空载体模型组(第2组)与5-LOX过表达病毒模型组(第7组)对比,5-LOX过表达后细胞活力下降,同样给予Zileuton、Montelukast、U75302组的细胞活性比5-LOX病毒过表达OGD/R模型组(第7组)高,5-LOX过表达Zileuton(第8组)与Montelukas(第9组)对细胞的保护作用基本接近,U75302(第10组)高于Zileuton(第8组)与Montelukas(第9组)。
2.4 OGD/R 5-LOX过表达对BV2细胞凋亡的影响 实验分组同1.2.4。流式细胞仪检测结果显示,在空载体对照病毒中,空白组(第1组)与模型组OGD/R(第2组)对比,OGD/R后细胞的凋亡明显升高,给予Zileuton(第3组)、Monteluka、U75302(第5组)能够减弱凋亡,空载体病毒Zileuton(第3组)明显降低细胞凋亡,接近空白(第1组),Montelukas(第4组)与U75302(第5组)降低细胞凋亡与模型组OGD/R对比差异有统计学意义(均P<0.05)。5-LOX过表达与空病毒空白组对比后,过表达的5-Lox病毒对细胞凋亡增加较小。模型组与空白组对比均具有统计学差异(P<0.01),给药组与模型组对比均具有统计学差异(P<0.01)。
空病毒对照组中,UR和UL区域细胞染色都是0%,在LL区域99%,细胞膜完整,LR区域0.86%,表示仅有极少凋亡细胞;空病毒组OGD/R后,细胞分别在UR区域0.221%,UL区域0.412%,细胞膜破裂,膜内磷脂酰丝氨酸被染色;在空病毒Zileuton组,细胞集中LL区域,UL与UR区域0%,仅有LR区域1.44%的凋亡细胞;空病毒Montelukast组中UL与UR区域0%,LR区域凋亡细胞2.73%;空病毒U75302组中,UL区域0.021%,UR区域0.126%,LR区域2.56%,与Montelukast、Zileuton组对比,U75302组中细胞死亡和细胞壁破裂较多。5-LOX病毒过表达对照组中,UR区域0%,LR区域0.087%,在LL区域90.6%的细胞膜完整,LR区域9.32%,与空载体对照组相比,5-LOX过表达后,细胞膜破裂出现,细胞出现死亡和晚期凋亡;空病毒组OGD/R后,细胞分别在UR区域1.48%,LR区域10.9%,细胞凋亡与死亡进一步增加;5-Lox过表达Zileuton组,细胞4个区域具有分布,UL:0.153%,UR:0.123%,LR:2.56%,细胞凋亡得到改善;5-LOX过表达U75302组中,UL:0.021%,UR:0.126%,LR:2.56%,与Zileuton组对比,U75302组中UR和UL区域细胞染色都是0%,在LL:97.1%,LR:2.87%,表示仅有极少凋亡,细胞死亡和细胞壁破裂减少。
3 讨 论
CI/RI后引起继发性损伤,炎性反应的发生不但与MG等中枢神经系统免疫细胞活化有关[11],损伤发生后小胶质细胞迅速活化,变成具有吞噬能力的“阿米巴状”,同时释放大量细胞因子和炎症介质,会引起继发性脑损伤。5-LOX属于一类称为脂氧合酶的酶,可氧化游离和酯化的多不饱和脂肪酸。5-LOX作用花生四烯酸代谢衍生白三烯,生成白三烯A4(LTA4),LTA4通过其酶促反应转化为白三烯B4(LTB4)和白三烯C4(LTC4)[12-13]。LTB4受体可分为BLT1和BLT2,LTC4可生成半胱氨酸白三烯受体CysLT1和CysLT2,它们可以识别白三烯LTD4、LTD4、LTE4和LTF4。实验结果得出5-LOX过表达增加细胞损伤。以5-LOX过表达病毒转染BV2细胞的手段,通过显微镜拍照观察,在不同缺糖缺氧时间中,细胞形态损伤变化情况。并根据细胞形态,筛选缺糖缺氧复氧模型的时间。BV2细胞采用OGD/R模型,模拟脑缺血再灌注损伤。基于前期对BV2的缺氧实验研究发现,在脑缺血损伤后,BV2被激活,细胞炎性因子增加。本次实验发现缺氧超过4 h就会对BV2的生长造成一定影响,缺氧1 h对细胞影响不大,但也不能很好的造成氧糖损伤模型,缺氧6 h后,细胞呈现“阿米巴状”较多,且BV2细胞的数量减少,细胞存活率下降。实验组最终确立模型时间为缺氧缺糖4 h,复氧12 h模型。
Zileuton作为5-LOX的抑制剂,它可有效地衰减在PC12细胞中的MG介导的鱼藤酮毒性[14]。在实验研究中,5-LOX上调在低氧血症患者的大脑皮层中,5-LOX在MG表达中升高[15]。这些结果表明5-LOX途径与MG炎症引起的神经元死亡有关。LTB4和CysLT1和CysLT2是主要的促炎介质,5-LOX途径在许多疾病中均被激活引起炎症反应[16]。研究发现CysLTs在各种神经调节过程具有重要调节作用,CysLTs及其受体与多种神经退行性疾病相关,例如多发性硬化症,帕金森氏病,亨廷顿氏病,癫痫和阿尔茨海默氏病[17]。抗白三烯药物分为两类:CysLT受体拮抗剂(扎鲁司特,普仑司特和孟鲁司特Montelukast)和LTs抑制剂(5-脂氧合酶抑制剂,例如齐留通Zileuton,ZD2138,BayX1005和MK-0591)。白三烯B4(LTB4)参与多种疾病中发生的炎症,U75302是BLT1受体拮抗剂,LTA4水解酶是LTB4生产中的限速酶,拮抗剂的使用均可以降低炎性反应[18-19]。选择性5-LOX抑制剂Zileuton和CysLTR1拮抗剂Montelukast可减轻胶质细胞的炎性损伤提高细胞活力[20]。U75302是LTB4的受体阻断剂,使用U75302阻断LTB4/BLT1信号通路已被用于缓解各种炎症和线粒体功能障碍[21]。Montelukast是白三烯的受体抑制剂,它可以降低LPS刺激的人类嗜中性粒细胞活化,同时减轻急性呼吸窘迫综合征(ARDS)小鼠模型的炎症[22]。
综上所述,通过探索5-LOX通路在氧糖剥夺/复氧小胶质细胞,我们发现过表达的5-LOX可以介导小胶质细胞OGD/R的损伤和激活。在OGD/R诱导的脑缺血损伤中,5-LOX激活是通过5-LOX过表达介导的BV2细胞中CysLTRs/CysLTs和LTB4/BLTs途径的氧化应激介导的,这一结果能够为脑缺血/再灌注损伤的诊断和临床治疗提供分子基础[23]。

