鼠伤寒沙门菌mgtC基因生物学功能的研究
曹 莉,武周慧,程如楠, 王家伟,吴清民,王 真*
(1. 北京农学院 动物科学技术学院,兽医学(中兽医)北京市重点实验室 ,北京102206;2. 北京大学第三医院 实验动物中心,北京100191;3. 中国农业大学 动物医学院,北京100193 )
沙门菌是一种很常见的食源性致病菌,引起人和多种动物感染。据统计,在所有食物中毒中,沙门菌感染畜禽类食品,而造成人类食品中毒是最为严重的,在细菌性食物中毒占比为42.6%~60%[1]。截止到2007年,沙门菌有多达2600余种血清型,其中能引起人类和畜禽沙门菌病的主要两大血清型是鼠伤寒沙门菌(Salmonellatyphimurium)和肠炎沙门菌(Salmonellaenteritidis)。鼠伤寒沙门菌可导致人的急性胃肠炎,且能够引起小鼠产生全身伤寒性疾病[2]。
毒力岛是一组染色体 DNA 片段,分子量非常大,可以对细菌感染过程进行调控。在很大程度上面增强病原菌的致病能力[3]。研究表明,随着细菌的毒力基因进化,大多致病菌,如李斯特氏菌、大肠杆菌、耶尔森氏菌、沙门菌、幽门螺杆菌等,大部分都存在着1个或多个毒力岛基因[4]。沙门菌的毒力岛(SPI)较复杂,有5个SPI,包括SPI-1,SPI-2,SPI-3,SPI-4 和 SPI-5,由 60 个基因编码。沙门菌的毒力岛影响着沙门菌对肠道上皮细胞的侵袭力,且与该菌在镁离子不足条件下或在巨噬细胞内的存活有关[5]。SPI-3是mgtC基因的编码产物,对沙门菌在低 Mg2+环境和巨噬细胞中的存活起了重要作用[6,7]。为了进一步研究沙门菌毒力岛基因mgtC的生物学功能,用λ- Red同源重组技术构建了鼠伤寒沙门菌mgtC基因缺失株;对mgtC基因缺失株的生长特性、抗菌肽耐受、酸敏感性、生物被膜形成能力、胞内增殖以及小鼠体内毒力进行研究,分析了mgtC基因的功能,阐述了毒力致病机制,为沙门菌致病机制的全面阐释提供理论指导并奠定基础。
1 材料和方法
1.1 主要试验材料
鼠伤寒沙门菌S.TyphimuriumATCC 14028s,质粒pKD46, pCP20, pKD3及互补质粒pBR322均由兽医学(中兽医)北京市重点实验室保存;鼠源巨噬细胞J774A.1,由中国农业大学吴清民教授实验室馈赠;BALB/c 小鼠购自北京维通利华实验动物有限公司;PCR Mixture、DNA Marker 、限制性内切酶、凝胶回收试剂盒、T4 连接酶等均购自北京擎科生物技术有限公司。
1.2 引物设计与合成
用 Primer 5.0设计6对引物。引物 F1 和 F2 由两部分组成,序列前部与mgtC基因同源,后部与氯霉素抗性基因(cat)同源,F1 和 F2 用于扩增cat基因。引物 F3、F4与mgtC基因同源,用于缺失基因mgtC的鉴定,引物 F5、F6用于mgtC基因扩增和构建回补菌株。由上海生工生物工程技术服务有限公司合成上述引物(表1)。

表1 PCR扩增所用引物Tab.1 The primer sequences for PCR amplification
1.3 mgtC基因缺失株及回补株的构建
使用引物 F1/F2扩增质粒pKD3上的氯霉素基因片段,进行胶回收;将培养至对数期的沙门菌S.typhimuriumATCC 14028s (携带 pKD46)菌液中加入终浓度为 30 mmol/L-阿拉伯糖,诱导2 h 后冰浴10 min ,用冰的去离子水洗涤3次,加ddH2O水重悬,制备感受态细胞。将带有mgtC同源臂氯霉素电击转化感受态细胞,涂布氯霉素平板,培养之后进行PCR鉴定。在42 ℃的条件下,将阳性菌热激去除质粒pKD46,通过氨苄青霉素平板筛选和 PCR鉴定获得一次缺失菌株。将上步经平板筛选和PCR鉴定的质粒pCP20电转化入一次缺失菌株中,筛选得到敲除氯霉素片段的菌株,即为mgtC基因缺失菌株SM△mgtC,再次进行PCR鉴定。扩增mgtC基因连接到质粒pBR322中。将其电转化至菌株SM△mgtC中,经鉴定阳性菌株命名为SM△mgtC::mgtC,即为回补菌株。
1.4 基因缺失株观察
取SM、SM△mgtC和SM△mgtC::mgtC三种沙门菌株单菌落于10 mL LB液体培养基中,在摇床中37 ℃,200 r/min震荡培养,分别于培养后2 h、4 h、6 h、8 h、10 h、12 h 取样,测定OD600值,绘制3种菌的生长曲线。
1.5 基因缺失株对多粘菌素B敏感性试验
挑取SM、SM△mgtC和SM△mgtC::mgtC单菌落接种于10 mL LB培养基中,培养至对数生长期。将各菌液稀释至106CFU/mL,取100 μL加入到96孔板中,并加入100 μL 0.3 μg/mL的多粘菌素B,混匀后放入37 ℃恒温箱孵育1 h后计数,计算各菌株的存活率。
1.6 基因缺失株酸敏感性试验
使用生理盐水调整SM、SM△mgtC和SM△mgtC::mgtC菌液浓度为 1×108CFU/mL;各菌液平均分成2管,其中1管离心后,加入新鲜的LPM培养基(pH为5.5);放置37 ℃恒温箱1 h后取出计数;离心后加入LPM培养基(pH为3),再次放置37 ℃恒温箱1 h后取出计数,分析各菌株存活率。
1.7 基因缺失株生物被膜形成能力检测
取SM、SM△mgtC菌液按1%接入LB液体培养基,并将其培养到对数生长期, 150 μL/ 孔加入到96 孔板中,在摇床30 ℃,180 r/min培养;24 h后弃去菌液,蒸馏水多次冲洗去浮游菌,加入2 %结晶紫室温染色 15 min,用蒸馏水冲洗;加33%乙醇溶解结晶紫,测量OD630值,数据整理后进行分析。
1.8 基因缺失株细胞黏附与侵袭试验
取生长良好的鼠源巨噬细胞J774A.1,以 1×105/孔铺于24 孔细胞板;根据SM、SM△mgtC和SM△mgtC::mgtC细菌计数结果,以MOI=10的剂量感染J774A.1细胞,37 ℃恒温培养箱中孵育20 min后,用PBS冲洗,加入含 0.5%(vol/vol)吐温-20的PBS缓冲液,对细胞裂解液进行稀释计数,并统计黏附细胞的细菌数量。黏附力计算公式:黏附的细菌量/感染细胞的细菌量;孵育1 h时,用庆大霉素杀死胞外细菌,裂解细胞后进行活菌计数,统计重组菌的侵袭力。
1.9 基因缺失株胞内存活能力的测定
鼠源巨噬细胞J774A.1,以 1×105/孔铺于24孔细胞板;将SM、SM△mgtC和SM△mgtC::mgtC以MOI=10分别感染J774A.1细胞,孵育20 min后掉上清,加入含20 μg/mL 庆大霉素的DMEM维持培养基杀死胞外细菌。分别在在感染后 1 h、4 h、8 h、12 h、16 h、24 h时加入1 % Tritoxn-100,对裂解的细胞进行细菌计数,绘制各菌株在胞内的增殖曲线。
1.10 小鼠体内毒力测定
选购BALB/c 小鼠,每组10只。取SM、SM△mgtC菌液,以104剂量腹腔注射小鼠,逐日观察记录小鼠死亡日期和数量。接种后7日,SM△mgtC组剖杀3只小鼠,对其脾脏载菌量进行测定。
2 结果与分析
2.1 mgtC基因缺失株和回补菌株的构建与鉴定结果
以引物F1 和 F2,扩增质粒 pKD3中的氯霉素基因序列 ,电转化至携带质粒pKD46的亲本菌中,热激去除质粒 pKD46;利用质粒 pCP20 消除氯霉素片段,得到缺失菌株SM△mgtC,PCR 鉴定结果如图 1,基因缺失株SM△mgtC扩增条带约为160 bp,SM扩增条带为640 bp,回补菌株扩增条带为640 bp,与预期相符,表明成功构建了mgtC基因缺失菌株。
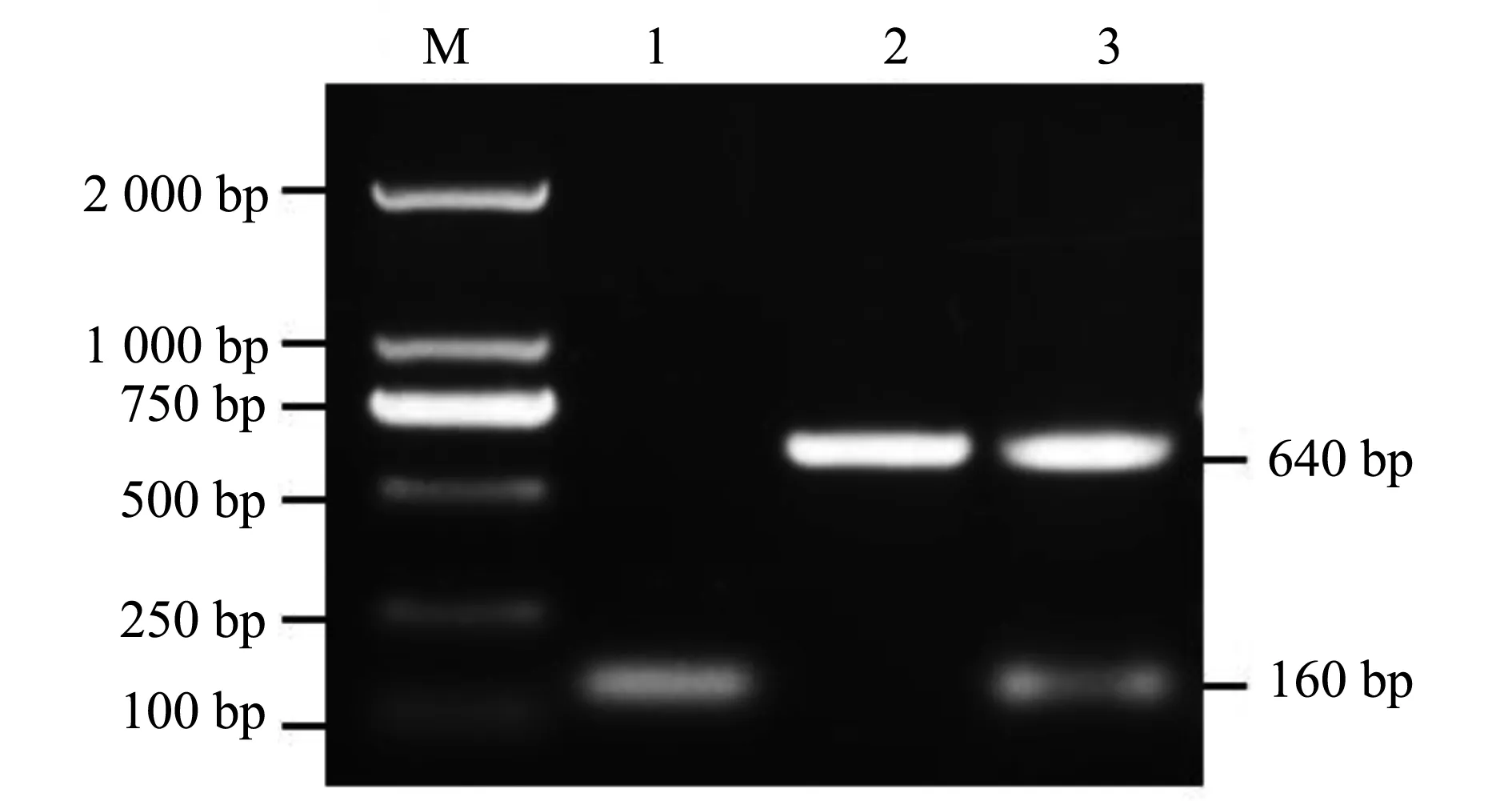
M.DL2000;1. mgtC基因缺失株;2. 亲本菌株;3.回补菌株图1 基因缺失株SM△mgtC的PCR鉴定M.DL2000: 1. mgtC gene deleted strain;2. Wild strains;3. complementary strainFig.1 Identification of deleted SM△mgtC strain by PCR
2.2 重组菌生长特性观察结果
SM、SM△mgtC和SM△mgtC::mgtC菌株不同时间点菌液的OD600生长曲线如图2所示,培养时间为6 h,基因缺失株SM△mgtC的 OD值略低于亲本菌株SM,但总体生长差异不显著,说明mgtC基因缺失不影响沙门菌的生长。
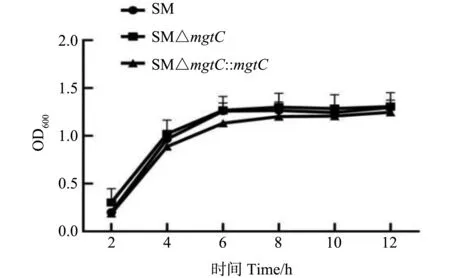
图2 重组菌生长特性测定Fig.2 Growth cuvers of recombinant stains
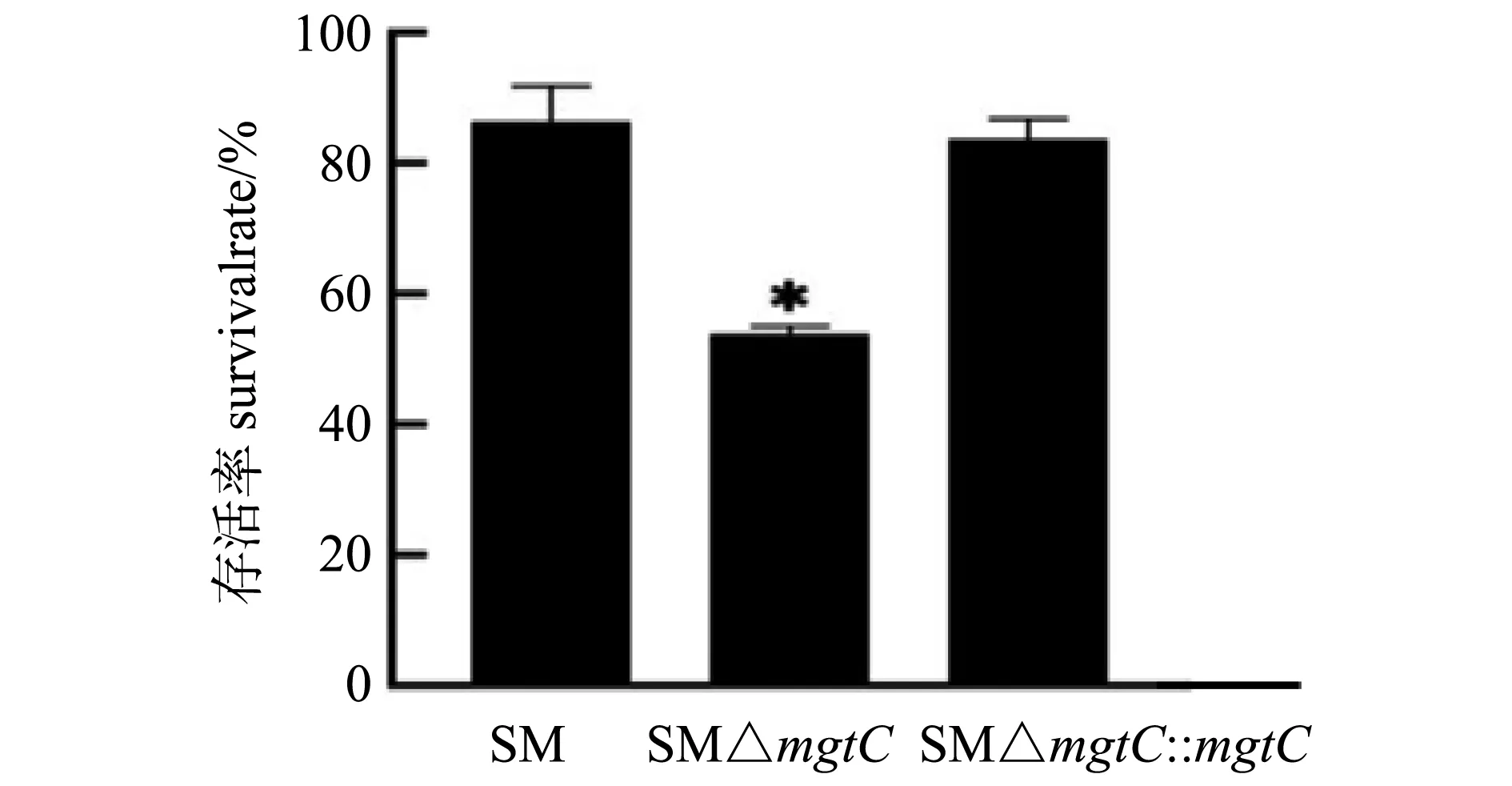
* P<0.05图3 重组菌多粘菌素B敏感性试验结果Fig.3 Polymyxin B sensitivity tests of recombinant strains
2.3 重组菌多粘菌素B敏感性测定结果
使用终浓度为0.15 μg/mL多粘菌素B作用各重组菌1 h后,活菌计数。结果如图3所示,在多粘菌素B作用下mgtC基因缺失株的存活率显著低于亲本菌株,说明mgtC基因的缺失影响了鼠伤寒沙门菌对多粘菌素B的耐受性。
2.4 重组菌酸性敏感性测定结果
酸适应是将各菌株首先暴露于pH为5.5的LPM液体培养基,然后暴露于pH为3的LPM液体培养基中;然后计算存活率。结果如图4所示,在酸适应情况下,SM△mgtC的存活率为45%左右,亲本菌株SM的存活率为60%左右,SM△mgtC与SM相比存活率差异显著,回补株酸耐受能力得到恢复。由此表明mgtC基因的缺失影响了沙门菌的酸性耐受能力。
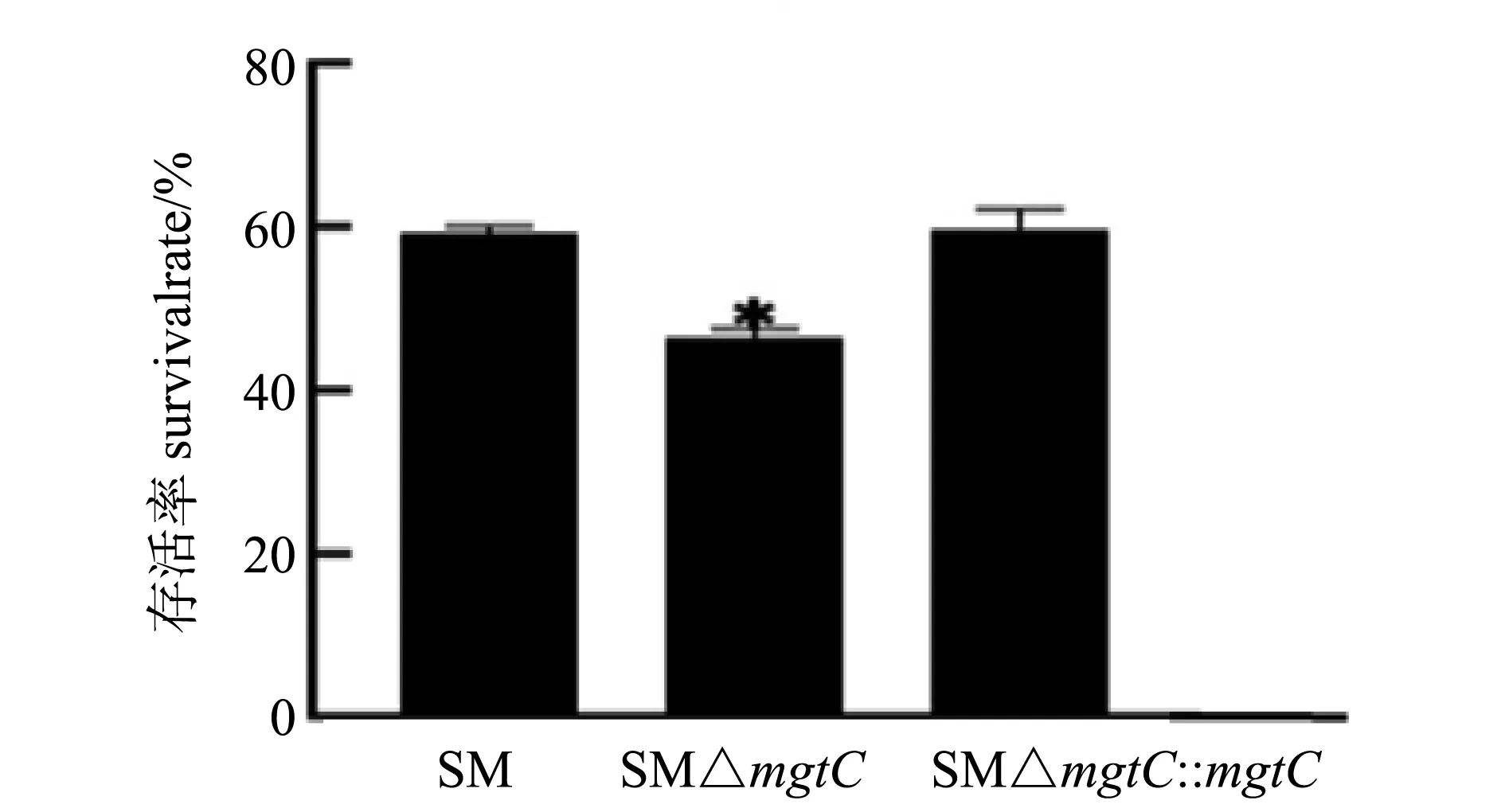
* P<0.05图4 重组菌酸敏感性试验结果Fig.4 Acid sensitivity tests of recombinant strains
2.5 重组菌生物被膜形成能力分析结果
结晶紫染色法定量分析菌株SM、SM△mgtC的生物被膜形成能力,染色结果如图5所示,试验结果如图6所示,亲本菌株SM显示强黏附的生物被膜,SM△mgtC显示弱黏附的生物被膜,基因缺失菌株SM△mgtCBF形成量仅为亲本菌株的30%左右。表明mgtC基因参与沙门菌的生物被膜形成。

图5 重组菌生物被膜染色分析Fig.5 Analysis of biofilm staining of recombinant strains
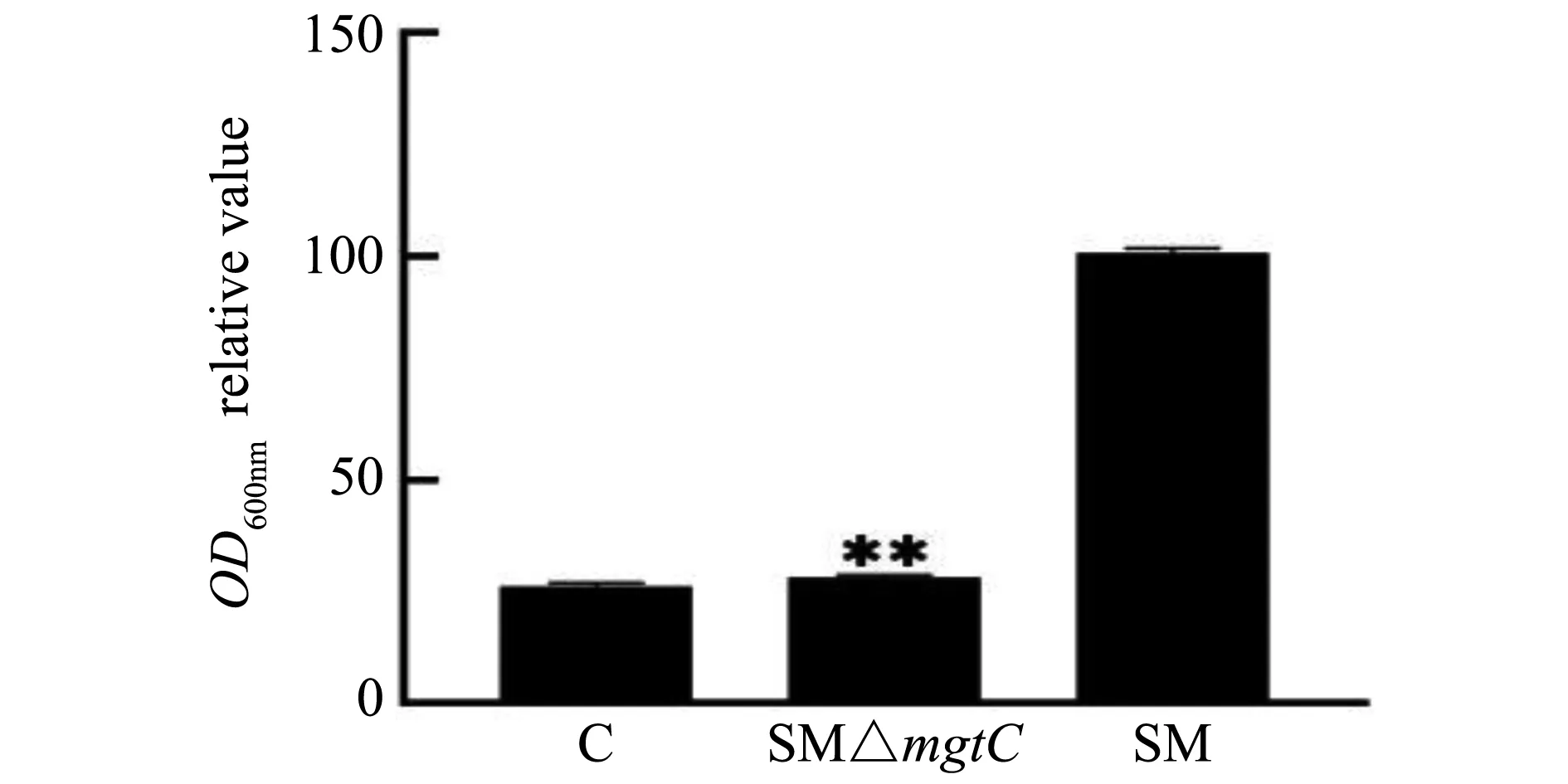
**P<0.05)图6 重组菌生物被膜形成能力分析Fig.6 Analysis of biofilm formation abilities of recombinant strains
2.6 重组菌细胞黏附和侵袭力测定结果
细菌黏附率和侵袭力如图7所示,SM△mgtC基因缺失株对巨噬细胞的黏附率为30%左右,与亲本菌株的黏附率差异不明显;感染1 h时,SM△mgtC胞内活菌数(Log10CFU/mL)为5.3,亲本菌株的胞内载量为5.5,两者相比差异不明显(图7)。说明mgtC基因的缺失不影响鼠伤寒沙门菌对细胞的黏附作用和侵袭力。

图7 重组菌细胞黏附作用和侵袭力测定Fig.7 Adhesion and invasiveness tests of recombinant strains

* P<0.05, ** P<0.01图8 重组菌胞内增殖能力测定结果Fig.8 Intracellular viabilitytests of recombinant strains
2.7 重组菌的胞内存活能力测定结果
如图8所示,SM△mgtC胞内增殖能力显著低于亲本菌株;在感染后的 8 h时,亲本菌株和回补株在胞内出现大量增殖,而基因缺失菌株SM△mgtC的胞内载菌量 (LgCFU/mL)开始下降;感染12 h时,SM△mgtC的胞内载菌量比亲本株SM约降低了1,即细胞载菌量降低了约 10 倍;表明mgtC基因严重影响鼠伤寒沙门菌的胞内存活能力。
2.8 小鼠体内毒力试验结果
体内毒力试验结果显示,在12 d内接种SM的小鼠全部死亡,而接种SM△mgtC的小鼠16 d内的存活率为100%;接种7 d时,SM△mgtC组小鼠脾载菌量和肝脏载菌量比SM组小鼠载菌量低近2个数量级(图9)。表明mgtC基因的缺失影响了沙门菌的毒力。
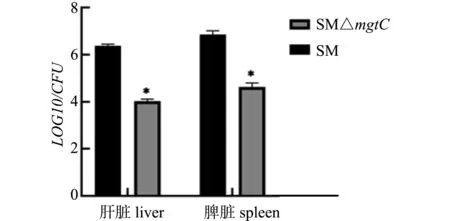
图9 重组菌小鼠体内载菌量测定Fig.9 Virulence tests in mice of recombinant strains
3 讨 论
作为兼性胞内寄生菌,沙门菌通过形成包裹菌体的内噬体的方式在细胞内进行增殖和扩散[8]。沙门菌能引起多种动物发病,造成成年动物持续时间可达数月的隐性感染和持续性感染,这给该病的防治带来很大的困难[9]。鼠伤寒沙门菌是一种胞内病原体,可以导致宿主局部或全身感染,通过研究毒力岛基因mgtC的生物学功能,进一步阐释鼠伤寒沙门菌的致病机制,也可为沙门菌病疫苗的研究提供了方向[10]。因此研究沙门菌致病性相关因子的功能和致病机制,可提供对于沙门菌病的防控策略。本研究主要围绕沙门菌毒力岛基因mgtC的生物学功能展开研究,探索其在沙门菌致病中的作用,为防治鼠伤寒沙门菌病的研究奠定基础。
多粘菌素 B是一种阳离子抗菌肽,通过在微生物的细胞壁上打孔,形成一种大分子通道引起细菌内容物的释放,造成细菌死亡[11,12]。本研究发现通过多粘菌素 B的刺激,mgtC基因缺失菌株的存活率较亲本菌株的低,表明mgtC基因对鼠伤寒沙门菌的抗菌肽耐受性产生了作用。生物被膜(Biofilm,BF)作为病原菌抵御药物和免疫系统杀伤的有效物理屏障,对细菌的生长意义非凡。沙门菌在不利环境下生存甚至造成长期持续性感染的主要的原因是其在生长和感染过程中也能于多种附着物表面产生BF[13, 14]。通过结晶紫半定量法试验,表明mgtC基因缺失株的生物被膜形成能力比亲本菌株降低约 70 %,该结果进一步解释了SM△mgtC抗菌肽耐受性降低的原因。
沙门菌在胞内最常见的恶劣条件之一是酸胁迫,因此感知和响应酸胁迫的能力对其生存至关重要。沙门菌通过复杂的酸存活系统响应酸性pH变化,统称为耐酸反应(ATR)。当鼠伤寒沙门菌在亚致死pH(pH 4.5~5.5)下体外生长一代后,沙门菌便获得在极端酸性条件下(pH 3)存活的能力。本研究发现,在酸适应情况下,SM△mgtC的存活率为45%左右,与亲本菌株SM相比存活率显著降低。由此表明mgtC基因的缺失影响了沙门菌的酸性耐受能力,进一步解释了mgtC基因缺失株丧失胞内增殖能力的原因。小鼠体内毒力感染试验结果表明,注射SM的小鼠在12 d内全部死亡,而注射SM△mgtC的小鼠存活率为100%,此时小鼠肝脏和脾脏的细菌载量显著低于亲本菌。
综上,本研究利用λ-Red 同源重组技术构建了mgtC基因缺失菌株,通过生长特性、酸性应激、多粘菌素B敏感性、生物被膜检测、胞内存活和小鼠体内毒力等生物学功能研究,证实mgtC基因与鼠伤寒沙门菌的致病性密切相关,有望进一步阐释沙门菌的致病机制,为防治沙门菌病奠定研究基础。

