Fe2O3负载MgO反应活性及表面形貌研究
孟庆龙
(昆明理工大学 冶金与能源工程学院 昆明理工大学复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093)
目前,大气中的CO2浓度已从工业化前的285±5×10-6增加到366×10-6[1],主要导致因素就是人类活动排放大量的CO2。化学链燃烧(Chemical Looping Combustion,简称CLC)是在隔绝空气条件下,利用载氧体(Oxygen Carrier,简称OC)与燃料直接发生氧化还原反应,能够避免NOx的产生[2-4],并将反应后产生CO2收集起来,能够有效地实现N2与CO2内在分离,减少温室气体排放[5-7]。化学链燃烧装置主要分为燃料反应器(Fuel Reactor,简称FR)和空气反应器(Air Reactor,简称AR)两个部分,如图1所示。燃料反应器主要是载氧体与燃料发生还原反应,见式(1)。空气反应器主要是低价态载氧体与空气中的氧气发生氧化反应,见式(2)[8-10]。
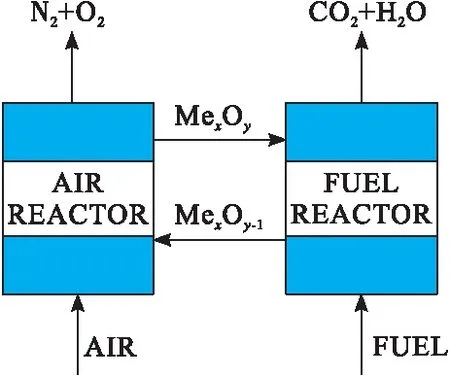
图1 化学链燃烧理论图
燃料反应器反应原理:
(2n+m)MexOy+CnH2m→(2n+m)MexOy-1+
mH2O+nCO2
(1)
空气反应器反应原理:
2MexOy-1+O2→MexOy
(2)
铁基载氧体价格便宜,机械强度高,环境友好无毒害[11],但是铁基载氧体也存在输氧能力差、反应活性低等问题[12]。所以,解决铁基载氧体反应活性,同时保证铁基载氧体其他性能优良是研究铁基载氧体关键问题。
1 铁基氧载体复合氧化镁热力学计算
1.1 FactSage7.2热力学计算软件
FactSage软件具有全面的数据库存和强大的热力学计算能力,本文应FactSage7.2 的相图计算模块(Phase Diagram ),选FToxid数据库,根据热力学原理进行计算。基于化学循环实验燃烧温度,参考为900 ℃。
1.2 FactSage7.2热力学计算结果
图2表示在900 ℃,1atm条件下,不同浓度的还原气氛中,不同质量比例的MgO/Fe2O3的热力学计算结果相图。当m(MgO)/m(Fe2O3)≤0.2时,可以看出随着MgO质量分数增加,在相对低浓度的CO气氛下,MgFe2O4在产物中的质量百分数不断提高,这是由于Fe2O3与MgO具有高度互溶性,容易形成固溶体。由图2可以发现,CO首先与Fe2O3反应,生成MgFe2O4。随着CO浓度提高,Fe2O3完全转化为MgFe2O4。m(MgO)/m(Fe2O3)>0.2时,产物主要是FeO、MgO、MgFe2O4,这说明MgFe2O4进一步发生还原反应,生成FeO和MgO。根据图3的相图分析,m(MgO)/m(Fe2O3)=0.2时,Fe2O3达到最佳负载比例。因为,第一,这个时候临界过量惰性担体MgO的出现,如果出现过量惰性担体必然引起铁基载氧体相同质量下活性组分Fe2O3质量比减少,反应活性降低。第二,铁基载氧体活性组分Fe2O3还原到Fe3O4时,铁基载氧体克服反应能垒最低,利用效果最好,Fe3O4还原到FeO过程中克服反应能垒较高,不利于铁基载氧体反应效率最大。
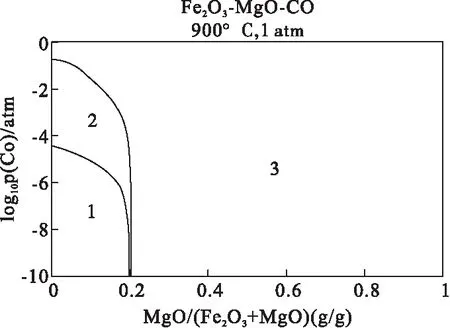
1.Fe2O3+MgFe2O4+gas2.MgFe2O4+gas3.FeO+MgO+MgFe2O4+gas
2 铁基氧载体复合氧化镁实验研究
2.1 铁基氧载体复合氧化镁制备方法
本实验主要采用浸渍法(Impregnation)将铁基复合氧载体中活性组分Fe2O3负载于惰性担体MgO中,根据900°C,1atm条件下,不同浓度的还原气氛中,不同质量比例的MgO/Fe2O3的热力学计算结果,本文选择四种质量比例的MgO/Fe2O3。本文选择m(MgO)/m(Fe2O3)=0.2,并结合相图分析结果,选择其他三种不同质量比例的MgO/Fe2O3进行对照实验,制备出相应的Fe2O3/MgO铁基复合氧载体。具体步骤如下:
(1)称取40.4 g的Fe(NO3)·9H2O溶于200 mL去离子水中,在加热磁力搅拌器中加热70 ℃进行不断搅拌1 h。
(2)称取不同相应质量的MgO(见表1)加入(1)中,利用数显恒温水浴锅,加热到70 ℃同时搅拌10 h,直至水分蒸发,样品变成粘稠胶状体,停止搅拌。

表1 Fe2O3/MgO不同质量配比参数
(3)将(2)放入干燥箱中,置于110 ℃环境恒温加热18 h,去除多余水分。
(4)将(3)放入马弗炉中,以10 ℃/min升温速率至550 ℃,并在该温度维持1 h,再以10 ℃/min升温速率至950 ℃,然后在该温度下焙烧3 h。
2.2 铁基氧载体复合氧化镁表征方法
2.2.1 晶体结构分析
X射线粉末衍射(X-ray Diffraction,简称XRD)应用日本理学公司制造的D/max-3B型X射线粉末衍射仪,以Cu Кα辐射,辐射波长λ=0.154 06 nm,管电压40 kV,管电流为30 mA,扫描速率5°/min ,扫描范围为10 ℃~90 ℃。
2.2.2 CO程序升温还原
CO程度升温还原(CO-Temperature Programmed Reduction,简称CO-TPR)是在美国Quantanchrome公司生产的TPR Win V l.50仪器下进行的,实验方法是气体流量为40 mL/min条件下,40%CO+60%Ar混合气对50 mg样品进行吹扫还原,同时以10 ℃/min的升温速率至900 ℃。
2.2.3 N2吸附脱附
比表面积测定应用美国Quantachrome公司生产的Autosorb-iQ型物理吸附仪,测试方法是先将样品在300 ℃和100 Pa下进行预处理,然后以真空、液氮冷冻温度(-196 ℃)条件下对150 mg样品进行p/p0=0.0~0.1MP的吸附-脱附实验。
3 铁基氧载体复合氧化镁实验结果分析
3.1 Fe2O3/MgO样品晶相分析结果
图3是四种铁基复合载氧体制备完成后的XRD晶相分析,由图3可以看出四种样品分别含有氧化铁(Fe2O3)、铁镁尖晶石(MgFe2O4)、铁镁氧化物(Mg1.55Fe1.6O4)[13]。Fe3+的半径为0.064 nm与Mg2+的半径是0.078 nm相近,且形成固溶条件符合,所以Fe3+与Mg2+可以有限取代形成MgFe2O4。Mg1.55Fe1.6O4的出现是由高温引起。由图3可知,随着m(MgO)/m(Fe2O3)的提高,铁镁固溶体MgFe2O4、Mg1.55Fe1.6O4质量分数不断增加。Fe9Mg1中主要物质是Fe2O3,含有部分MgFe2O4、Mg1.55Fe1.6O4。Fe8Mg2中Fe2O3的质量分数降低,与MgFe2O4、Mg1.55Fe1.6O4质量分数接近。随着惰性担体MgO的质量分数不断提高,铁镁固溶体MgFe2O4、Mg1.55Fe1.6O4开始成为Fe6Mg4、Fe5Mg5中的主要成分。
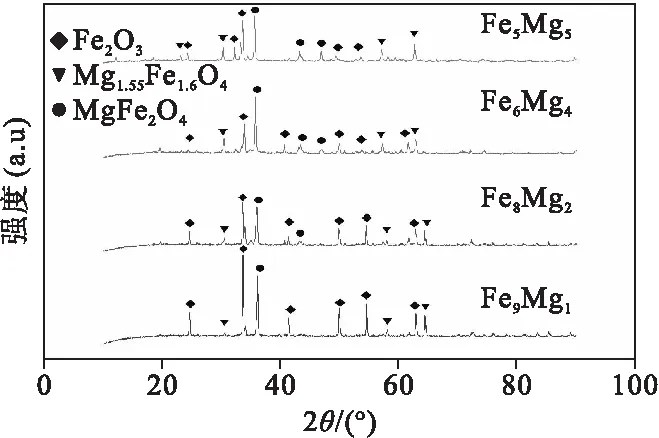
图3 铁镁氧化物XRD晶相分析
3.2 Fe2O3/MgO样品还原活性分析结果
由图4可以看出,Fe9Mg1、Fe8Mg2的还原峰面积比较大,随着MgO质量比例的提高,Fe6Mg4、Fe5Mg5的还原峰面积逐渐减少。如表2所示,随着MgO质量比例的提高,第一峰出峰时间逐渐加快,说明Fe2O3负载于MgO确实能够减少与CO反应的反应能垒。但是,第一峰的峰面积逐渐减少,主要是由于Fe2O3的质量比减少,Fe2O3还原为Fe3O4过程中,样品与CO还原反应活性及还原反应能力不足。第二峰还原峰面积先减小后增大,Fe8Mg2样品CO-TPR的第二峰还原峰面积最大,表明Fe3O4还原为FeO过程中,Fe8Mg2样品的还原能力最强,还原效果最好。如图5所示,Fe8Mg2样品的CO-TPR的还原峰面积最大,说明Fe8Mg2样品的还原反应能力最好。
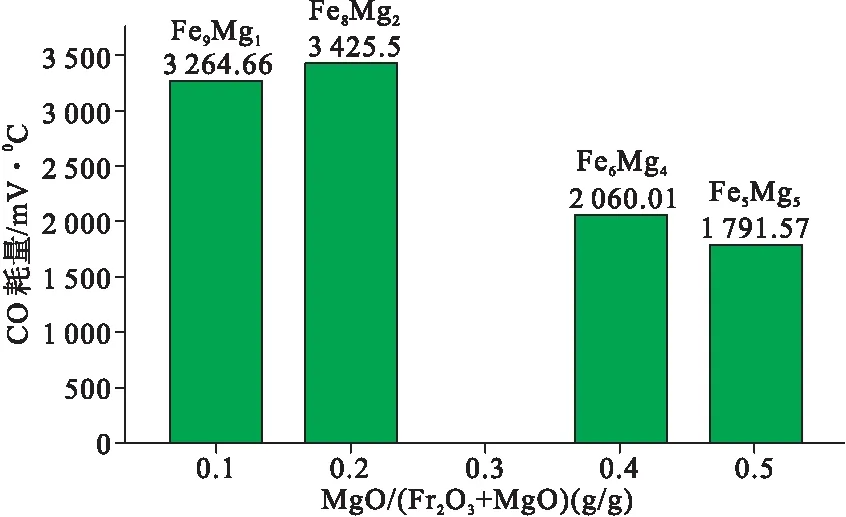
图5 铁镁氧化物CO-TPR还原峰总面积
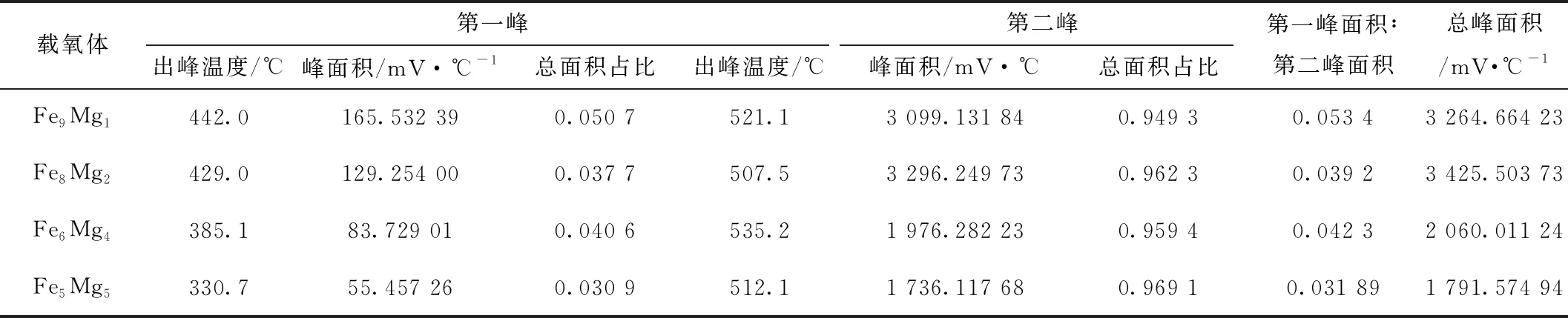
表2 载氧体出峰温度、峰面积和总面积
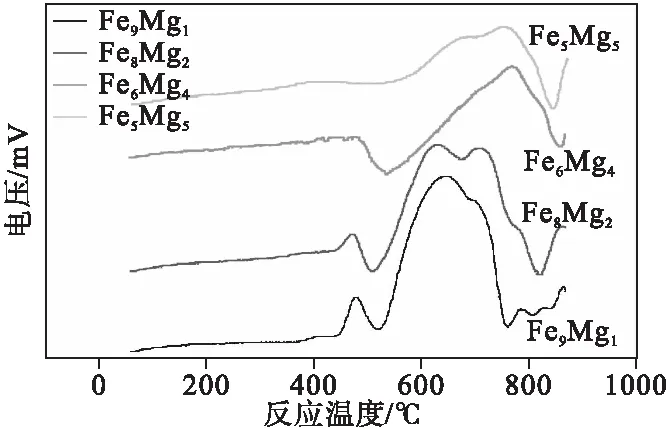
图4 铁镁氧化物TPR图
3.3 Fe2O3/MgO样品表面孔隙分析结果
由图6可知,样品Fe9Mg1的比表面积最小,随着MgO的含量增加,样品的比表面积先逐渐加大,后略微减小。比表面积大有利于样品与还原气体接触,加快反应速率。样品Fe6Mg4的比表面积最大,为2.427 m2/g。
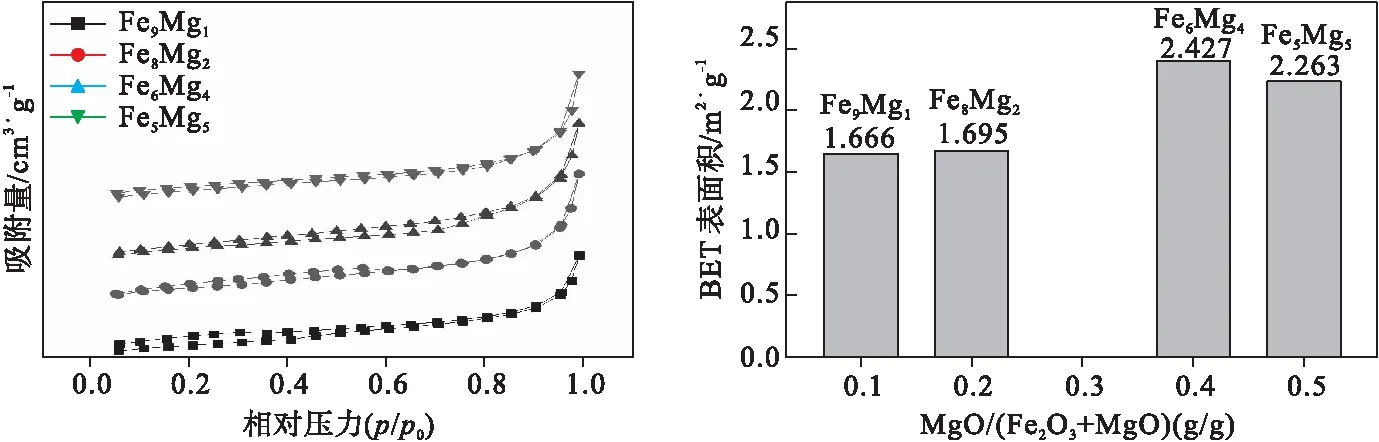
图6 Fe2O3/MgO样品表面孔隙
3.4 氧化还原循环前Fe2O3/MgO样品SEM图
由图7可知,样品都出现了不同程度的结块。Fe9Mg1粉末中含有硬块、板状结块。Fe8Mg2粉末中也出现了结块,但是结块物为疏松多孔状态。Fe6Mg4、Fe5Mg5样品粉末化加大,样品虽然出现一定程度的结块,但是区别于Fe9Mg1、Fe8Mg2样品疏松程度提高,这与MgO载体的加入比例提高有关。所以,样品在Fe8Mg2时就已经有良好的形貌表现。

图7 电镜扫描图
4 结 论
(1)随着MgO的添加,铁基载氧体中铁镁氧化物逐渐增多。
(2)Fe2O3负载MgO后,CO-TPR出峰时间变短,说明MgO能够提高Fe2O3与CO的反应活性。
(3)实验中,Fe8Mg2载氧体TPR峰总面积最大,Fe8Mg2载氧体还原能力最强,还原效果最好,与FactSage模拟相互一致。
(4)MgO的添加能够减轻铁基载氧体的团聚和烧结。

