应用高分辨质谱法的马铃薯种植土壤嘧菌酯残留快速筛查方法
高 磊,王美仙,郭威艳
(1.内蒙古自治区乌兰察布市农畜产品质量安全监督管理中心,内蒙古 乌兰察布 012000;2.内蒙古自治区乌兰察布市农牧业综合执法支队,内蒙古 乌兰察布 012000)
0 引言
人口数量的急速上升,对于食物的需求量也逐渐增大,市场对于各类农产品的需求逐年上升,在保证农产品产量提升时一般需要使用不同成分的农药抑制病虫危害。目前我国市面上常使用的农药数量约有1 600种,年用量超过200万t,是目前世界上农药使用数量最庞大的国家,但是大量使用农药很容易使其残留在农作物中,并且大量喷洒农药还会对土壤和水源造成严重污染,长期食用残留农药的农作物也会严重危害人们的身体健康[1]。嘧菌酯是一种有机化合物,纯品是一种呈现出浅棕色色泽的棕色结晶固体,沸点高于500 ℃,在水解过程中呈现稳定状态,是近年来由国外引入的新型农药,在众多农作物种植中已经广泛使用,属于甲氧基丙烯酸酯型杀菌农药,对农作物生产过程中经常出现的霜霉病、白粉病都具有良好的控制效果[2-4]。该农药不但能够喷洒在土壤中还可以直接在种子阶段实现病虫害处理,对于根茎类作物、蔬菜、谷物等作物均有良好的处理效果。但是由于嘧菌酯具有特殊性,如果嘧菌酯与有机类农药混合使用会由于强烈的粘着性与渗透性导致作物出现药害情况。嘧菌酯农药具有诸多特点:仅需少量用药就能消灭多种病虫危害,能够有效降低农药使用成本;能够提升作物的抗病性能,保证作物提前上市,为种植户带来最优成本;使用嘧菌酯农药即使在天气不佳的情况下依旧保证作物生长;使作物的收获期拉长,提升作物整体产量;有效期较长,每次药效能够持续15 d以上;毒性较低,无公害性能较强。尽管嘧菌酯已经属于性能较好的农药,但是大量残留在土壤中仍然会造成较为严重的环境污染和作物危害,需要探索嘧菌酯残留快速筛查方法[5]。
对于农药中各类物质的残留测定学术界通常使用质谱技术。近年来,随着质谱技术的进步,高分辨质谱技术逐渐发展并完善起来。高分辨质谱法能够获得通量较高的非靶向定量分析与定性筛查,不会受到被筛查样品种类与数量的限制[6-8]。定性筛查嘧菌酯残留时能够通过匹配高分辨数据库获得的结果,不用依赖筛查对照组,同时能够准确回溯数据内容,做到有据可查。
基于以上优点,本文应用高分辨质谱法快速筛查马铃薯种植土壤嘧菌酯残留,为今后马铃薯的增产种植提供技术支持。
1 材料与方法
1.1 材料
土壤样本:马铃薯种植土壤矿质养分充足,肥力较强,夹杂半风化母质碎块;呈现红色质地,pH值显示为弱酸性,富含铁元素及铝元素,盐基高度不饱和,同时富含有机物与腐殖质,钾元素与磷元素丰富;属于壤质粘土,土质疏松呈现屑粒状结构。
材料:25%嘧菌酯悬浮剂(河南省安阳市振华化工有限公司);乙腈(山东省淄博市协创化工有限公司);丙酮(江苏省扬州市贝尔新环境科技有限公司);二氯甲烷(山东省济南市坤丰化工有限公司);无水硫酸钠(湖北省武汉市华翔科洁生物技术有限公司);弗罗里硅土柱(湖北省武汉市敬信科技有限公司);石油醚(江苏省苏州市森菲达化工有限公司);乙酸乙酯-环乙烷(山东省济南市盈鑫化工有限公司);色谱柱(天津市西纳智能科技有限公司)。
仪器:四极杆-飞行时间高分辨质谱系统(沃特世飞行技术有限公司);液相色谱系统(广东省通用仪器有限公司);液相色谱仪(北京市京科瑞达科技有限公司);三重四极杆质谱仪(山东省梁山市钰豪仪器设备有限公司);涡旋混合器(河北省沧州市筑龙工程仪器有限公司);恒温水浴锅(浙江省杭州市舍岩仪器有限公司)。
1.2 方法
高分辨质谱法是近年来检测土壤或农作物中农药残留情况经常使用的方法,本文研究中使用的高分辨质谱法为飞行时间质谱法,同时结合四级杆串联与高效液相色谱法筛查马铃薯种植土壤中的嘧菌酯残留情况[9]。研究在马铃薯种植土壤中嘧菌酯随着时间推移残留量消解变化规律,经高分辨质谱法分析获得马铃薯种植土壤中嘧菌酯原始沉积量及嘧菌酯残留时空变化,同时计算马铃薯种植土壤中的嘧菌酯残留半衰期[10]。
1.2.1 土壤样品准备
为了方便后续试验,划分试验区域为每个区域10 m2,并设置保护围栏。实施嘧菌酯消解变化规律试验时施加2倍嘧菌酯剂量,按照常规比例充分混合水与2倍嘧菌酯悬浮剂,均匀喷洒在样本土壤上至土壤充分湿润停止,采样时间分别为施药后的1、2、5、7、15、20、40、60、80、100与120 d。在样品区域取1 kg土壤样品,分别放置在惰性干净的塑料袋中,并注明标签后携带回实验室。使用自然风将土壤样品风干,风干过程中使用干净无菌的薄纸覆盖土壤样品,防止其他干扰因素混入,风干完成后简单过筛并研磨处理,再次使用惰性塑料包装袋装好置于冰箱内待提取,冰箱温度为-21 ℃。
1.2.2 样品的提取
嘧菌酯是一种有机化合物,在残留情况筛查过程中需要考虑嘧菌酯的极性,同时筛查过程中也要考虑嘧菌酯及溶液性质、基质的特点,从而选取较为恰当的提取溶剂[11-12]。已有研究中,由于丙酮具有良好的渗透力,经常作为农药中各类物质的提取溶剂,因此选取该试剂辅助筛查。具体过程:将丙酮适当酸化,有利于从马铃薯种植土壤中提取出嘧菌酯成分,优化提取效率。
为保证精准提取马铃薯种植土壤中的嘧菌酯,并且确保具有较高的回收率,将丙酮溶液与占液体总质量0.1%的冰醋酸混合,确保嘧菌酯回收率范围为60%~100%[13]。不同地域的马铃薯种植土壤中的基质存在差异,部分基质对于嘧菌酯回收率较高,然而土壤中基质的硫化物、生物碱等物质较高将会严重影响嘧菌酯的回收率。为实现嘧菌酯的高效回收,对于土壤样品可能存在的干燥情况,加水湿润处理[14]。
简单研磨处理土壤并称取25 g土壤样本,置于容量500 mL的三角瓶中,在三角瓶中添加25 mL去离子水,充分浸泡土壤,浸泡时间设置为20 min。浸泡完成后在三角瓶中添加75 mL丙酮,利用振荡仪充分振荡,振荡时间设置为35 min。完成振荡后抽滤溶液,使用35 mL丙酮冲洗两次液体残渣,冲洗完成后合并溶液。取一个容量为300 mL的平底烧瓶,将溶液转移至该平底烧瓶中,恒温水浴锅温度设置为45 ℃,将溶液置于水浴锅中实行减压浓缩至25 mL方可停止,取一支容量为500 mL的分液漏斗,向漏斗转移溶液,与氯化钠水溶液(100 mL,5%浓度)混合,萃取时引入二氯甲烷液,使用硫酸钠收集二氯甲烷层,水浴锅温度调至40 ℃,减压浓缩,使得溶液接近干燥,使用氮气将半固体吹干处理后静置。
1.2.3 样品的净化
取经过脱活的弗罗里硅土柱3 g,使用约1 cm无水硫酸钠施加在弗罗里硅土柱两端,再使用石油醚25 mL对弗罗里硅土柱预淋。取提取的土壤样本,用乙酸乙酯-环乙烷3.5 mL实现溶解,溶解完成后上柱,使用纯水与纯甲醇混合液洗脱土壤中嘧菌酯,收集流出的液体。减压状态下设定恒温水浴锅温度为45 ℃,将溶液浓缩接近干燥,使用氮气吹干,定容固体时使用乙酸乙酯,静置等待后续测定。
1.2.4 色谱条件与标准曲线绘制
色谱柱:型号为BDS-C18,规格为260 mm×4.5 mm×4.5 μm。
流动相:使用甲醇与水组合的混合物,二者体积比例为6∶4。
流速设为0.9 mL/min,色谱柱温度设为35 ℃,检测波长与进样体积分别为265 nm与11 μm。
使用外标分析法绘制标准曲线,调配嘧菌酯母液,浓度设定为550 mg/L,通过稀释法制备嘧菌酯标准液,浓度分别为0.02、0.06、0.12、0.48、1.10和5.10 mg/L,进样量设定为1 μL,由此得出标准曲线。
1.2.5 质谱条件
设定毛细管电压(正负离子模式)与电喷雾离子源温度分别为3 200 V与300 ℃;设定质谱正、负离子模式的扫描范围分别为110~1 100与400~450 m/z;正、负离子扫描切换时间均为1 s;分辨率与扫描频率分别为70 000与3.6 Hz。
1.2.6 定性筛查
土壤样品使用高分辨质谱系统中携带的筛查软件构建筛查数据库,用于分析马铃薯种植土壤中的嘧菌酯准确分子量、碎片离子信息及同位素峰型,上述3个指标是筛查土壤中各种农药残留的重要指标,目前众多研究均表明通过筛查数据库对于农药类的药品筛查测试时,定性筛查可行性较高[15]。
1.2.7 浓度差异下嘧菌酯残留量统计试验
为进一步验证马铃薯种植土壤中嘧菌酯最终残留情况,将土壤样本划分成多个区域,间隔7 d分别喷洒浓度为190 g(ai)/hm2的嘧菌酯溶液和浓度为250 g(ai)/hm2的嘧菌酯溶液,一部分土壤样本施药3次,一部分土壤施药4次,分别记录施药后距离收获2、4、6和8 d的嘧菌酯残留量。
2 结果分析
2.1 净化效果验证
在马铃薯种植土壤嘧菌酯残留快速筛查时使用弗罗里硅土柱实现样品的净化,为获得嘧菌酯在弗罗里硅土柱上的保留情况,需要先确定石油醚淋洗弗罗里硅土柱的曲线,由此验证净化处理效果。净化淋洗曲线变化效果如图1所示。

图1 弗罗里硅土柱上的嘧菌酯洗脱曲线Fig.1 Elution curve of azoxystrobin on Florisil column
由图1可知,从洗脱剂用量达到14.5 mL开始,土壤溶液的嘧菌酯回收率已经超过90%,且自该用量以后即使依然增加洗脱剂用量嘧菌酯回收率不会发生明显变化。由此可以看出,净化处理阶段只需保持洗脱剂用量在14.5 mL时就可以保持较好的回收效果,洗脱剂用量的增加并不会对嘧菌酯回收率造成显著影响。
2.2 色谱情况
在200~410 nm范围内,样品扫描时需要使用紫外分光光度计,选择波长时需要考虑方法适用性和成分响应值等因素,多方验证后确定波长为255 nm。使用体积比例存在差异的丙酮与水混合物,以及甲醇与水混合物分别开展流动相试验,试验开始之前先要确定方法足够简单且分离效果快速有效。如果配比中,丙酮在混合物中的占比分别低于总溶液比例的30%,会导致色谱柱大量保留嘧菌酯,造成过晚出峰;相反,如果配比中,丙酮在混合物中的占比分别高于总溶液比例的80%,会导致色谱柱大量保留嘧菌酯,造成过早出峰。如果出现过早或者过晚出峰,都会分离不充分,出现严重杂质干扰。综合这些影响因素,确定丙酮与水之间的比例为6:4的流动相是最佳混合物比例。土壤样品优化后混合溶液色谱图如图2所示。

图2 溶液色谱图Fig.2 Chromatogram of solution
经过优化后的色谱图出现比较尖锐的堆成峰型,保证杂质被较好分离,且时间恰当,符合土壤嘧菌酯残留分析需求,经过分析,嘧菌酯保留时间约为12.5 min。
2.3 定性筛查结果
通过高分辨质谱系统开展定性筛查,马铃薯种植土壤中嘧菌酯残留筛查色谱与质谱图如图3所示。
图3a是在全扫描模式下,在5 mg/kg质量数偏差范围中嘧菌酯离子色谱图,在此基础上可以开展精确碎片离子分析与同位素峰型匹配。图3b是经过质谱筛查获得的嘧菌酯同位素峰286.366与母离子精确质量数285.363。图3c统计母离子精确质量数下发生的ddMS2扫描情况,由此进一步获得高能量碰撞情况下获得的嘧菌酯保留时间二级质谱图,由此得到图3d的二级质谱碎片离子结果:69.799、87.187、158.227和188.274。
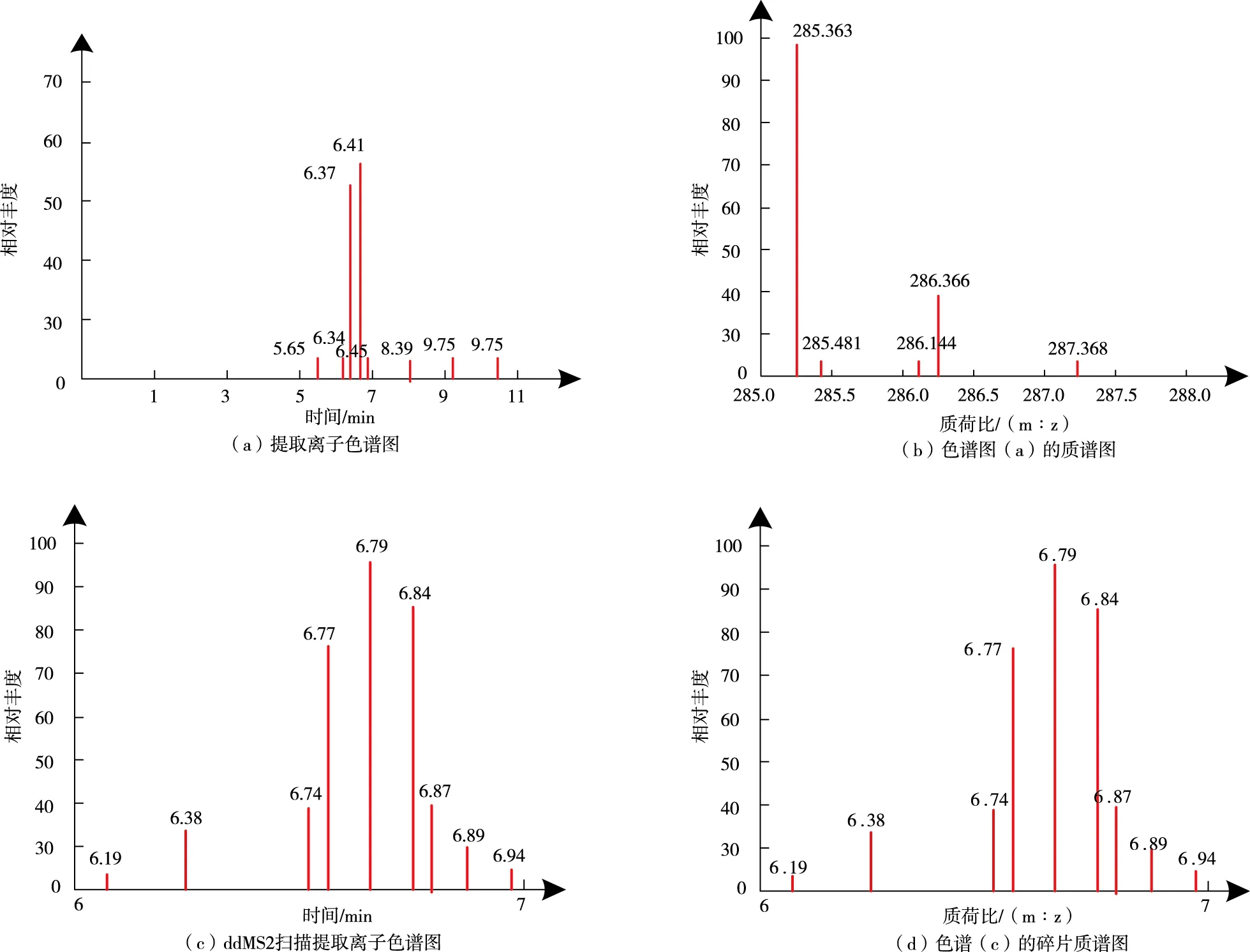
图3 色谱图与质谱图Fig.3 Chromatogram and mass spectrum
根据以上筛查过程,定性筛查土壤样品嘧菌酯残留,筛查结果如表1所示。
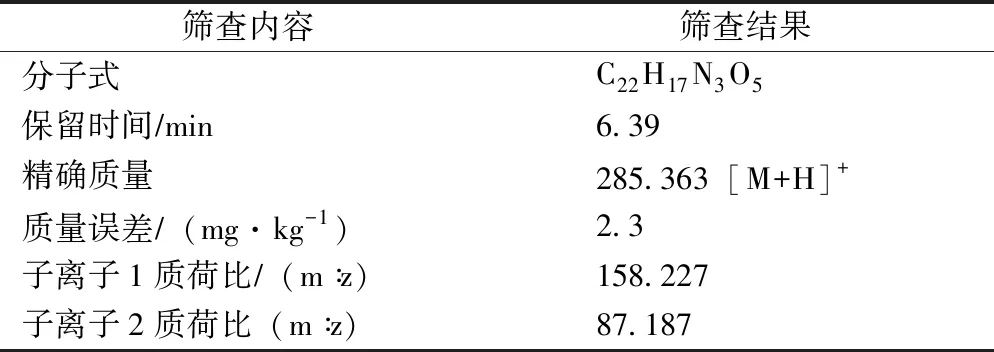
表1 定性筛查结果Tab.1 Qualitative screening results
2.4 定量下限与线性范围结果
土壤样品中嘧菌酯浓度情况(线性范围、定量下限、加标浓度差异下标准偏差与回收率)范围如表2所示。
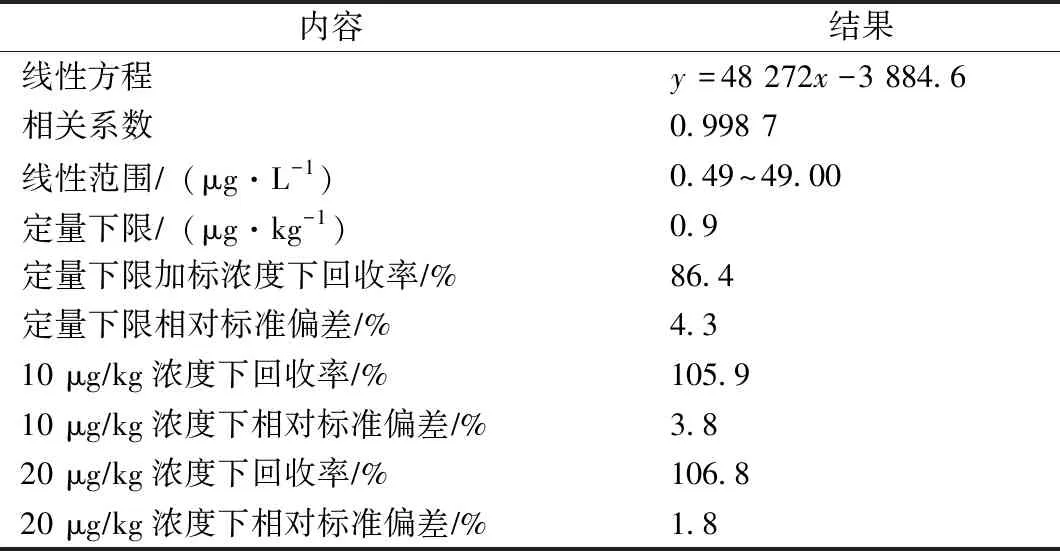
表2 浓度范围Tab.2 Concentration range
按设定的色谱条件与质谱条件,使用高分辨质谱系统开展标准溶液分析,绘制得到的嘧菌酯标准曲线如图4所示。

图4 嘧菌酯标准曲线Fig.4 Standard curve of azoxystrobin
由图4可知,在0.02~5.10 mg/L嘧菌酯浓度范围,嘧菌酯标准浓度与峰面积之间存在较为均匀的线性关系。在色谱仪检测条件下嘧菌酯最低检出量标识为1×10-11g。依据10倍信噪比确定嘧菌酯定量下限为0.9 μg/kg。欧盟规定农药的最低定量下限水平为10 μg/kg,本文筛查结果为0.9 μg/kg,说明该部分试验中马铃薯种植土壤中嘧菌酯符合最低报告水平。
2.5 嘧菌酯在马铃薯种植土壤中的消解动态
在马铃薯种植土壤中嘧菌酯的消解动态情况如表3所示。
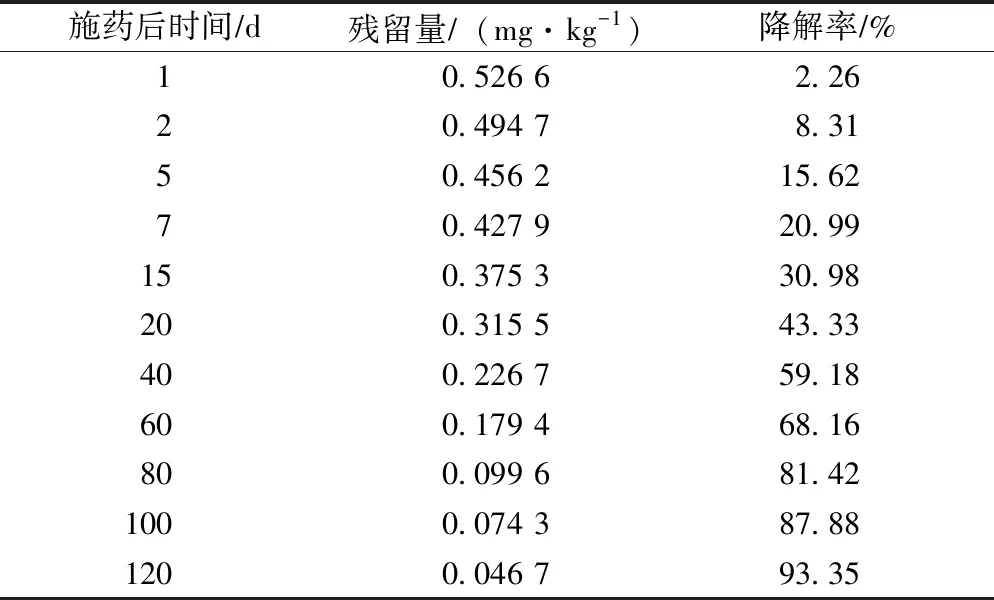
表3 马铃薯种植土壤中嘧菌酯残留消解动态Tab.3 Degradation dynamics of azoxystrobin residues in potato planting soil
由表3可知,马铃薯种植土壤中嘧菌酯呈现缓慢消解状态,施药1 d嘧菌酯残留量为0.526 6 mg/kg,当施药天数达到120 d以后,嘧菌酯残留量降至0.046 7 mg/kg,降解率为93.35%,半衰期约为33.87 d。土壤中嘧菌酯类农药消解快慢情况受到气候因素和土壤性质等多种外部因素影响,由表3可知,马铃薯种植土壤中的嘧菌酯消解速度较慢,符合一级动力学消解模式情况。
2.6 不同浓度嘧菌酯消解情况
不同嘧菌酯浓度与施药次数下马铃薯种植土壤最终残留情况如表4所示。
由表4可知,嘧菌酯浓度与施药次数上升都会增加土壤中初始嘧菌酯残留情况,随着间隔时间的增长,残留浓度也会适当下降,嘧菌酯施药浓度越高,残留量也就越高,因此实际种植时需要控制嘧菌酯的使用次数与使用浓度。而且实际种植时,考虑不同土壤与气候特征影响,应该适当调整嘧菌酯用量。

表4 不同嘧菌酯浓度下残留量统计结果Tab.4 Statistical results of residue under different azoxystrobin concentrations
3 结论
研究基于高分辨质谱法的马铃薯种植土壤嘧菌酯残留快速筛查方法,使用高分辨质谱法结合四级杆串联与高效液相色谱法筛查马铃薯种植土壤中的嘧菌酯残留情况,对马铃薯种植土壤中嘧菌酯残留开展定性和定量分析。经过试验表明,高分辨质谱法能够有效提取出嘧菌酯的详细质量色谱图,还能同时开展二级质谱碎裂,获得比较准确的碎片质量数,经过试验进一步研究还能获得嘧菌酯随着时间推移,嘧菌酯消解残留情况,以及不同嘧菌酯浓度下消解残留量,由此能够看出,实际种植过程中适当调整嘧菌酯用量,不但不会造成过多的嘧菌酯残留还能提升马铃薯掺量,降低病虫害。

