甲状腺乳头状微小癌诊断究研进展
黄力营 董晓英 胡厚琼 王木兰 林清群 潘小路

摘要:甲状腺乳头状癌近年来不断增多,并以甲状腺乳头状微小癌增多占优势,虽然恶性程度较低,但部分具有侵袭性行为,早期出现淋巴结转移,所以早期诊断显得尤为重要,文章从超声引导下细针穿刺(US-FNA)液基细胞学诊断、免疫组织化学及BRAF基因分别阐述对甲状腺乳头状微小癌的诊断的临床意义。
关键词:甲状腺乳头状微小癌;US-FNA;免疫组织化学;BRAF基因
中图分类号:R365;366:文献标志码:A
甲状腺乳头状微小癌(Papillary Thyroid Micro Carcinoma,PTMC)定义为10mm以下的甲状腺乳头状癌(Papillary Thyroid Carcinoma,PTC),随着现阶段检查手段多样化,技术操作水平不断提高,很多甲状腺乳头状微小癌早期得到准确的诊断,这也是近年来甲状腺乳头状微小癌发病不断上升的原因之一。 实际上,至少30年以来,与甲状腺癌相关的死亡率没有明显改变,因为这些癌症中的绝大多数是惰性的。因此,不仅要鉴定甲状腺癌,而且还要将那些具有惰性行为的甲状腺乳头状微小癌区分开来,已变得至关重要。相关研究表明,甲状腺乳头状微小癌的预后与患者年龄、肿瘤大小、多病灶及免疫组织学标记物相关[1],Yokozoa[2]和Ahuia[3]分别记录了小于1cm 的癌症中有15.9%表现出额外的甲状腺侵袭性,甲状腺乳头状癌向淋巴结的隐性转移占病例的20%,Hawk[4]认为大小似乎是甲状腺乳头状癌生物学行为的重要决定因素,大小的最佳值仍然有争议,Chang et al,(2012)[5]表示为0.6cm,(2015)[6]表示改为0.5cm。本次研究淋巴结转移占14.8%(4/27),直径0.8-0.9cm,多灶性,均为术中冰冻送检标本。本组研究肿瘤最大直径0.9cm,肿瘤最小直径0.05cm,有一半以上是临床考虑甲状腺良性结节经手术切除后才发现的甲状腺乳头状微小癌。相关研究证实肿瘤较大及多灶性病变提示生物学行为攻击性更强,Kasai和Sakamoto声称PTMC的大小是淋巴结转移和血管浸润的标志[7],Hay指出,有两个重要的参数需要牢记,有复发的可能:多焦点(焦点数目)和手术治疗类型(全甲状腺切除术与叶切除术)[7]提出的观点相符。因此早期诊断显得尤为重要。本文主要综述了甲状腺乳头状微小癌相关的诊断研究进展。
1 超声引导下细针穿刺(US-FNA)在甲状腺乳头状微小癌的应用。
US-FNA是目前公认术前判断甲状腺病变性质最可靠方法,简单、快捷,创伤小。近年来超声影像的发展及应用,使甲状腺细针穿刺技术应用更加广泛[8],通过液基细胞学(Liquid- Based Cytology)保存标本并制片,细胞学形态特点,细胞核拥挤,核毛玻璃样,核拉长,核形不规则,有核沟及核内假包涵体可以做出甲状腺乳头状癌诊断,但也存在一定的检测误差,因制片原因形成假的核沟及核内假包涵体,另外一些肿瘤细胞也具有核构的特点,如甲状腺透明变梁状肿瘤和桥本性甲状腺炎合并异型增生的虑泡上皮,而部分是因为样本中可参考的细胞量过少,很难做出正确的诊断。根据Bethesda报告甲状腺细胞病理学系统的结果,有部分病例不能明确诊断相一致,大约有30%的样品被归类为不确定样品,因此,许多研究提倡使用免疫组织化学标记物和分子组合的辅助技术[9],经过细胞块制作,应用免疫组织化学检测,可以明显提高诊断准确性,相关研究指出[10],在甲状腺乳头状癌患者进行FNA取样后,应用液基薄层细胞学制片及免疫检测,结果 CK-19、Galectin- 3、HBME1、CD-44v 表达阳性率分别为91.8%、87.1%、75.3%、85.9%,CD56和E-cadherin 的失表达率分别95.3%和94.1%,其研究结果表明,在US-FNA液基细胞学中CK-19、Galectin-3、HBME- 1和CD-44v 的阳性表达和CD56和E-cadherin 的阴性表达对甲状腺乳头状癌有诊断意义,为术前诊断甲状腺乳头状癌提供了一种可靠而有前景的诊断方法,对甲状腺乳头状微小癌的早期发现,早期诊断有重要的临床意义。关于甲状腺细针穿刺诊断甲状腺乳头状微小癌,相关学者认为,年轻甲状腺乳头状微小癌患者发生中央区淋巴结转移风险不断增加,可根据患者实际病情发展以及各项生命体征现状,为其进行具有针对性的积极治疗,以免患者发生淋巴结转移[11]。
2 免疫组织化学在甲状腺乳头状微小癌与灶性上皮非典型增生的鉴别的应用。
结节性甲状腺肿、腺瘤、桥本氏甲状腺炎等良性病变以及甲状腺乳头状癌周围的甲状腺组织中,形态学上观察到一些类似PTC样核形态结构并与PTC形态学重叠的病变是客观存在的。有数据表明,一些良性结节可能具有恶性潜能,并可能具有从良性到恶性的多灶性进展。Hunt等[12]在慢性淋巴细胞性甲状腺炎的非典型增生区域观察到抑癌基因的杂合缺失突变,表明这些非典型区域是肿瘤性而非反应性区域。
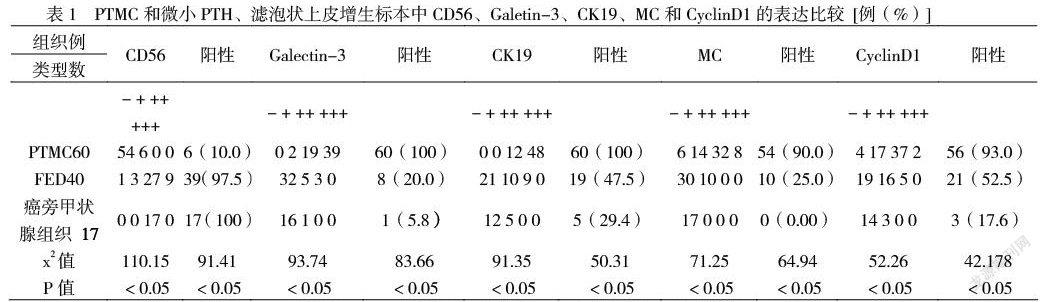
甲状腺乳头状微小癌依靠典型HE细胞学特征,包括毛玻璃样的核,核形不规则、核沟、核内假包涵体和砂粒体可做出诊断,部分PTMC变型中,HE细胞学形态可能并不突出,在甲状腺良性和恶性疾病中经常观察到乳头状形成,这意味着很难区分良性和恶性病变[13]。病理形态学特征,例如具有典型分支的乳头状结构,核特征(包括核不规则,核沟和核内假包涵体)和砂粒体,被广泛用于甲状腺疾病的诊断。然而,由于肿瘤的异质性,将PTC与甲状腺乳头状增生和具有乳头状变的孤立结节区分开来是具有挑战性的。因此,免疫组化在诊断中也必不可少。相关研究表明,免疫组织化学的高表达对诊断甲状腺乳头状微小癌有独特的作用,1995年Xu等[14]首次报道Galectin-3在甲状腺乳头状癌中强表达,相关研究指出[15],CK19高表达于PTC,阳性率70%-100%不等,而在甲状腺良性病变中报道不一致,在各种上皮组织和肿瘤中表达,尽管在甲状腺滤泡上皮细胞源性病变中表达的广泛性和强度方面的研究之间存在差异,但在乳头状癌中它的扩散程度和强度更高。CK19在本研中(60/60)弥漫强阳性表达,在非典型增生滤泡上皮中(19/40)出现不均匀弱到中等强度表达(表1),特异性和准确性低于CD56,galectin-3,MC(表2)。HBME-1有大量研究报告了其在确定滤泡上皮细胞的甲状腺结节中的恶性肿瘤方面的优势[16]。在Mataraci等人的研究中,HBME-1对40个甲状腺增生性结节和35个滤泡性腺瘤均呈阴性[16]。同样,在我们的研究中,我们未在癌旁周边甲状腺组织中观察到HBME-1阳性,在非典型增生滤泡上皮中(10/40)出现灶性弱阳性表达(表1),特异性和准确性仅次于CD56,galectin-3(表2)。MCNasr等[17],在51 PTC和57甲状腺良性病变中已经使用了许多免疫组织化学标记物。他们发现,在96%的恶性组织HBME-1染色,而在93%的良性病变中未观察到染色。galectin-3、CK19标记物在甲状腺乳头状微小癌中均呈弥漫强阳性染色,而在良性病变中见灶性弱到中等阳性染色(表1)。CD56在甲状腺乳头状微小癌中表达能力降低或缺失,提标肿瘤细胞的病变发展程度及预后情况,在以前的研究中,据报道PTC中CD56的表达率为0-24.3%,PTMC中为0-60%,甲状腺良性疾病为91.7-100%[18],本研究表明,CD56在甲狀腺乳头状微小癌组织中表达大部分消失,阳性率10.0%,滤泡上皮异形增生阳性率97.5%,在癌周边甲状腺组织中100%表达(表1)。CD56、Galectin- 3、CK19灵敏度最高100%,CD56的特异度和准确度最高,因此,我们认为CD56是非常有效的筛选标记。Park等,已在甲状腺癌和甲状腺良性结节中免疫组织化学研究了CD56,galectin-3和CK19,92.5%的PTC患者无CD56染色,他们仅在1例发现强染色(3+)。FA和NH病例中CD56的染色百分比分别为93.3%和90.5%。在这项研究中,与CK19和半乳凝素3相比,最特异性的标志物是CD56[19]。与我们的研究相一致。最不特异的标记物是CyclinD1。相关研究,HBME-1和/或半乳凝素3阳性标志物的CD56阴性标志物的双重和三重组合可能对PTC病例的鉴别诊断非常有用[20] ,因此联合应用CD56、Galectin- 3及HBME-1对甲状腺乳头状微小癌的诊断非常有价值。
3 BRAF基因分子生物学标志物在甲状腺乳头状微小癌的作用。
BRAF属于RAF蛋白家族,是有丝分裂原激活的蛋白激酶信号级联反应的细胞内效应器[21]。相关报道,BRAF突变率在PTC中为29-83%,在PTMC中为37.5-77%,在甲状腺良性疾病中为0.2-5.7%[22]。Ylli 等人[23],在 PTC 中检测出BRAF-V600E为56%,在其他肿瘤中均未检出。周迪等[24]研究发现 89 例 PTC 中突变率为78.61%研究相一致。相关研究中[25],BRAF突变率在PTC中为77.5%(93/120),在PTMC中为73.4%(47/64),在NG中为8.8%(3/34),在HT中为7.1%(2/28)。此外,目前的结果表明,BRAF突变与PTC和PTMC中CK19和galectin-3的表达有关。这些结果表明BRAF突变可能在甲状腺癌的诊断中有价值。一些证据表明,BRAF V600E突变与预后相对较差有关,尽管在BRAF V600E阳性组中总体死亡率也很低。TERT启动子突变也可能赋予更具侵略性的表型,即使控制了其他临床病理因素,BRAF V600E和TERT启动子突变的患者似乎也具有较高的侵袭性疾病发生率。结果表明BRAF基因阳性甲状腺乳头状微小癌更具侵袭性,应进行积极治疗。
4 总结
甲状腺乳头状微小癌的发病率不断增高,虽然相关研究证实甲状腺乳头状微小癌是惰性癌,恶性程度较低,但肿瘤直径大小对患者预后有较大影响,肿瘤直径越大,淋巴结转移概率就越高,因此早期诊断显得尤为重要。甲状腺微小结节术前可以选择在超声引导下细针穿刺(US-FNA)进行液基细胞学诊断,必要时再进行细胞块制作并应用免疫组织化学技术可以提高诊断的准确度。甲状腺乳头状微小癌根据细胞学形态特点,细胞核拥挤,核毛玻璃样,核拉长,核形不规则,有核沟、核内假包涵体及肿瘤边界情况综合判断可以做出诊断,但要注意与滤泡上皮非典型增生作鉴别,结合应用免疫组织化CD56、Galetin-3、CK19、MC和CyclinD1对鉴别诊断有非常大的帮助,特别就CD56、Galetin-3、MC的联合应用,必要时应用BRAF V600E基因检测对甲状腺乳头状微小癌的诊断有一定意义,BRAF基因阳性甲状腺乳头状微小癌更具侵袭性,应进行积极治疗。
参考文献:
[1].房芹,白玉勤.甲状腺微小乳头状癌相关预后指标的研究进展[J].赤峰学院学报(自然科学版),2020(4):27-29.
[2]. Yokozawa T, Miyauchi A, Kuma K, Sugawara M. Accurate and simple method of diagnosing thyroid nodules the modified technique of ultrasound-guided fine needle aspiration biopsy. Thyroid. 1995; 5:141–45. https://doi.org/10.1089/thy.1995.5.141.
[3]. Ahuja S, Ernst H, Lenz K. Papillary thyroid carcinoma: occurrence and types of lymph node metastases. J Endocrinol Invest. 1991; 14:543–49. https://doi.org/10.1007/BF03346863.
[4]. Hawk WA, Hazard JB. The many appearances of papillary carcinoma of the thyroid. Cleve Clin Q. 1976; 43:207–15.
[5] Zhang L, Wei WJ, Ji QH, Zhu YX, Wang ZY, Wang Y, Huang CP, Shen Q, Li DS, Wu Y. Risk factors for neck nodal metastasis in papillary thyroid microcarcinoma: a study of 1066 patients. J Clin Endocrinol Metab. 2012; 97:1250–57. https://doi.org/10.1210/jc.2011-1546.
[6]. Chang YW, Kim HS, Kim HY, Lee JB, Bae JW, Son GS. Should central lymph node dissection be considered for all papillary thyroid microcarcinoma? Asian J Surg. 2016; 39:197–201.
[7].Ersillo Trapanese,Carmine De Bartolomeis,Basilio Angrisani and Giulio Tarro,Papillary thyroid microcarcinoma (Black Ink)[J]. Oncotarget,2018,9(49):29275-29283.
[8].周樂,张广,张大奇,等. 超声引导下甲状腺结节细针穿刺活检临床应用及质量控制研究 [J]. 临床合理用药杂志,2017,35 (4):650-652.
[9].Solmaz OA. Diagnostic importance of CD56 with fine-needle aspiration cytology in suspected papillary thyroid carcinoma cases. Cyto-journal 2018; 15: 3.
[10].杨晓斌,欧陵斌,肖古月.细针吸取结合液基细胞学对甲状腺 乳头状癌的免疫组化分析[J].中國现代医学杂志,2011,21(27):3380-3382.
[11].郭媛洁,徐秀梅,翟虹.甲状腺微小乳头状癌临床 及超声特征与颈部淋巴结转移的相关性 [J].新 疆医科大学学报,2019,42(12):1606-1609
[12].Hunt JL, Baloch ZW, Barnes L, et al. Loss of heterozygosity mutations of tumor suppressor genes in cytologically atypical areas in chronic lymphocytic thyroiditis[J]. Endocr Pathol, 2002,13:321-330.
[13].Lee JH, Shin JH, Lee HW, Oh YL, Hahn SY and Ko EY: Sonographic and cytopathologic correlation of papillary thyroid carcinoma variants. J Ultrasound Med 34: 1‑15, 2015.
[14].Xu XC,el-Naggar AK, Lotan R. Differential expression of galectin-1 and galectin-3 in thyroid Tumors. Potential diagnostic implications[J]. AM J Pathol,1995,147( 3) : 815 - 822.
[15] .Cui W,Sang W,Zheng S,et al. Usefulness of cytokeratin-19, galectin-3,and Hector Battifora mesothelial-1 in the diagnosis of benign and malignant thyroid nodules[J]. Clin Lab,2012,58( 7- 8) : 673 - 680.
[16].Mataraci EA, Ozguven BY, Kabukcuoglu F. Expression of cy-tokeratin 19, HBME-1 and galectin-3 in neoplastic and non-neoplastic thyroid lesions. Pol J Pathol 2012; 63: 58-64.
[17].Nasr MR, Mukhopadhyay S, Zhang S, Katzenstein AL. Immunohistochemical markers in diagnosis of papillary thyroid carcinoma: Utility of HBME1 combined with CK19 immunostaining. Mod Pathol 2006;19:1631‑7.
[18].Bizzarro T, Martini M, Marrocco C, D'Amato D, Traini E, Lombardi CP, Pontecorvi A, Fadda G, Larocca LM and Rossi ED: The role of CD56 in thyroid fine needle aspiration cytology: A pilot study performed on liquid based cytology. PloS One 10: e0132939, 2015.
[19].Park WY, Jeong SM, Lee JH, Kang HJ, Sin DH, Choi KU, et al. Diagnostic value of decreased expression of CD56 protein inpapillary carcinoma of thyroid gland. Basic Appl Pathol 2009;2:63‑8.
[20].Ceyran AB, Şenol S, Şimşek BC, Sağıroğlu J, Aydın A. Role of cd56 and e‑cadherin expression in the differential diagnosis of papillary thyroid carcinoma and suspected follicular‑patterned lesions of the thyroid: The prognostic importance of e‑cadherin. Int J Clin Exp Pathol 2015;8:3670‑80.
[21].Rossi M, Buratto M, Tagliati F, Rossi R, Lupo S, Trasforini G, Lanza G, Franceschetti P, Bruni S, Degli Uberti E and Zatelli MC: Relevance of BRAF(V600E) mutation testing versus RAS point mutations and RET/PTC rearrangements evaluation in the diagnosis of thyroid cancer. Thyroid 25: 221‑228, 2015.
[22].Liu Z, Yu P, Xiong Y, Zeng W, Li X, Maiaiti Y, Wang S, Song H, Shi L, Liu C, et al: Significance of CK19, TPO, and HBME‑1 expression for diagnosis of papillary thyroid carcinoma. Int J Clin Exp Med 8: 4369‑4374, 2015.
[23]. Ylli D,Patel A,et al. Microfluidic Droplet Digital PCR Is a Powerful Tool for Detection of BRAF and TERT Mutations in Papillary Thyroid Carcinomas[J]. Cancers ( Basel) ,2019,11( 12) : 1916.
[24].周迪,刘霞,丁国楠,等. BRAFV600E 免疫组化在甲状腺乳头状 癌中的表达及与临床病理特征的相关性研究[J]. 中国实验诊断学,2019,23( 8) : 1363 - 1366.
[25].LIHUA HUANG, XUMING WANG.Diagnostic significance of CK19, galectin-3, CD56, TPO and Ki67 expression and BRAF mutation in papillary thyroid carcinoma J ONCOLOGY LETTERS 15: 4269-4277, 2018
基金项目:贺州市科学技术和知识产权局科研课题项目(编号:贺科转1809014)
作者简介:黄力营,女,1974.08,汉族,广西贺州市,研究生,病理科主任/副主任医师,研究方向:基础医学,病理学

