剪切波弹性成像定量参数对乳腺肿块良恶性鉴别及与生物学指标的相关性分析*
王嘉图,赵丽,尹世淩,田晓玲
(甘肃中医药大学附属医院超声科,甘肃兰州730000)
乳腺癌是起源于乳腺导管上皮的高度异质性疾病,发病率占恶性肿瘤的7%~10%[1-2]。早期无典型体征及症状,随着病情进展,可在诸多器官(脑、肺、骨等)中发生转移并使正常组织受损。分子基因的异常表达可影响肿瘤细胞诸多生物学行为,并改变肿瘤组织形态[3]。研究指出,肿瘤生物学特征所致的病理形态学改变是乳腺癌出现影像学异常的基础[4]。因此,阐明乳腺癌影像学征象与生物学指标的关系尤为关键。已有研究证实,扩散加权成像(diffusion weighted imaging, DWI)定量参数、超声弹性成像评分等与乳腺癌分子生物学指标有关[5-6],但尚未明确剪切波弹性成像(shear wave elastography, SWE)定量参数与生物学指标的关系。SWE 属于一种脉冲波触诊技术,具有可视化、实时、定量等优势,其可通过声辐射脉冲叩击组织施加激励,获取弹性模量值,从而鉴别肿瘤性质,判断组织硬度变化[7-8]。本文旨在分析SWE 定量参数鉴别乳腺肿块良恶性的价值及与生物学指标的关系。
1 资料与方法
1.1 一般资料
选取2018年9月—2021年10月于甘肃中医药大学附属医院超声科检查的乳腺肿块患者100例(共100个乳腺肿块)。患者年龄35~65岁,平均(50.32±8.67)岁;病程1~5年,平均(3.12±0.84)年;体质量指数20.87~24.65 kg/m2,平均(22.16±1.42)kg/m2;肿块直径5~38 mm,平均(20.32±4.18)mm;肿块位于左侧58 例,右侧42 例。恶性乳腺肿块56例作为恶性组,其中浸润性导管癌50 例,小叶原位癌2 例,导管原位癌2 例,黏液癌1 例,乳头状癌1 例;良性乳腺肿块44 例作为良性组,其中纤维腺瘤17 例,腺病伴纤维腺瘤12 例,乳腺腺病8 例,导管内乳头状瘤3 例,慢性化脓性炎症2 例,纤维腺瘤伴不典型增生1 例,腺病伴不典型增生1 例。纳入标准:①女性;②单侧乳腺单发肿块;③肿块直径<50 mm;④接受经空心针穿刺活检或手术病理检查;⑤术前无乳腺炎病史、隆胸史、放化疗史及乳腺相关手术史;⑥自愿签署知情同意书。排除标准:①复发性乳腺癌;②乳腺超声检查与病理检查时间>1 个月;③伴有严重肝肾疾病、心脑血管疾病;④妊娠期或哺乳期;⑤病灶紧邻部位有瘢痕。
1.2 方法
1.2.1 SWE 检查采用荷兰Philips 公司的Epiq5型彩色多普勒超声诊断仪,选择eL18-4 高频线阵探头,超宽带频率3~22 MHz,乳腺模式。常规超声检查观察肿块声像图特征后转为SWE 模式,默认量程为0~180 kPa,感兴趣区(region of interest,ROI)2 mm×2 mm。打开质控图,将探头移至距肿块边缘>3 mm 处,移动过程需缓慢轻柔。嘱患者屏气,不施压,图像稳定时间需>3 s,定帧存储。借助Q-Box 测量软件测量SWE 定量参数。通过Shell功能及描迹法分别测量病灶1 mm、2 mm、3 mm区域内组织(Shell1、Shell2、Shell3)的最大弹性模量值(Emax),分别记录为AE-max、Shell1 Emax、Shell2 Emax、Shell3 Emax。
1.2.2 免疫组织化学检查取恶性组标本,甲醛固定,石蜡包埋,3μm厚切片处理,HE染色,观察镜下切片。通过免疫组织化学法测定乳腺肿块细胞增殖抗原标志物表达情况,包括孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)、雌激素受体(estrogen receptor, ER)、增殖细胞核抗原Ki-67。细胞核染棕色>10%定义为PR、ER 阳性,并分为PR 阴性组19 例和PR 阳性组37 例、ER 阴性组16 例和ER 阳性组40 例;切片视野中阳性细胞比例>10% 定义为HER-2 阳性,并分为HER-2 阴性组(21 例)和HER-2 阳性组(n35 例);细胞核内着色颗粒为棕色定义为Ki-67 阳性,并分为Ki-67 阴性组(18 例)和Ki-67 阳性组(38 例)。
1.3 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验;相关性分析采用Kendall's tau-b 检验;绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)。P<0.05 为差异有统计学意义。
2 结果
2.1 两组SWE定量参数比较
两组AE-max、 Shell1 Emax、Shell2 Emax、Shell3 Emax比较,差异有统计学意义(P<0.05),恶性组较良性组大。见表1。
表1 两组SWE定量参数比较 (kPa,±s)
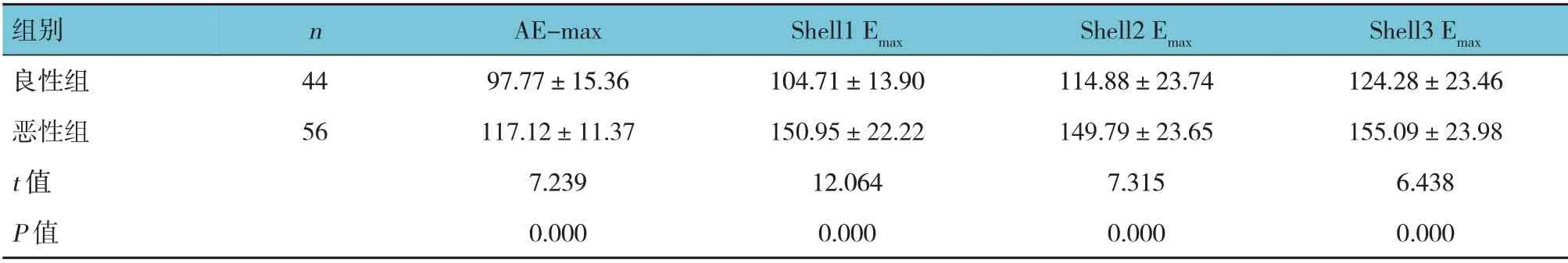
表1 两组SWE定量参数比较 (kPa,±s)
组别良性组恶性组t 值P 值n 44 56 AE-max 97.77±15.36 117.12±11.37 7.239 0.000 Shell1 Emax 104.71±13.90 150.95±22.22 12.064 0.000 Shell2 Emax 114.88±23.74 149.79±23.65 7.315 0.000 Shell3 Emax 124.28±23.46 155.09±23.98 6.438 0.000
2.2 SWE定量参数预测乳腺癌的ROC曲线分析
将SWE 定量参数AE-max、Shell1 Emax、Shell2 Emax、Shell3 Emax及4 者联合检测作为因变量,将乳腺肿块性质作为自变量(恶性=0,良性=1),进行ROC 分析。结果发现,AE-max、Shell1 Emax、Shell2 Emax、Shell3 Emax及4 者联合检测预测乳腺癌发生的AUC 分别为0.830、0.906、0.844、0.833 和0.978。见表2和图1。
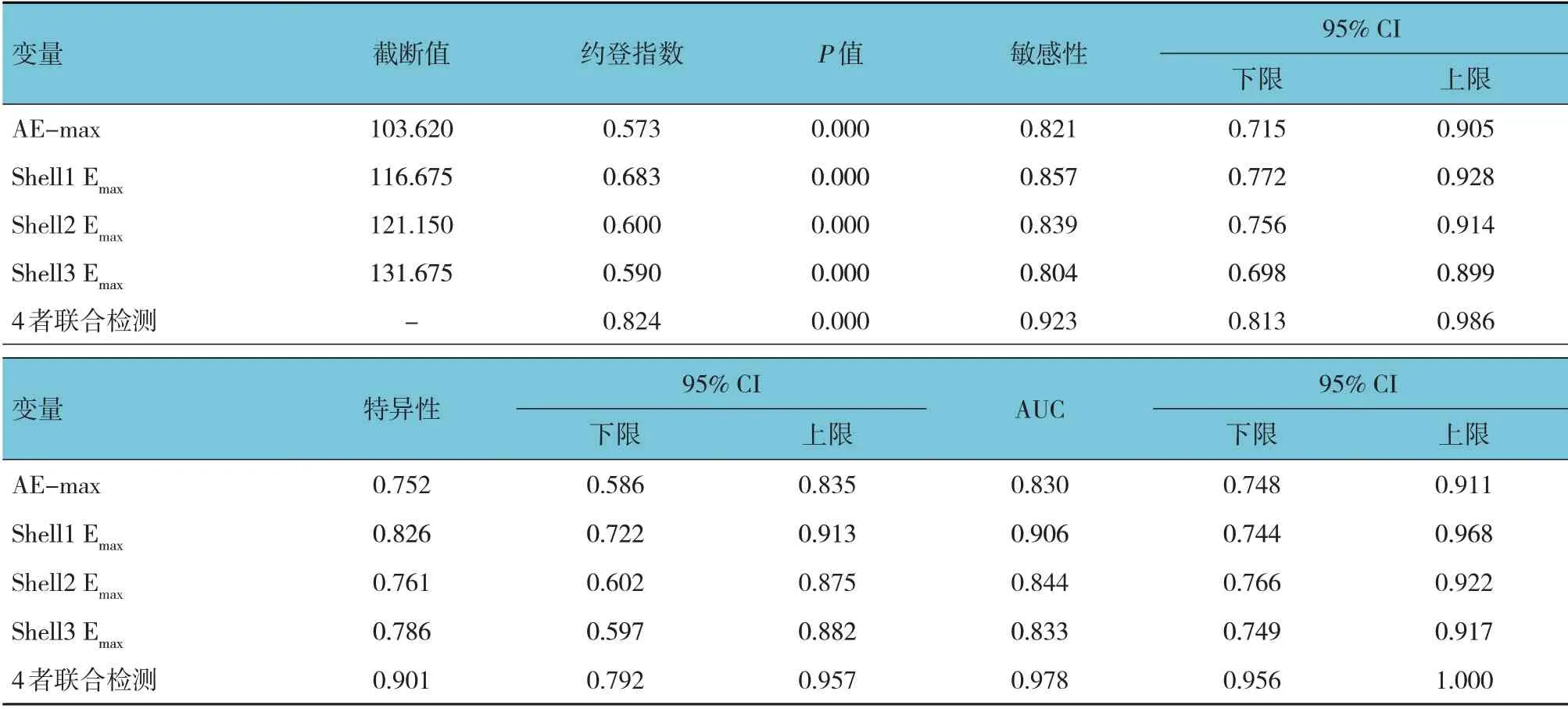
表2 SWE定量参数预测乳腺癌的价值分析
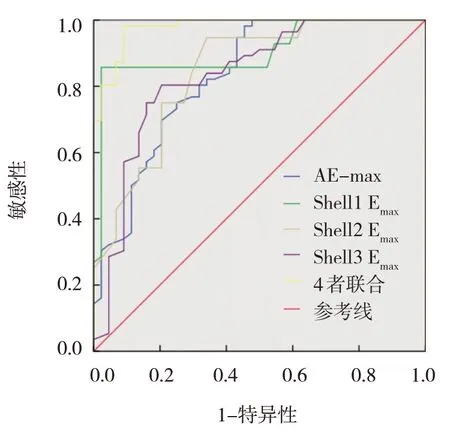
图1 SWE定量参数预测乳腺癌的ROC曲线
2.3 PR、ER、HER-2、Ki-67 乳腺癌患者阳性、阴性表达的SWE定量参数比较
PR、ER、HER-2、Ki-67 的阳性组与对应阴性组的AE-max、Shell1 Emax、Shell2 Emax和Shell3 Emax比较, 差异有统计学意义(P<0.05)。 见表3~6。
表3 PR阴性组与PR阳性组SWE定量参数比较 (kPa,±s)
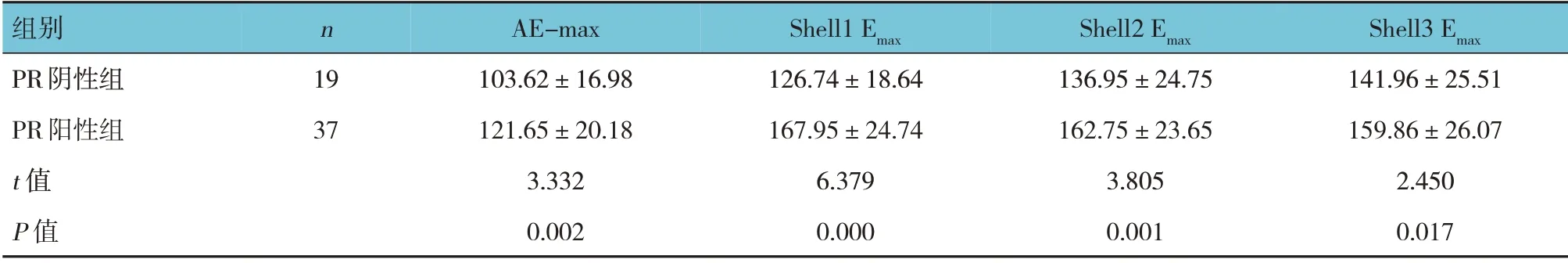
表3 PR阴性组与PR阳性组SWE定量参数比较 (kPa,±s)
组别PR阴性组PR阳性组t 值P 值n 19 37 AE-max 103.62±16.98 121.65±20.18 3.332 0.002 Shell1 Emax 126.74±18.64 167.95±24.74 6.379 0.000 Shell2 Emax 136.95±24.75 162.75±23.65 3.805 0.001 Shell3 Emax 141.96±25.51 159.86±26.07 2.450 0.017
表4 ER阴性组与ER阳性组SWE定量参数比较 (kPa,±s)
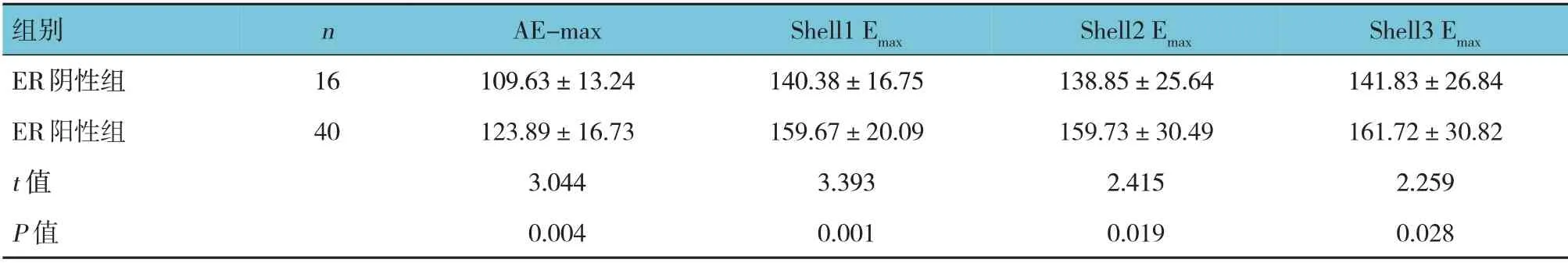
表4 ER阴性组与ER阳性组SWE定量参数比较 (kPa,±s)
组别ER阴性组ER阳性组t 值P 值n 16 40 AE-max 109.63±13.24 123.89±16.73 3.044 0.004 Shell1 Emax 140.38±16.75 159.67±20.09 3.393 0.001 Shell2 Emax 138.85±25.64 159.73±30.49 2.415 0.019 Shell3 Emax 141.83±26.84 161.72±30.82 2.259 0.028
表5 HER-2阴性组与HER-2阳性组SWE定量参数比较 (kPa,±s)
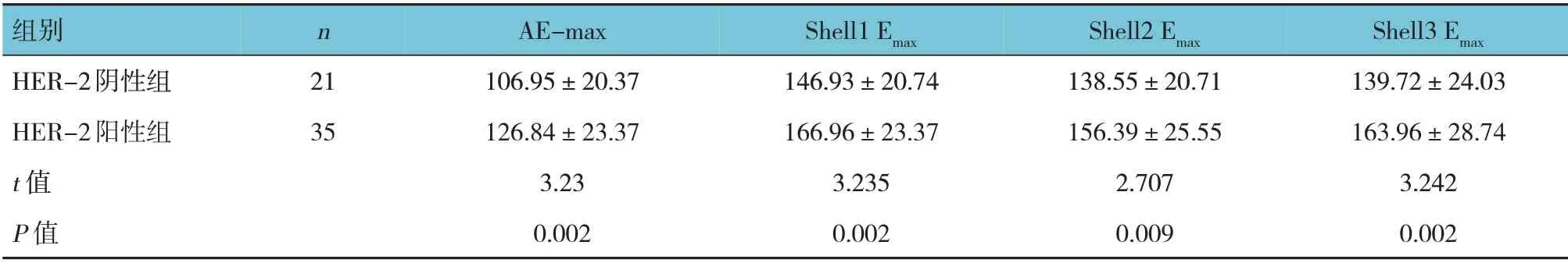
表5 HER-2阴性组与HER-2阳性组SWE定量参数比较 (kPa,±s)
组别HER-2阴性组HER-2阳性组t 值P 值n 21 35 AE-max 106.95±20.37 126.84±23.37 3.23 0.002 Shell1 Emax 146.93±20.74 166.96±23.37 3.235 0.002 Shell2 Emax 138.55±20.71 156.39±25.55 2.707 0.009 Shell3 Emax 139.72±24.03 163.96±28.74 3.242 0.002
表6 Ki-67阴性组与Ki-67阳性组SWE定量参数比较 (kPa,±s)
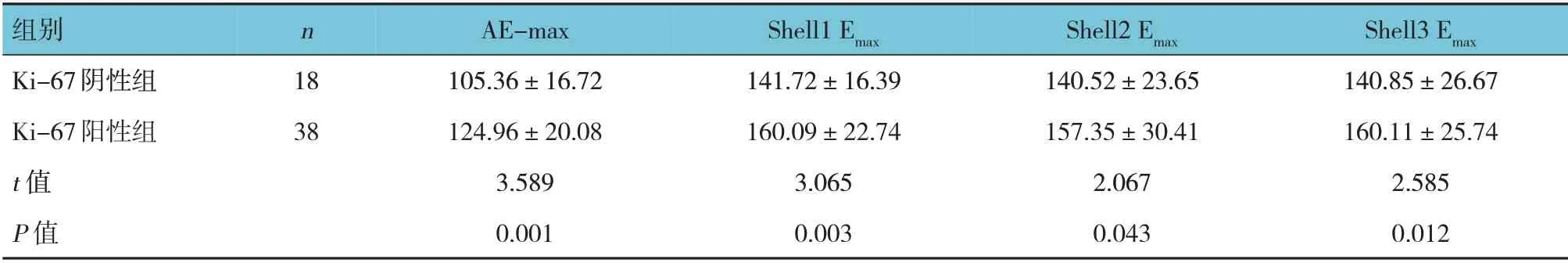
表6 Ki-67阴性组与Ki-67阳性组SWE定量参数比较 (kPa,±s)
组别Ki-67阴性组Ki-67阳性组t 值P 值n 18 38 AE-max 105.36±16.72 124.96±20.08 3.589 0.001 Shell1 Emax 141.72±16.39 160.09±22.74 3.065 0.003 Shell2 Emax 140.52±23.65 157.35±30.41 2.067 0.043 Shell3 Emax 140.85±26.67 160.11±25.74 2.585 0.012
2.4 乳腺癌病灶的SWE定量参数与生物学指标的相关性
Kendall's tau-b 相关性分析显示,乳腺癌病灶的AE-max、Shell1 Emax、Shell2 Emax、Shell3 Emax与PR、ER、HER-2、Ki-67 表达均呈正相关(P<0.05)。见表7。
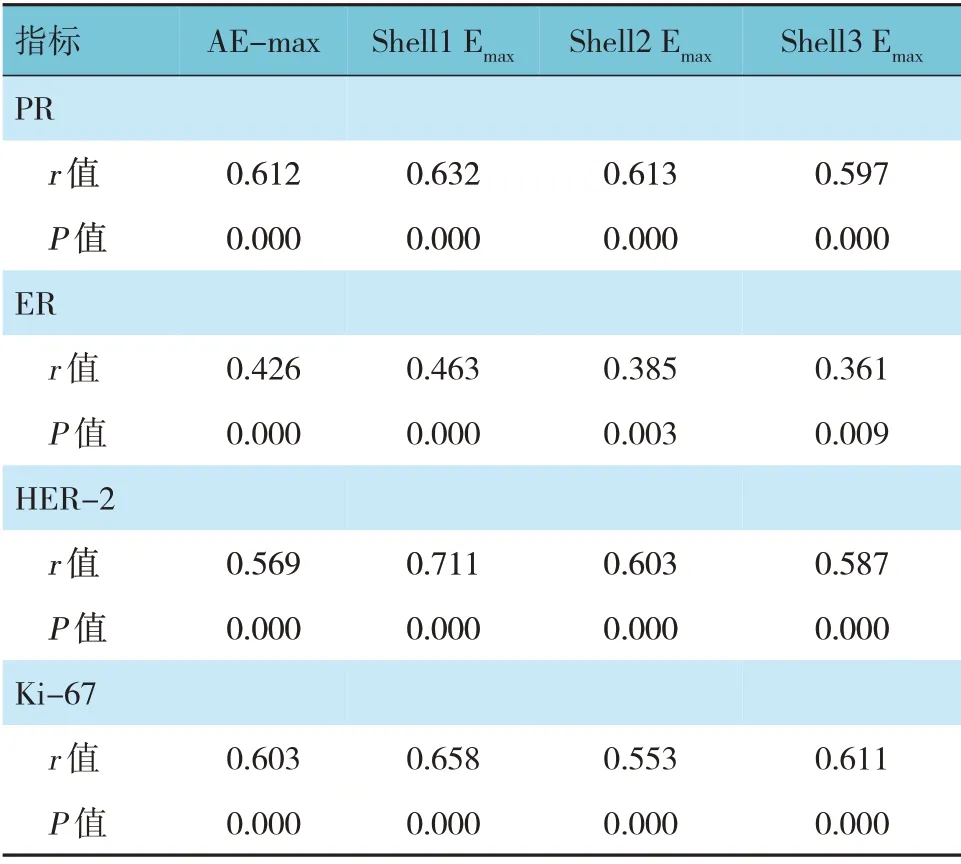
表7 乳腺癌病灶的SWE定量参数与生物学指标的相关性
2.5 不同临床病理特征患者的PR、ER、HER-2及Ki-67阳性率比较
良性与恶性乳腺肿块患者PR、ER、HER-2 及Ki-67 阳性率比较,差异有统计学意义(P<0.05),恶性高于良性。有无淋巴结转移患者HER-2 阳性率比较,差异有统计学意义(P<0.05),有淋巴结转移高于无淋巴结转移。其余指标比较,差异无统计学意义(P>0.05)。见表8。
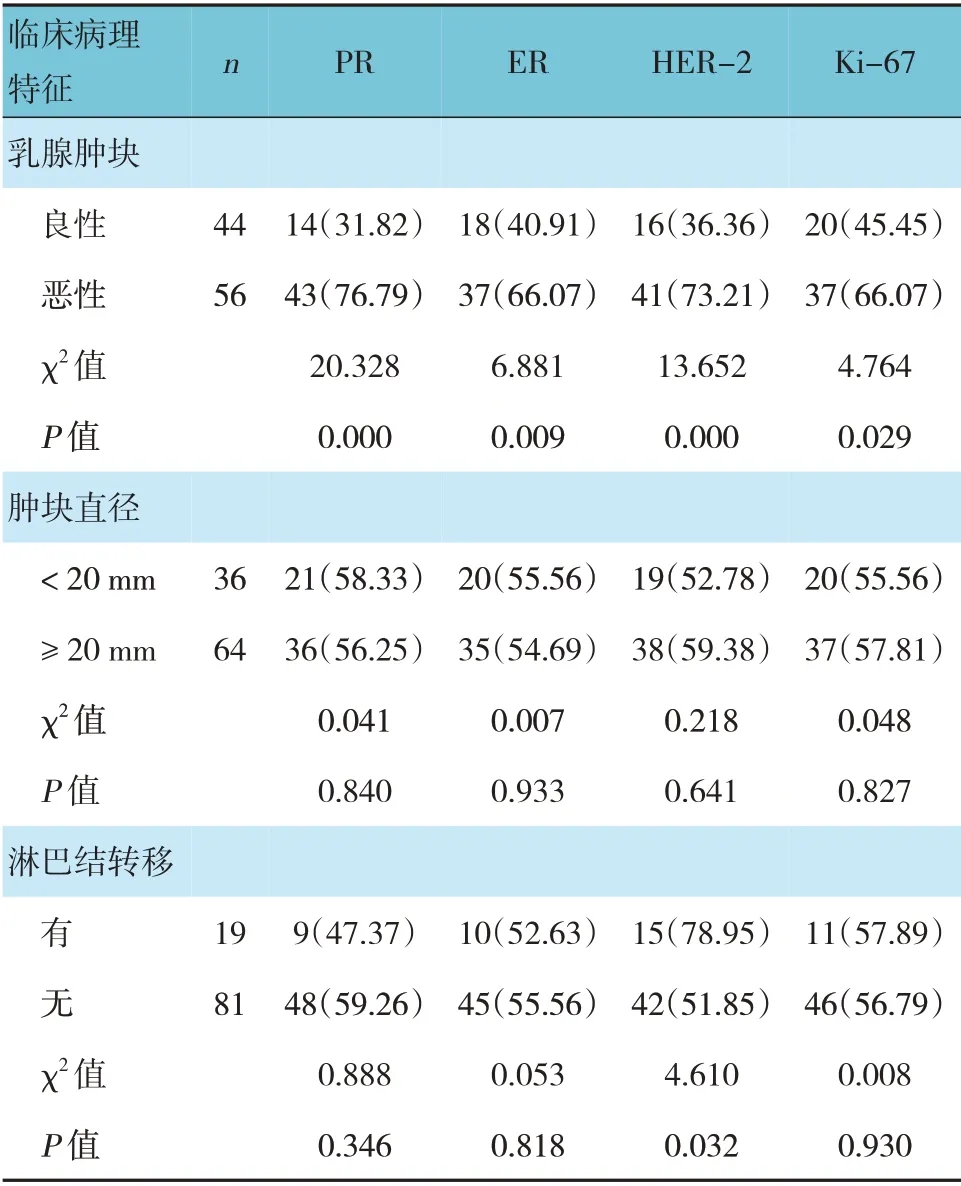
表8 不同临床特征患者的PR、ER、HER-2及Ki-67阳性率比较 例(%)
3 讨论
原发性乳腺癌的形态结构复杂,细胞增生异常,胶原纤维组织大量增加,并构成癌细胞外基质,大量纤维与周围组织黏连,活动度降低。在乳腺癌进展过程中,肿瘤内血管不断生长,且周围结缔组织持续增生,可导致病变组织硬度增加、肿瘤直径扩大[9-10]。胡小丽等[11]研究发现,弹性模量可有效鉴别乳腺癌病理类型,病变组织的弹性模型值由大至小依次为浸润性导管癌、腺病、导管内乳头状瘤、纤维腺瘤。FORTE 等[12]研究报道,乳腺恶性病灶的硬度与胶原纤维含量呈正相关,且与乳腺肿瘤细胞生长期间细胞外基质胶原过度沉积、交联及线性化的病理特征相符。由上述国内外研究不难看出,乳腺恶性肿块病变程度与组织硬度有关。基于这一理论,SWE 通过测量不同病变组织的弹性模量值,以定量鉴别乳腺肿块的性质。
SWE 扫查时利用快速声辐射力激励产生线性振源,根据位移时空分布图获得组织的剪切波传播速度或杨氏模量,形成组织弹性图,从而评估病灶硬度,达到实时量化分析组织弹性特征的目的[13-14]。林武辉等[15]研究发现,恶性乳腺肿瘤SWE 检查时颜色分布紊乱,颜色多为红色,而良性肿瘤的颜色呈均匀分布,且以蓝色为主。BIONDIC ŠPOLJAR 等[16]研究发现,SWE 诊断乳腺癌准确率、敏感性为82%、83%。SEO 等[17]以BIRADS 结果为最终评估标准,结果发现,SWE 鉴别乳腺癌恶性的AUC 为0.940。本研究中,恶性组AE-max、Shell1 Emax、Shell2 Emax、Shell3 Emax较良性组大,分析原因可能在于肿瘤硬度受间质水肿、血管形成、内部细胞构成等因素影响,而恶性肿瘤会侵袭周边组织,导致肿瘤内部及周边促结缔组织增生性反应,降低组织弹性,加重肿瘤内部血管生成、细胞结构及间质水肿,增加病变组织硬度[18]。进一步绘制ROC 曲线发现,4 项定量参数联合预测乳腺癌发生的AUC 为0.978,与上述研究结论相似,再次证实SWE 定量参数可有效鉴别乳腺肿块良恶性,可为临床防治提供影像学依据。
随着分子生物学及药理学的进步,PR、HER-2等生物标志物的合理使用为乳腺癌的诊治提供实质性价值。ER、PR 在靶器官细胞的生长、增殖、分化中发挥重要的调控作用,当上皮细胞出现异型增生时,ER、PR 表达异常,影响患者预后及对内分泌治疗的反应[19]。HER-2 通过信号传导参与调控细胞分化及分裂过程中,在该信号传导过程中,外部生长因子经细胞内信号因子或跨膜蛋白的磷酸化及去磷酸化来发挥影响基因转录的作用。张唤雨等[20]研究发现,乳腺癌组织中HER-2、ER、PR 均呈高表达,经新辅助化疗后上述表达降低。Ki-67 可用于评估肿瘤细胞增殖活性。王文云等[21]研究报道,超声造影定性资料与乳腺癌患者Ki-67表达有关。本研究结果发现,乳腺肿块恶性患者的PR、ER、HER-2 及Ki-67 的阳性率高于良性患者,且经Kendall's tau-b 相关性分析,乳腺癌病灶的AE-max、Shell1 Emax、Shell2 Emax、Shell3 Emax均与PR、ER、HER-2、Ki-67 表达呈正相关,表明乳腺癌的PR、ER、HER-2 及Ki-67 呈高表达,且SWE定量参数与其生物学指标有关,可指导临床乳腺癌不同亚型的个体化治疗。其原因为ER、PR、HER-2 过表达型乳腺癌病理表现以淋巴细胞浸润、微血管密度大等为主,且肿瘤局部侵袭度高,肿瘤生长速度快,故该类型的病变组织硬度较大;HER-2 过表达会导致细胞外基质中的蛋白质大量聚集,而细胞外基质可通过胶原交联导致肿瘤细胞迁移、周围组织粘黏,增加组织硬度;Ki-67 表达与肿瘤恶性程度、侵袭能力、增殖速度及与周围组织黏连程度有关,且Ki-67 表达上升可促进微血管增殖,导致组织硬度增加。
综上所述,SWE 定量参数可有效鉴别乳腺肿块良恶性,且与乳腺癌生物学指标密切相关,在临床诊断中有一定的参考价值。

