人参皂苷Rg1对慢性脑缺血导致白质损伤的影响
李欣娱,楚世峰,李晚晚,贺文彬,陈乃宏,
(1.山西中医药大学中药与食品工程学院,山西 太原 030619;2.中国医学科学院药物研究所神经科学中心,天然药物活性物质与功能国家重点实验室,北京 100050;3.国家卫生健康委医药卫生科技发展研究中心,北京 100044)
大脑内部神经纤维聚集的地方,颜色浅,称为脑白质。脑白质由被髓鞘包裹着的神经轴突组成,控制着神经元共享的讯号,协调脑区之间的正常运作。许多因素会导致脑白质病变,如感染、中毒、神经退行性疾病、外伤和慢性脑缺血等。脑白质病变会损伤人的认知和运动协调能力[1],且越来越趋于年轻化。目前,由于缺乏安全有效的治疗方法,白质病变的治疗多以预防为主。人参具有增强学习记忆能力、提高免疫力[2]和改善心脑血管疾病的作用。本课题组研究[3]证明人参皂苷Rg1对急性脑缺血损伤具有保护作用,而对慢性缺血造成脑白质的损伤尚未进行深入研究。本实验采用BCAS(bilateral carotid artery stenosis,BCAS)方法[4]建立脑白质损伤模型,在此基础上探究人参皂苷Rg1对慢性脑白质损伤的影响。
1 材料与方法
1.1 动物健康♂性C57BL/6小鼠,50只,8周龄,购买于北京维通利华实验动物技术有限公司(SYXK(京)2019-0023)。体质量(18~22) g,SPF级。所有动物均饲养于SPF级动物房,恒温(22±1) ℃,相对湿度55%±10%,12/12 h明暗交替,自由获取食物和水。所有小鼠在进行正式实验前于该环境适应1周。
1.2 药品与试剂人参皂苷Rg1由吉林大学化学学院教研室提供,纯度≥98%;盐酸多奈哌齐,卫材(中国)药业有限公司制造,批准文号:国药准字H20050978;异氟烷购买于深圳市瑞沃德生命科技有限公司;固蓝染液、碳酸锂溶液购于武汉赛维尔生物有限公司;BCA蛋白浓度测定试剂盒、ECL超敏发光液等购于北京普利莱基因有限公司;牛血清白蛋白(BSA)、β-actin Mouse Antibody等购于美国Sigma公司;Anti-Myelin Basic Protein antibody(货号:ab11159)、Anti-Olig2 antibody(货号:ab109186)等购于英国Abcam;驴抗兔IgG荧光二抗(批号:2273718)、驴抗小鼠IgG荧光二抗(批号:1975519)等购于美国Invitrogen公司。
1.3 仪器双目体式显微镜,深圳市瑞沃德生命科技有限公司,型号77001S;0.18 mm弹簧微线圈,Sawane Spring Co,Shizuoka,Japan;激光多普勒血流仪,英国Moor仪器公司;BX51正置显微镜,日本OLYMPUS公司;Image Quant LAS-4000 min型化学发光成像仪,美国GE公司;激光共聚焦显微镜,德国徕卡公司。
1.4 方法
1.4.1动物分组、模型制备及给药 将50只C57BL/6小鼠随机分为Sham组、BCAS模型组、阳性药组、Rg1低剂量组、Rg1高剂量组,每组10只。小鼠用异氟烷维持麻醉,使用加热垫将其体温保持在37 ℃左右,从颈部正中开口,剥离两侧相关肌肉,分离出两侧迷走神经VN(vagus nerve,VN)和颈总动脉CCA(common carotid artery,CCA),将0.18 mm弹簧微线圈缠绕在CCA上,注意不要损伤VN。Sham组只分离相关血管,不缠绕弹簧,术后立即缝合伤口并消毒。术后1 d,阳性药组小鼠灌胃盐酸多奈哌齐0.5 mg·kg-1,Rg1低剂量组、高剂量组分别灌胃Rg1 5 mg·kg-1、10 mg·kg-1,假手术组、BCAS模型组小鼠灌胃等量生理盐水,不间断30 d。
1.4.2体重及CBF值检测 在造模过程中,每天称量各组小鼠的体重并记录。在造模前,沿失状正中线将小鼠头部皮肤剪开,用激光多普勒血流仪监测小鼠术前皮层CBF(cerebral blood flow,CBF)值,并监测术后、术后2 h、1 d、3 d、7 d、14 d、30 d皮层CBF值。
1.4.3行为学检测
1.4.3.1 爬杆实验 动物给药30 d后,进行爬杆实验,爬杆实验通过记录小鼠由杆的顶端往下爬到底部所需时间,来检测动物的运动协调能力[2]。将高50 cm、直径1 cm、由纱布包裹的爬杆装置放置于一个木箱中。在小鼠适应环境后,将其头部朝上放置于爬杆顶部的木质小球上,引导小鼠向下爬行。每只小鼠训练3次,以确保它们在被放在球上的时候有向下爬的意识。记录小鼠从开始向下爬到四肢全部着地所用的时间。共进行5次测试,每次测试间隔至少30 min,选取5次测试的平均值进行统计分析。
1.4.3.2 新物体识别实验 新物体识别实验分为熟悉、适应、测试3个阶段。在动物给药30 d后,进行熟悉阶段的实验,首先将一只小鼠放在长、宽、高均为50 cm的木箱中,使其熟悉5 min,然后取出。再将下一只小鼠放入之前,喷洒10%的乙醇,消除上只动物的残留气味。依此,使所有组小鼠都熟悉木箱环境。d 2,在木箱对称位置放入两个相同大小的长方形木块,两个木块的位置距离木箱中心、侧壁距离相等。将小鼠放入木箱中距离两个物体等距位置处,使其适应5 min,观察小鼠的行走路径,用Smart 3.0软件记录小鼠对物体的探究时间,小鼠鼻子距物体1 cm之内视为其对物体有探索行为。d 3,将两个长方形木块中的一个换为三角形木块,检测各小鼠5 min内,对两个物体的探索时间,并分析其新物体识别指数。
1.4.3.3 Y迷宫 Y迷宫由三条臂组成,每条臂长40 cm、宽5 cm、高10 cm,它们与中心点成120°角,按顺时针顺序将三条臂分别标记为A、B、C,在每条臂中贴上不同形状的图形作为标记。将小鼠从A臂末端放入,让其自由活动8 min,手动记录小鼠进入每条臂的顺序,统计其连续交替次数,如ABC、CAB和最大交替次数(总交替次数-2),计算其自主交替次数,将进入总臂数不足8的小鼠排除。
1.4.4固蓝(luxol fast blue,LFB)染色 小鼠进行完行为学测试后,用水合氯醛(400 mg·kg-1)腹腔注射麻醉,PBS灌流取脑,多聚甲醛固定,石蜡包埋,将包埋的脑组织胼胝体部位切为4 μm的石蜡切片用于LFB染色。将石蜡切片置于二甲苯中15 min×2次进行脱蜡,乙醇梯度水化:100%乙醇5 min×2,90%、80%、70%、60%的乙醇各5 min,然后用双蒸水冲洗5 min。固蓝染液于60 ℃水浴锅中预热30 min,然后将切片置于固蓝染液中于60 ℃染色4 h。切片冷却至室温后,流水冲洗1 min,浸入70%乙醇中10 s。然后再次流水冲洗切片1 min,并浸入碳酸锂溶液1 min进行分化。重复以上步骤,直到背景为无色或浅蓝色,此时神经髓鞘呈亮蓝色。最后,将切片逆浓度脱水:80%、90%乙醇各2 min,100%乙醇2 min×2次,二甲苯3 min×2次进行脱水,随后用中性树脂封片。BX51正置光学显微镜下观察并拍摄图像,便于后续统计分析。
1.4.5尼氏染色 依照1.4.4中脱蜡和乙醇梯度水化流程进行操作,完成后将切片置于焦油紫染液中于60 ℃染色30 s。蒸馏水洗净染料后,将切片分别置于70%、80%、95%以及100%乙醇中脱水,再用二甲苯透化,中性树胶封片。BX51正置光学显微镜下观察并拍摄图像,便于后续统计分析。
1.4.6Western blot实验 小鼠进行完行为学测试后,用水合氯醛(400 mg·kg-1)腹腔注射麻醉,断头取脑,于冰上分离胼胝体部分,立即于-80 ℃冻存。提取胼胝体组织总蛋白,BCA试剂盒定量,用SDS-PAGE凝胶电泳,12%的分离胶分离MBP。转膜,5%BSA封闭2 h,根据目的蛋白分子量裁膜,随后加一抗(MBP,1 ∶1 000;β-actin,1 ∶5 000),4 ℃孵育过夜。然后TBST洗10 min×3次,加入相应二抗,常温孵育2 h,回收二抗,TBST洗10 min×3次。于Image Quant LAS-4000 min型化学发光成像仪成像,用ImageJ软件进行统计学分析。
1.4.7免疫荧光实验 将石蜡切片置于二甲苯中15 min×2次进行脱蜡,然后依照“1.4.4”进行乙醇梯度水化,再用双蒸水、PBS洗5 min。抗原修复冷却至室温后,PBS洗5 min×3次,后用0.5%的TritonX-100透化15 min,PBS洗5 min×3次。用免疫组化笔圈住脑片周围,滴加封闭液,室温封闭30 min。然后弃去封闭液,滴加一抗(MBP,1 ∶200;Olig2,1 ∶100),切片置于湿盒中4 ℃孵育过夜。d 2,复温30 min,PBST洗10 min×3次。加相应的二抗室温避光孵育2 h,PBST避光洗10 min×3次,甘油封片,透明指甲油固定四周。激光共聚焦显微镜下观察并拍摄图像,进行统计分析。

2 结果
2.1 体质量、CBF值变化实验造模后1~3 d内,与Sham组相比,BCAS模型组和给药组小鼠体质量明显下降(Fig 1A),在d 7~30内体质量明显上升,达到初始水平,而BCAS模型组小鼠与给药组小鼠间无显著性差异。动物进行手术后,立即检测其皮层CBF值,发现Sham组小鼠CBF值下降为术前的98.73%±6.65%,30 d内CBF值无明显波动,BCAS模型组小鼠CBF值下降为术前的55.13%±3.5%,30 d内CBF值逐渐上升,最终恢复为初始的80.48%±5.71%(Fig 1B)。

Fig 1 Effect of ginsenoside Rg1 on body weight and CBF values of mice induced by BCAS during treatment stage (n=7-9)
2.2 Rg1对脑白质损伤小鼠运动协调和认知能力的影响
2.2.1爬杆实验 爬杆检测结果(Fig 2A)表明,与Sham组相比,BCAS模型组的小鼠爬杆所用时间明显延长,说明其运动协调能力下降,与BCAS模型组相比,盐酸多奈哌齐和人参皂苷Rg1治疗后,小鼠爬杆时间明显降低,与BCAS模型组相比差异有显著性,说明盐酸多奈哌齐和人参皂苷Rg1能够改善脑白质损伤引起的行为学障碍。

Fig 2 Effect of ginsenoside Rg1 on movement coordination and cognitive ability in BCAS mice
2.2.2新物体识别实验 新物体识别实验被广泛用于评价动物的学习记忆能力[5],新物体识别实验结果(Fig 2B)表明,与Sham组比较,BCAS模型组小鼠新物体识别指数明显降低,认知能力严重受损。而给予盐酸多奈哌齐和人参皂苷Rg1治疗后,小鼠新物体识别指数与BCAS模型组相比差异有显著性,认知能力得到明显改善。
2.2.3Y迷宫实验 Y迷宫实验模型用来研究啮齿类动物的空间识别记忆能力,这种迷宫利用了啮齿类动物对新异环境天然探究的自然习性,不需要动物学习任何规则来趋利避害,能够有效地反映出动物对新异环境的识别记忆能力[6]。Y迷宫的实验结果(Fig 2C)表明,与Sham组相比,BCAS模型组的小鼠自主交替次数明显减少,空间记忆能力明显下降,与Sham组相比差异有显著性,而给予盐酸多奈哌齐和人参皂苷Rg1治疗的小鼠,其自主交替次数增加,与BCAS模型组相比差异有显著性,表明阳性药盐酸多奈哌齐和人参皂苷Rg1能改善脑缺血引起的脑白质损伤,提高空间记忆能力。
2.3 Rg1对脑白质损伤小鼠髓鞘的影响
2.3.1LFB染色 LFB染色常用来检测髓鞘的形态结构和病理损伤[7]。Sham组的小鼠胼胝体髓鞘致密,颜色深,而BCAS造模的小鼠,其胼胝体髓鞘疏松,颜色浅,大部分崩解且呈空泡状(Fig 3A),经统计比较,两组IOD(integrated optical density,IOD)值(Fig 3B)有显著性差异,而给予盐酸多奈哌齐和人参皂苷Rg1治疗后,其髓鞘明显颜色加深,排列致密,崩解和空泡状减少,与模型组相比差异有显著性,说明人参皂苷Rg1能有效改善髓鞘损伤。
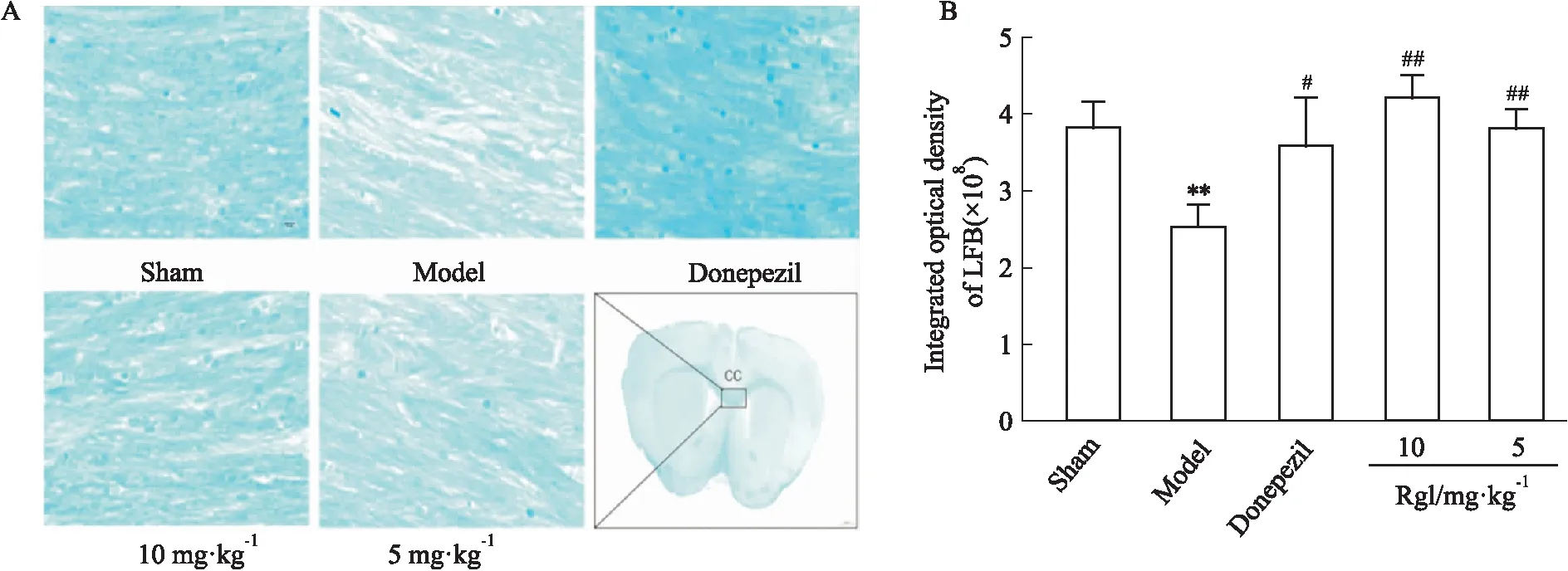
Fig 3 Effect of ginsenoside Rg1 on pathological changes in BCAS mice
2.3.2Nissl染色 Sham组小鼠的胼胝体神经元Nissl+细胞数量较多,尼氏小体颜色深,细胞核完整,而BCAS模型组小鼠的胼胝体神经元Nissl+细胞数明显减少,且细胞核固缩,尼氏小体色浅(Fig 4A)。在给予盐酸多奈哌齐和人参皂苷Rg1给药治疗后,小鼠胼胝体神经元Nissl+细胞数有明显增加(Fig 4B),细胞核固缩程度减弱,尼氏小体颜色加深,与模型组相比差异有显著性,说明人参皂苷Rg1对脑白质神经元损伤有明显的改善作用。

Fig 4 Effect of ginsenoside Rg1 on pathological changes in BCAS mice
2.4 Rg1对髓鞘碱性蛋白MBP表达水平的影响
2.4.1Western blot MBP是检测髓鞘结构完整性最常用的标记蛋白之一[8]。Western blot检测结果(Fig 5A,5B)表明,与Sham组相比,BCAS模型组MBP蛋白表达水平明显降低,两者相比差异有显著性,而给予盐酸多奈哌齐和人参皂苷Rg1治疗的小鼠其MBP蛋白水平相比BCAS模型组升高,与其相比差异有显著性。说明人参皂苷Rg1能明显提高MBP蛋白表达水平,对脑白质损伤引起的髓鞘脱落有明显的治疗作用。

Fig 5 Effect of ginsenoside Rg1 on expression of MBP
2.4.2免疫荧光 免疫荧光实验结果(Fig 6A,6B)表明,BCAS模型组小鼠的MBP荧光强度明显降低,与Sham组相比,两者差异有显著性,而给予盐酸多奈哌齐和人参皂苷Rg1治疗的小鼠,其MBP的荧光强度有明显的提高,与BCAS模型组相比差异有显著性,说明人参皂苷Rg1能够明显促进MBP蛋白的表达,改善脑缺血引起的脑白质损伤。
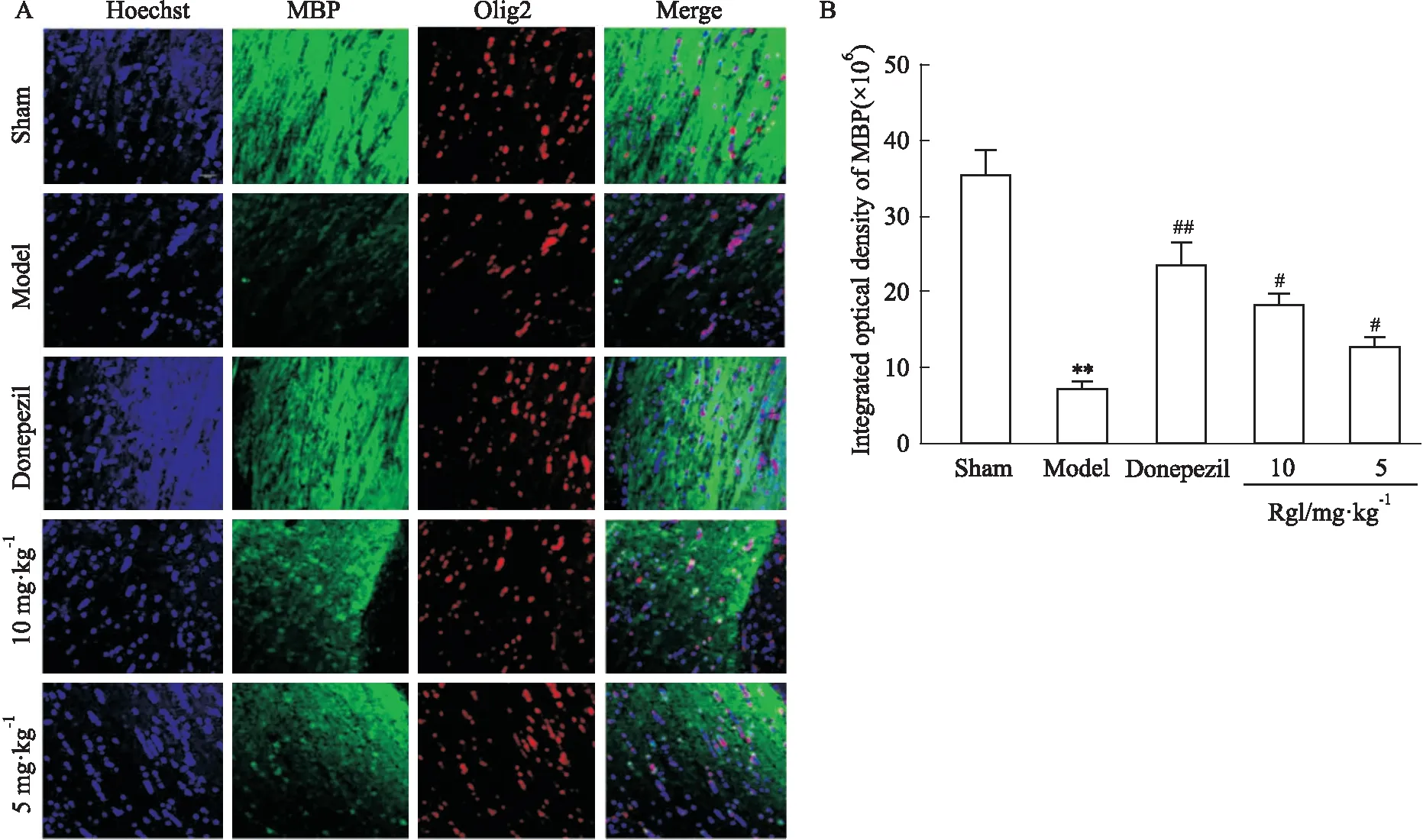
Fig 6 Effect of ginsenoside Rg1 on expression of MBP
3 讨论
目前许多研究都表明,在大脑缺血/缺氧的情况下,脑白质会受损[9],从而影响其对神经信号的传导作用。Shibata等[4],Wang等[10]都通过双侧颈总动脉狭窄手术建立了成功的慢性脑缺血白质损伤模型,我们也基于此,建立了BCAS模型,其CBF值指标与文献报道的一致,在术后动物皮层CBF血流值降低为初始的55.13%±3.5%[11],证明模型建立成功。BCAS模型操作简单易重复,不损伤小鼠眼动脉,避免了对小鼠行为学的测试结果的干扰。相对于传统饲料喂养和2VO的造模方式,有极大的优势,对药物的评价结果也更为准确。目前髓鞘损伤后的修复成为治疗脑白质损伤主要手段,现代研究证明[12-15],人参具有增强机体免疫力、改善学习记忆和心脑血管疾病的作用,且本课题组也已证明人参主要成分人参皂苷Rg1能够改善急性脑缺血造成的神经损伤[3],而对于人参皂苷Rg1能否改善慢性脑缺血造成的白质损伤尚未及进行深入研究。盐酸多奈哌齐已被证明对脑缺血/再灌注损伤有很好的神经保护作用[16],所以我们选用盐酸多奈哌齐作为阳性药进行治疗。在给予药物治疗后,发现各治疗组小鼠的CBF值差异无显著性,说明人参皂苷Rg1对小鼠的CBF值影响不大,与已有研究的结果一致。行为学测试结果表明,人参皂苷Rg1明显提高了小鼠的物体识别和自主活动能力,明显改善了小鼠因脑白质损伤导致的认知障碍和运动失调。胼胝体连接左右大脑半球,通常是检测脑白质损伤的代表性部位[17],LFB染色和尼氏染色结果表明,人参皂苷Rg1组能明显改善胼胝体已损伤髓鞘的空泡状结构,减弱髓鞘的疏松度,增加Nissl+神经元的表达,对髓鞘损伤有明显的修复作用。少突胶质细胞是中枢神经系统的成髓鞘细胞,少突胶质前体细胞在髓鞘损伤后会迁移到受损部位,进而分化成为成熟的少突胶质细胞形成髓鞘,改善脑白质的损伤,Oligo2是少突胶质细胞谱系特殊标志物,通过Western blot和免疫荧光实验,我们检测到人参皂苷Rg1组能明显促进MBP和Olig2的表达,维持髓鞘的完整性。本实验的行为学和病理学检测结果都表明,人参皂苷Rg1 10 mg·kg-1的剂量比5 mg·kg-1的改善效果要好。
综上,人参皂苷Rg1能明显改善因慢性脑缺血造成的脑白质损伤。本研究为人参皂苷Rg1研究脑白质损伤提供了理论依据,为治疗脑白质损伤的研究提供了备选药物,但其改善的作用机制尚需进行深入研究。

