基于酶活性丹参茎叶散剂活血活性谱—效模型研究
杨 慧,张 佳,钟林江,戴 静,郭晓恒
(1.江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004;2.成都大学 食品与生物工程学院,四川 成都 610106;3.成都大学 四川抗菌素工业研究所,四川 成都 610052;4.成都大学 基础医学院,四川 成都 610106;5.四川省抗病毒中药产业化工程技术研究中心,四川 成都 610106)
0 引 言
丹参为川产道地药材,常用于活血化瘀、行经止痛、凉血消痈等症状[1].其代表性物质为丹酚酸类水溶性成分和丹参酮类脂溶性成分[2-4].丹参的传统用药部位(根及根茎)仅占丹参植株的33%,造成其茎叶资源的浪费[5-6].课题组前期研究表明,丹参茎叶与丹参在化学成分方面相似[7-8],为扩大丹参资源利用率,进行丹参茎叶散剂的开发研究.中药谱—效关系研究已逐渐成为中药研究的一个重要内容[9].随着现代计算机信息技术日益成熟,数学统计分析方法逐渐科学化,易于构建科学合理的谱—效模型.纤维蛋白原平板法原理是底物经水解作用将纤维蛋白原水解成透明的纤维蛋白,根据透明圈面积与活血活性的量效关系进行评判.本研究通过建立丹参茎叶散剂的HPLC特征图谱,并采用纤维蛋白原平板法测定其体外活血活性值,将特征峰与其体外活血活性进行相关性分析,建立谱—效模型,以实现对药效作用的预测和评价,为其临床的应用提供基础.
1 材 料
1.1 仪 器
iChrom P5100型高效液相色谱仪(大连依利特分析仪器有限公司),SQP型1/10万电子分析天平(赛多利斯科学仪器北京有限公司),PS-40型超声波清洗器(深圳深华泰超声洗净设备有限公司),JJ-CJ-2FD型洁净工作台(苏州金净净化设备科技有限公司),DH系列电热恒温培养箱(西安禾普生物科技有限公司).
1.2 材 料
尿激酶(批号,170609),购自丽珠集团丽珠制药厂;凝血酶(批号,201701107)、牛血纤维蛋白原(批号,F20180302),购自上海经科化学科技有限公司;琼脂粉(批号,2017100101),购自成都市科隆化学品有限公司;迷迭香酸、丹酚酸B对照品(批号分别为wkq17010504、wkq17061901,质量分数均≥98%),均购自四川省维克奇生物科技有限公司.
丹参茎叶药材采自德阳市中江县,经成都大学郭晓恒副教授鉴定为唇形科植物丹参的茎和叶.
2 方法与结果
2.1 丹参茎叶散剂的制备
取丹参茎叶500 g,加入13.41倍水,冷凝回流提取2次,每次0.65 h,合并提取液,抽滤后经减压浓缩(80 ℃、0.085 MPa、47 r/min)至浓缩液相对密度为1.25~1.30(室温).按照浓缩液∶糊精质量比为4∶6混合均匀,经过减压干燥(65 ℃、0.085 MPa),粉碎,过2号筛,即得.
2.2 丹参茎叶散剂活血活性的测定
2.2.1 供试品溶液的制备
取丹参茎叶散剂约1 g,精密称定,置100 mL具塞锥形瓶中,精密加入纯化水20 mL,称定质量,超声处理(140 W,频率42 kHz)30 min,放冷,再称定质量,用纯化水补足减失质量,摇匀,滤过,取续滤液离心10 min(15 000 r/min),取上清液过0.45 μm水系微孔滤膜,即得.
2.2.2 纤维蛋白原平板的制备
取经灭菌后的培养皿,依次加入(85±5)℃的1%琼脂热溶液20 mL和0.3%的纤维蛋白原溶液15 mL,混匀,待冷却至温度为(30±2)℃时,加入20 U/mL凝血酶1mL,摇匀,静置30 min,待纤维蛋白原平板冷却凝固,在其表面打孔,备用.
2.2.3 阴性样品及对照品溶液的制备
取活性为100 000 U的尿激酶固体粉末1g,精密称定,置于100 mL棕色容量瓶中,采用生理盐水定容,即为每1 mL含1 000 U的储备液.分别稀释成浓度为每1 mL含50、100、200、300、400、500与600 U的尿激酶对照品溶液,备用.阴性样品即为纯化水和生理盐水.
2.2.4 标准曲线的绘制
取纤维蛋白原平板,依次点样对照品溶液25 μL,置于37 ℃恒温培养箱中静置16 h,取出,以测定的透明圈面积为纵坐标(Y),对照品溶液浓度为横坐标(X),拟合得线性方程为,Y=0.342 6X+182.21(r=0.998 6).
2.2.5 精密度
1)同板精密度.取纤维蛋白原平板,分别进行同板点样300 U/mL的对照品溶液25 μL(n=6),置于37 ℃恒温培养箱静置16 h,取出,游标卡尺测定透明圈面积大小,计算RSD为3.7%.
2)异板精密度.取纤维蛋白原平板(n=6),分别进行异板点样300 U/mL的对照品溶液25 μL,置于37 ℃恒温培养箱静置16 h,取出,游标卡尺测定透明圈面积大小,计算RSD为4.2%.
2.2.6 重复性
取丹参茎叶散剂粉末适量,按“2.2.1”项方法平行制备供试品溶液(n=6),取纤维蛋白原平板,依次点样供试品溶液、300 U/mL对照品溶液与阴性样品各25 μL,置于37 ℃恒温培养箱中静置16 h,游标卡尺测定透明圈面积,计算活血活性值,RSD为4.8%.
2.2.7 稳定性
取丹参茎叶散剂粉末适量,按“2.2.1”项方法制备供试品溶液,取纤维蛋白原平板,分别于0、0.5、1、1.5、2与2.5 h后点样供试品溶液、300 U/mL对照品溶液与阴性样品各25 μL,置于37 ℃恒温培养箱静置16 h,游标卡尺测定透明圈面积,计算活血活性值,RSD为5.3%.
2.2.8 加样回收率
取活血活性值为3 065 U/g丹参茎叶散剂粉末约0.5 g(n=6),精密称定,置于具塞锥形瓶中,分别精密加入浓度为150 U/mL的对照品溶液和纯化水各10 mL,照“2.2.1”项下制备供试品溶液.分别取纤维蛋白原平板,依次点样供试品溶液、300 U/mL对照品溶液与阴性样品各25 μL,置于37 ℃恒温培养箱静置16 h,取出,游标卡尺测定透明圈面积,计算活血活性平均回收率为83.2%,RSD为6.7%.
上述研究表明方法学符合相关技术要求,阴性样品无干扰.
2.2.9 活血活性值测定
分别取丹参茎叶散剂粉末约1 g,精密称定,按“2.2.1”项方法制备6批供试品溶液,取纤维蛋白原平板,依次点样供试品溶液、300 U/mL对照品溶液与阴性样品各25 μL,置于37 ℃恒温培养箱静置16 h,游标卡尺测定透明圈面积,计算6批丹参茎叶散剂活血活性值,详见表1.

表1 6批丹参茎叶散剂活血活性值
2.3 丹参茎叶散剂特征图谱的构建
2.3.1 供试品溶液的制备
取丹参茎叶散剂粉末约1 g,精密称定,置于100 mL具塞锥形瓶中,精密加入纯化水20 mL,称定质量,超声处理(140 W,频率42 kHz)30 min,放冷,再称定质量,用纯化水补足减失质量,摇匀,滤过,取续滤液离心10 min(15 000 r/min),取上清液过0.45 μm水系微孔滤膜,即得.
2.3.2 对照品溶液的制备
分别取迷迭香酸与丹酚酸B对照品适量,精密称定,置于棕色量瓶中,加甲醇制成每1 mL含迷迭香酸125 μg,丹酚酸B 50.72 μg的单一对照品溶液.
2.3.3 色谱条件
色谱柱为Supersil ODS2色谱柱(5 μm,250 mm×4.6 mm).流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱:0~10 min,12%~12%A;10~20 min,12%~14%A;20~36 min,14%~24%A;36~50 min,24%~22%A;50~65 min,22%~38%A;65~70 min,38%~12%A;70~75 min,12%~12%A.柱温30 ℃,流量1.0 mL/min,进样量10 μL,检测波长280 nm.
2.3.4 精密度
取丹参茎叶散剂粉末约1 g,精密称定,按照“2.3.1”项方法制备供试品溶液和“2.3.3”项色谱条件,分别对供试品溶液重复进样分析6次,计算各共有峰相对峰面积RSD<1.8%,相对保留时间RSD<1.5%,结果表明仪器精密度良好.
2.3.5 稳定性
取丹参茎叶散剂粉末约1 g,精密称定,按照“2.3.1”项方法制备供试品溶液和“2.3.3”项色谱条件,分别于0、4、8、12、16与24 h进样分析,计算各共有峰相对峰面积RSD<4.1%,相对保留时间RSD<2.2%,结果表明供试品在24 h内稳定性良好.
2.3.6 重复性
取丹参茎叶散剂粉末约1 g,精密称定,按照“2.3.1”项方法平行制备6份供试品溶液,按照“2.3.3”项色谱条件进样分析,计算各共有峰相对峰面积RSD<4.23%,相对保留时间RSD<3.1%,结果表明供试品制备方法重复性良好.
2.3.7 特征图谱的构建
取6批丹参茎叶散剂粉末适量,按照“2.3.1”项方法平行制备供试品溶液,按照“2.3.3”项色谱方法进行测定.将所得各批成品特征色谱图采用“中药色谱特征图谱相似度评价系统(A版)”进行处理,详见图1.经系统拟合得到对照特征图谱,详见图2,确定9个共有特征峰,通过丹酚酸B和迷迭香酸单一对照品进行指认,鉴定出7号峰为迷迭香酸,9号峰为丹酚酸B.供试品溶液、丹酚酸B对照品、迷迭香酸对照品以及空白溶液叠加图谱,详见图3.

图1 6批丹参茎叶散剂HPLC叠加特征图谱
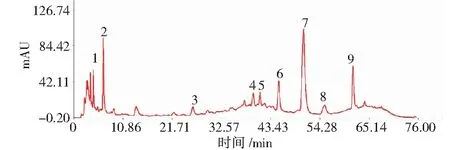
图2 丹参茎叶散剂HPLC对照特征图谱
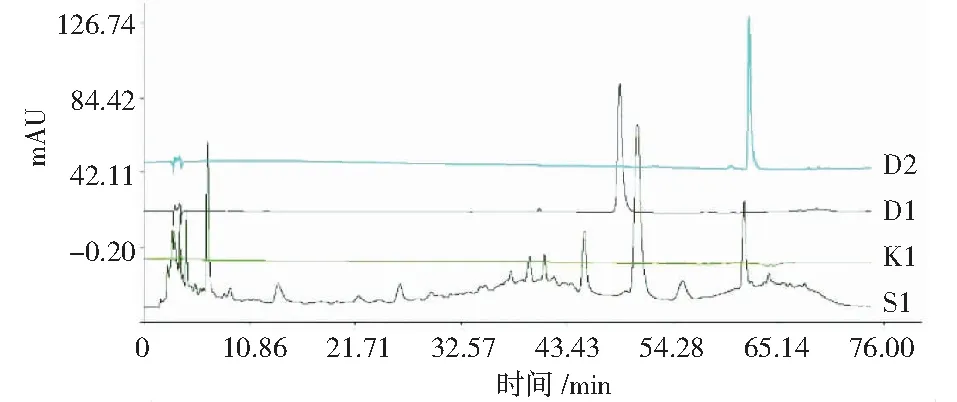
S1-供试品,K1-空白,D1-迷迭香酸对照品,D2-丹酚酸B对照品
2.4 谱—效分析
2.4.1 主成分分析和相关性分析[10]
采用“SPSS”中“Reduction”组的“Factor”分析其主成分数目,由主成分分析解释总方差表2可知,第6位及以后主成分解释数据变异的总比例为100%,且碎石图在成分数5之后具有平缓趋势,详见图4所示,基于此,该分析模型的最优主成分数为5.再由Spearman相关性分析确定主成分特征峰,Spearman分析中各共有峰峰面积活血活性相关性强弱见表3.优选相关性较强的5个特征峰,优选3、4、5、7、8号特征峰与活血活性构建谱—效模型.
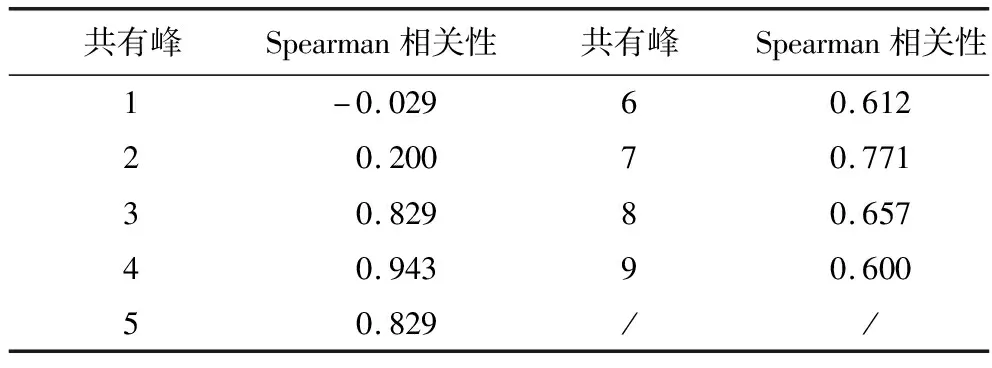
表3 各共有特征峰活血活性相关性强弱

图4 碎石图
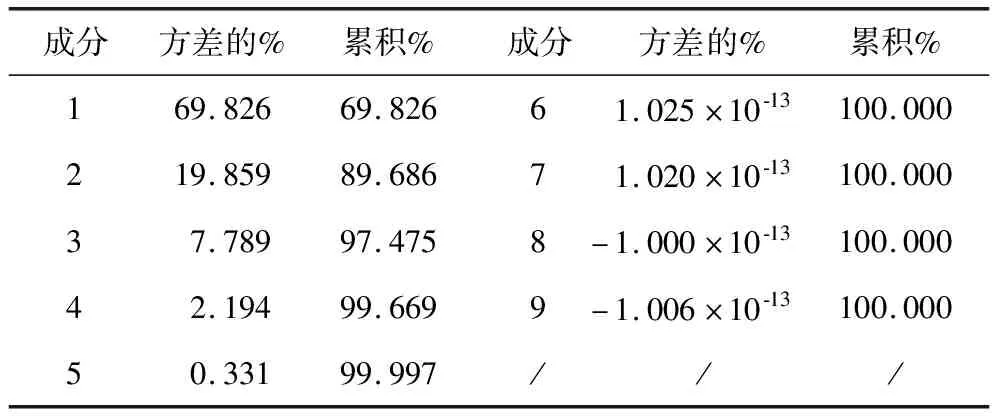
表2 主成分分析解释的总方差
2.4.2 多重线性回归分析[11]
运用“SPSS”中“Regression”组的“Linear”法,对峰3、4、5、7(迷迭香酸)、8与活血活性值进行线性拟合,以特征峰峰面积为横坐标(X),活血活性值为纵坐标(Y),采用多重线性回归分析,建立其谱—效模型,回归方程表示为,Y=0.269X峰3+0.008X峰4+0.244X峰5-0.024X峰7-0.051X峰8+64.506(r=0.999 6).
2.5 丹参茎叶散剂谱—效评价模型的验证
为验证已建立谱—效评价模型的适用性及准确性,另取6批丹参茎叶散剂,采用HPLC测定其特征图谱3、4、5、7、8号峰面积,带入谱—效模型,得到其活血活性预测值.采用纤维蛋白原平板法测定其体外活血活性测量值.预测值及测量值,详见表4.
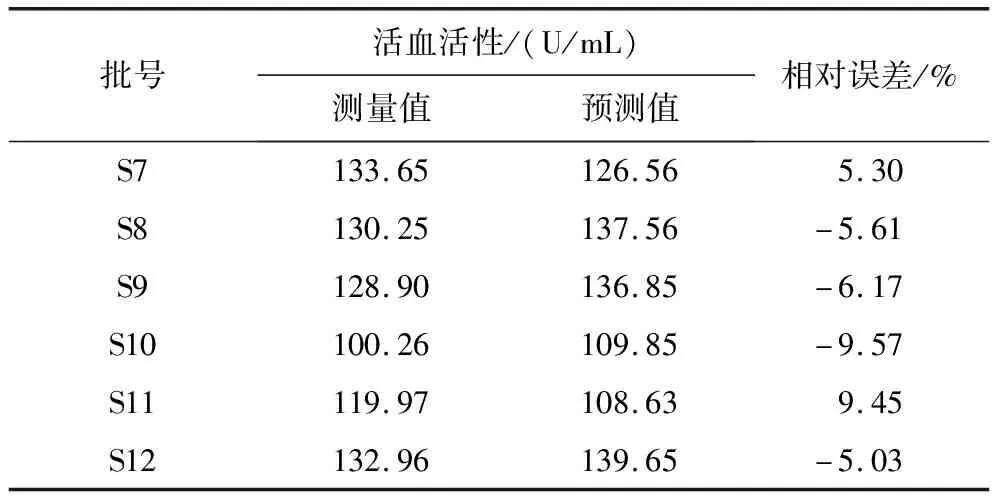
表4 丹参茎叶散剂活血活性的预测值和测量值
由表4可知,丹参茎叶散剂活血活性谱—效模型预测值与测量值的相对误差较小,表明所建立的谱—效模型可较好地评价丹参茎叶散剂的活血活性值.
3 讨 论
HPLC特征图谱逐渐成为评价中药整体质量的一种方式,但其一般只能从“模糊”的角度控制相对出峰时间、相似度与相对峰面积等指标,虽然可以定性对药品的均匀性进行表征,但并不能控制药物“有效性”的属性,本研究在建立丹参茎叶散剂HPLC特征图谱基础上,通过数学公式拟合丹参茎叶散剂的内在化学成分群与活血活性的相关性方程,建立其谱—效模型,达到快速预测其体外活血活性的目的.经相关性分析阐述了内在化学成分群对活血活性的密切程度及作用方向,即协同和拮抗作用,采用丹酚酸B和迷迭香酸对照品对特征峰进行指认,进一步评价丹参茎叶散剂HPLC特征峰,以期实现用药品质量标准表征药品临床疗效的目标.
在进行谱—效分析时,经主成分分析和Spearma分析时,峰1对谱—效模型虽然不是主成分,但对活血活性却显负相关作用,现还未知峰1是何种成分.峰2、3、4、5、6、7(迷迭香酸)、8与9(丹酚酸B)对活血活性显正相关,文献表明迷迭香酸具有活血活性的药理活性[12].Lee等[13]由实验证明丹酚酸B可抑制动脉粥样硬化,表明丹酚酸B可有效抑制血小板的凝血活性,本研究结果与相关文献报道一致.现还未知峰1、2、3、4、5、6与8是何种物质,本课题下一步将采用液—质连用技术对其成分进行研究,探究其对活血作用的关系.
中药作为一个极其复杂的化合物体系,通过以上分析,其发挥治疗作用可能是几种成分互相作用的结果,正符合中药“多成分,多靶点”的特点.本研究以主成分分析、相关性分析和多重线性回归分析3种方法对特征图谱色谱峰和活血活性值进行谱—效分析,经降维与相关性研究后,将相关性强的主成分和活血活性进行线性回归,线性方程相关系数为0.999 6,验证实验中,预测值与测量值相对误差不大,表明本研究建立的丹参茎叶散剂谱—效模型可较好地预测其体外活血活性.

