三酰甘油-葡萄糖指数与急性缺血性卒中神经功能缺损的相关性分析
黄妍,付学军,史会杰,邹良玉
随着社会经济的快速发展及人口老龄化,我国缺血性卒中的发生率逐年上升。目前我国卒中的患病率为1596.0/10万,是我国疾病所致全年龄组伤残调整生命年(disability adjusted life year,DALY)的首位原因[1]。胰岛素抵抗在急性缺血性卒中(acute ischemic stroke,AIS)患者中较常见,有研究提示,胰岛素抵抗可能通过促进动脉粥样硬化及血流动力学紊乱加快AIS的进展,且与AIS的不良功能预后独立相关[2-7]。三酰甘油-葡萄糖(triglyceride-glucose,TyG)指数被认为是一项简便、可靠的评估胰岛素抵抗的指标[8-9]。本研究通过对AIS患者的临床资料进行回顾性分析,探讨TyG指数与AIS患者神经功能缺损的相关性。
1 对象与方法
1.1 研究对象 连续纳入2021年1-5月于深圳市人民医院神经内科住院治疗AIS患者的临床资料,进行回顾性分析。
纳入标准:①缺血性卒中,诊断符合中华医学会制定的《中国急性缺血性脑卒中诊治指南2018》[10],且经头颅MRI证实存在新发梗死灶;②年龄≥18岁;③发病21 d内;④病历资料齐全,实验室检查指标完善。排除标准:①出血性脑血管病或混合性脑梗死;②其他神经系统器质性疾病,如脑外伤、脑炎、肿瘤等;③有严重的心脏、肝脏、肺脏和肾功能不全或严重感染;④发病后出现意识障碍而无法配合检查;⑤发病21 d内死亡。
1.2 研究方法
1.2.1 一般资料 根据住院病历记录,收集研究对象的年龄、性别、受教育程度等人口学资料,记录患者的既往病史,包括高血压、冠心病、糖尿病、高脂血症、高尿酸血症或痛风、吸烟、饮酒史等。
1.2.2 实验室检查资料 收集研究对象入院后24 h内空腹血清检测指标,包括hs-CRP、空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycated hemoglobin,HbA1c)、TG、TC、HDL-C、LDL-C、Hcy、尿酸(uric acid,UA)。计算TyG指数,计算公式为Ln[TG(mg/dL)×FPG(mg/dL)/2][11]。
1.2.3 神经功能缺损评估及分组 应用入院时NIHSS评估卒中后神经功能缺损严重程度,将患者分为无神经功能缺损组(NIHSS 0分)、轻度神经功能缺损组(NIHSS 1~4分)和中重度神经功能缺损组(NIHSS>4分)[12]。比较3组间人口学资料、既往病史及实验室检查指标等资料的差异。计算TyG指数预测神经功能缺损的效能,根据预测的最佳截断值将患者分为TyG指数≥最佳截断值的高TyG指数组和TyG指数<最佳截断值的低TyG指数组,比较2组间人口学资料、既往病史及实验室检查指标等资料的差异。
1.3 统计学分析 采用SPSS 20.0统计软件进行分析。计量资料先进行正态检验和方差齐性分析,符合正态分布的用表示,3组间比较采用单因素方差分析,2组间比较采用t检验;不符合正态分布的用M(P25~P75)表示,组间比较采用Kruskal-WallisH或Mann-WhitneyU参数检验。计数资料以频数(%)表示,组间比较采用χ2检验。采用Spearman等级相关分析人口学信息、既往病史及其他实验室检查结果与TyG指数之间的相关性。TyG指数对神经功能缺损的预测价值评价采用ROC曲线,计算AUC。以TyG指数为自变量,将单因素分析中P<0.10的指标为协变量,以是否存在神经功能缺损以及是否存在中重度神经功能缺损分别为因变量,采用二元logistic回归模型,计算TyG指数的OR值和95%CI,分析TyG指数对神经功能缺损的影响。以P<0.05为差异有统计学意义。
2 结果
研究共入组符合入组和排除标准的患者177例,年龄29岁~90岁,男性122例,平均62.3±11.7岁,女性55例,平均66.8±12.0岁。无神经功能缺损组43例、轻度神经功能缺损组85例,中重度神经功能缺损组49例。
2.1 不同神经功能缺损组基线资料比较 无神经功能缺损组、轻度神经功能缺损组和中重度神经功能缺损组的糖尿病、高脂血症、HbA1c、FPG、TG、TC及TyG指数等指标的差异有统计学意义;年龄、性别、高血压、冠心病、高尿酸血症或痛风、吸烟、饮酒、hs-CRP、UA、HDL-C、LDL-C及Hcy等指标的差异无统计学意义(表1)。
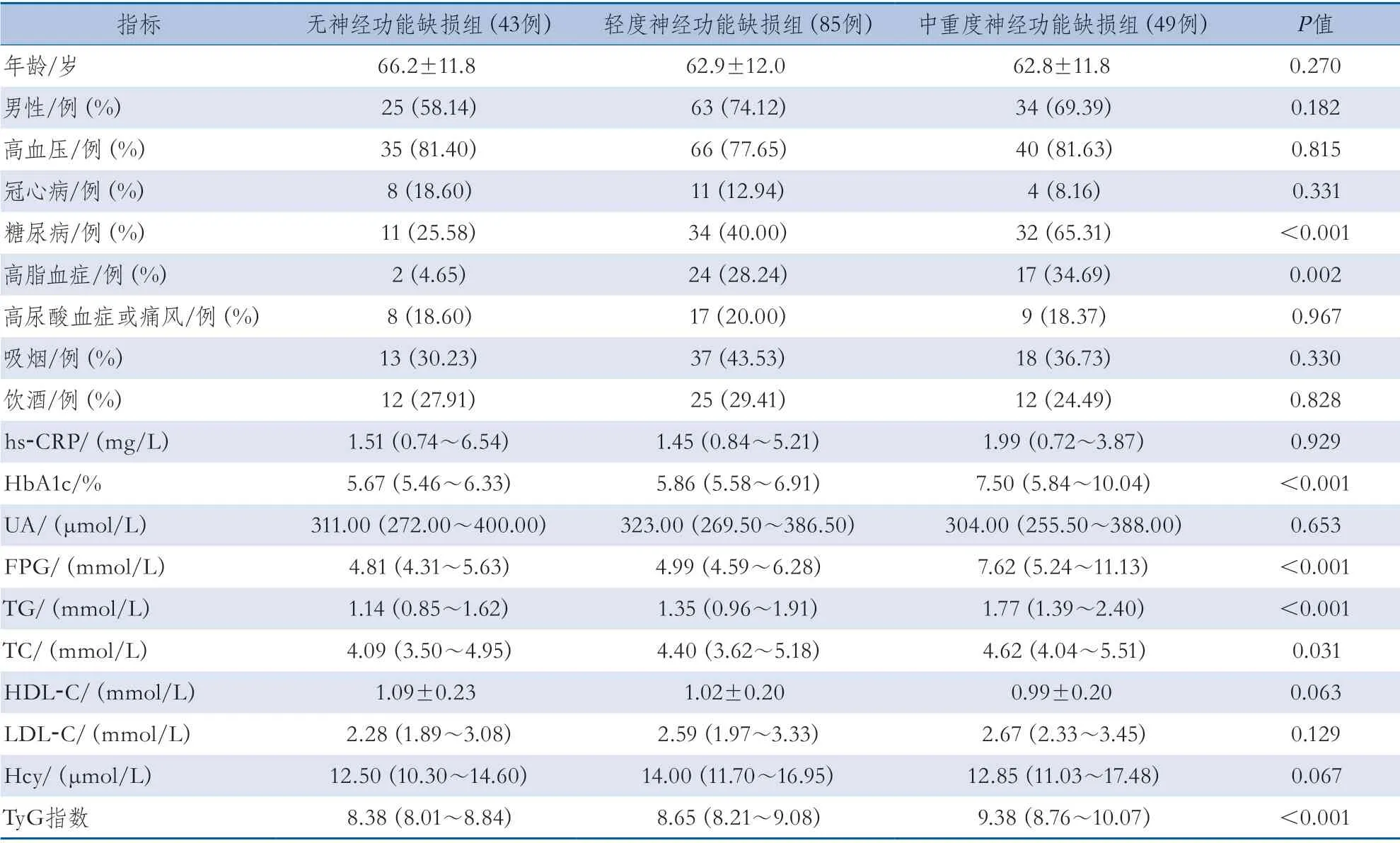
表1 不同神经功能缺损组基线资料比较
2.2 TyG指数与卒中危险因素及NIHSS的相关性分析 在入组的AIS患者中,TyG指数与糖尿病、高脂血症、HbA1c、FPG、TG、TC、LDL-C及入院NIHSS呈正相关;与年龄、HDL-C呈负相关;与性别、高血压、冠心病、高尿酸血症或痛风、吸烟、饮酒、hs-CRP、UA及Hcy等指标无相关性(表2)。
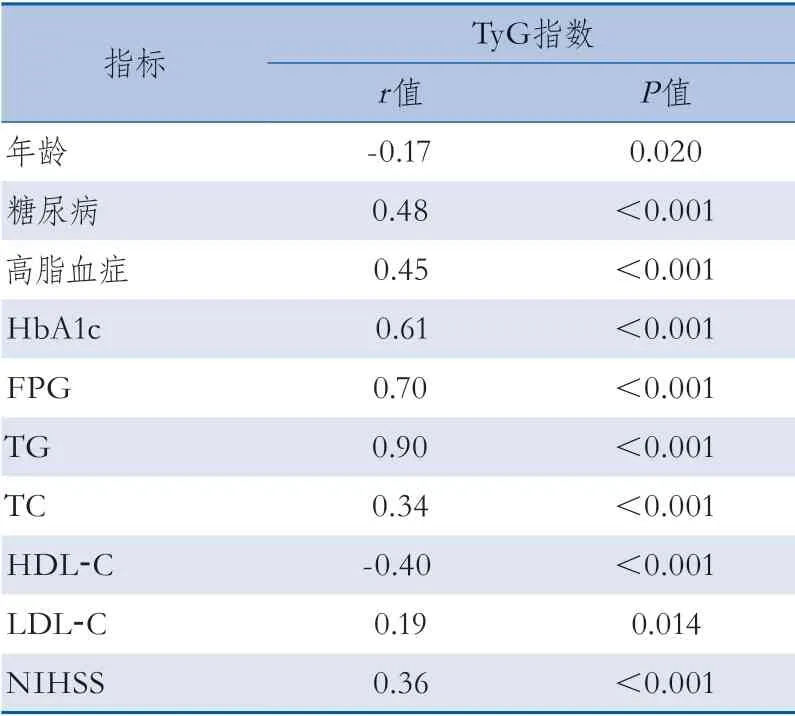
表2 TyG指数与卒中危险因素及NIHSS的相关性分析结果
2.3 TyG指数预测神经功能缺损严重程度的效能以TyG指数为检测变量,以是否存在神经功能缺损(NIHSS≥1分)作为结局变量进行ROC曲线分析,结果显示AUC为0.70(95%CI0.62~0.79,P<0.001),TyG指数预测神经功能缺损的最佳截断值为8.55,敏感度为69.4%,特异度为62.8%(图1)。

图1 TyG指数预测神经功能缺损效能的ROC曲线
2.4 不同TyG指数组基线资料比较 177例患者中,高TyG指数(≥最佳截断值)组109例,低TyG指数(<最佳截断值)组68例。高TyG指数组年龄低于低TyG指数组,高血压、糖尿病和高脂血症的比例高于低TyG指数组,入院NIHSS分值和中重度卒中比例高于低TyG指数组,HbA1c、FPG、TG、TC水平高于低TyG指数组,HDL-C水平低于低TyG指数组,差异有统计学意义,其余指标的差异无统计学意义(表3)。
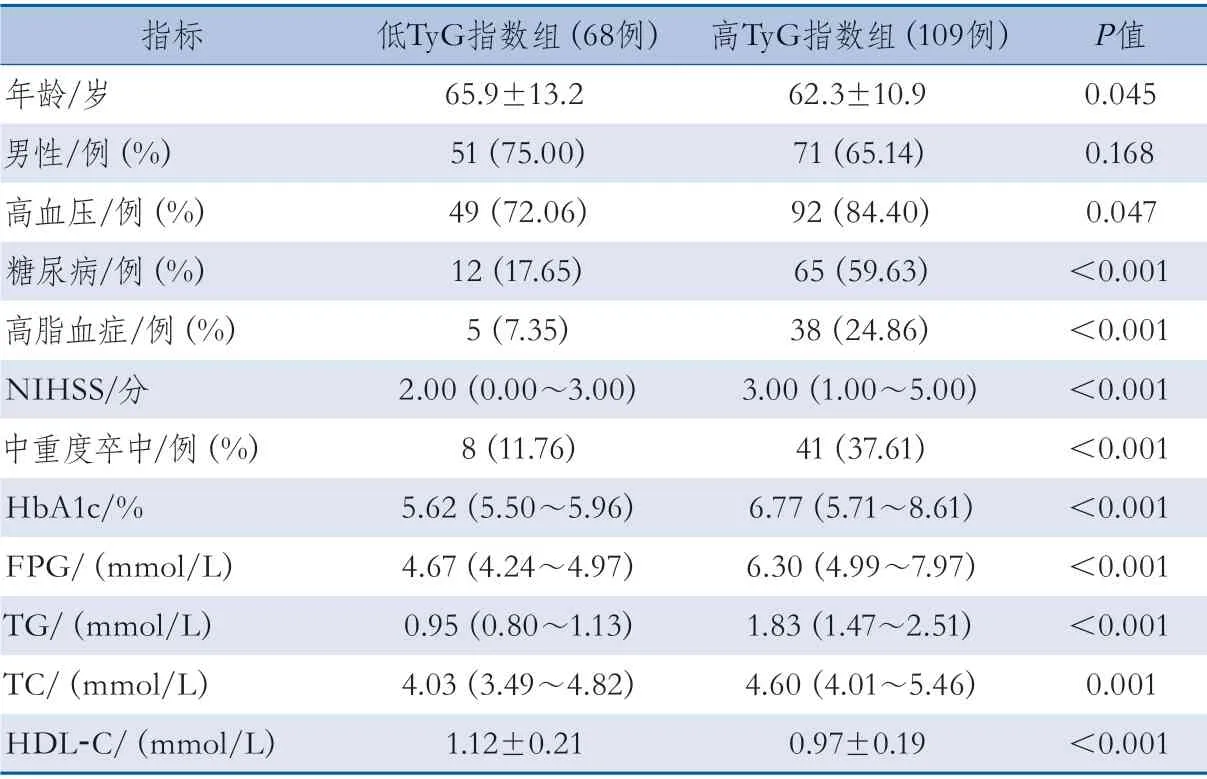
表3 高TyG指数与低TyG指数组基线资料比较结果
2.5 TyG指数影响神经功能缺损严重程度的多因素分析 以AIS患者是否发生神经功能缺损为因变量(NIHSS 0分赋值为0,NIHSS≥1分赋值为1),自变量为TyG指数,进行logistic回归分析发现,OR值为3.03(95%CI1.79~6.11,P<0.001),即在AIS患者中,TyG指数每增加1,发生神经功能缺损的风险增加2.03倍。
以AIS患者是否发生中重度神经功能缺损为因变量(NIHSS≤4分赋值为0,NIHSS>4分赋值为1),自变量为TyG指数,logistic回归分析显示,OR值为5.72(95%CI3.12~10.45,P<0.001),即在AIS患者中,TyG指数每增加1,发生中重度神经功能缺损的风险增加4.72倍。
3 讨论
AIS具有高发病率、高致残率、高死亡率和高复发率的特点,是我国成年人致死和致残的首位因素[1]。AIS的传统危险因素包括高血压、糖尿病、血脂异常、冠心病、吸烟及酒精摄入等,这些危险因素多与代谢综合征有关,可以解释94.3%的卒中病因。代谢综合征被认为是心脑血管病变的病理基础,而胰岛素抵抗是其中心环节[13]。胰岛素抵抗已被证实与AIS相关[2],但其是否与神经功能缺损严重程度相关尚存在争议[7,9]。目前TyG指数已被证实在识别胰岛素抵抗方面具有很高的敏感度(96.5%)和特异度(85.0%),是评估胰岛素抵抗的可靠指标[8,14],探讨TyG指数与AIS后神经功能缺损程度之间的关系,有助于识别高危人群,预防中重度卒中。
本研究发现,在AIS患者中,TyG指数与神经缺损程度呈正相关,TyG指数每增加1,发生神经功能缺损的风险性增加2.03倍,发生中重度神经功能缺损的风险性增加4.72倍,表明胰岛素抵抗会加重AIS后神经功能缺损的发生与发展。与以往研究不同,本研究关注了NIHSS评分为0分、头颅MRI提示存在明确新发梗死灶的患者,这类患者存在神经系统病损,但是不存在神经系统功能的明显缺损,整体预后良好。回顾该组患者资料,患者多以“头晕”“头痛”为主诉,但这些症状无神经系统定位意义,传统神经系统查体无阳性发现。与既有神经系统病损,又有神经功能缺损的患者(NIHSS>0分)相比,这类患者的特征对于AIS的预防与治疗更具有临床意义。
胰岛素在正常情况下可促进胆固醇转运至动脉平滑肌细胞,降低脂质斑块的分解退化,并通过增加NO介导血管舒张及通过内皮素-1调节血管收缩。当发生胰岛素抵抗时,NO产生减少,内皮素-1活性增加,引起氧化应激、炎症级联反应和早期动脉粥样硬化,最终减少新生毛细血管和微血管血流[15-16]。除此之外,胰岛素抵抗可能通过改变脂肪的转运和分泌炎症介质引起持续性的慢性炎症,导致血管功能障碍。在大脑中,血管收缩和毛细血管扩张减少可能会干扰神经元的功能[17]。当发生AIS时,脑内产生与胰岛素抵抗相关的促炎细胞因子,在胰岛素抵抗患者中,可能增强局部炎症反应和促血栓形成反应,从而加剧脑缺血损伤[7]。胰岛素抵抗还可能导致缺血半暗带的循环不良,引起溶栓后持续性动脉闭塞[16,18]。同时,胰岛素抵抗的患者易出现高血糖,高血糖可增加血脑屏障的通透性,引起脑水肿,造成神经细胞损伤,还对血管内皮细胞有直接毒性损伤作用,导致出血转化及再灌注损伤的风险增加,进而对AIS患者的神经功能造成损害[19-21]。AIS发生后,胰岛素抵抗除了加重颅内血管神经损伤外,还会导致肌肉分解代谢,引起肌肉瘫痪,进一步加重功能不良[7]。本研究ROC曲线分析表明,TyG指数水平≥8.55时,对识别有无神经功能缺损有一定的临床价值,为将胰岛素抵抗作为预防AIS神经功能缺损的治疗靶点提供了新的思路。
与低TyG指数组相比,高TyG指数组患者中糖尿病、高脂血症及高血压比例较高,FPG、HbA1c、TG、TC较高,HDL-C水平较低。胰岛素抵抗可以通过肾脏潴钠、激活交感神经系统及改变离子(钠离子和钙离子)的转运等途径引起血压升高,而高血压可通过改变向骨骼肌细胞输送胰岛素和葡萄糖的方式引起胰岛素抵抗[22]。高血糖既引起胰岛素受体β亚单位酪氨酸磷酸化程度降低,又导致磷脂酰肌醇-3-激酶降低,从而造成胰岛素抵抗。HbA1c与FPG共同反映糖尿病患者的血糖控制水平。研究表明,FPG的异常升高会促进AIS的发生与发展,血糖水平与AIS功能不良的风险正相关,显著增加卒中后神经功能缺损的风险[7,23],与本研究结果相一致。此外,脂代谢异常亦会引起胰岛素抵抗。高TG、高TC、低HDL-C及高LDL-C为特点的血脂代谢紊乱会干扰胰岛素受体与葡萄糖转运体的级联连接,损害胰岛细胞的正常功能,导致胰岛素抵抗的发生[24]。且TG、TC、HDL-C、LDL-C为炎症的重要调节因子,可介导炎症反应,胰岛素抵抗引起的慢性炎症反应也加剧了血脂的代谢异常。因此,TyG指数可能反映了高血压、高血糖及高血脂等因素的综合效应。在临床工作中,可通过TyG指数水平对AIS患者进行管理,对于胰岛素抵抗高危风险的患者,必要时可采取适当措施进行干预以预防AIS后严重的神经功能缺损发生。
本研究的不足之处在于,第一,本研究为单中心的横断面回顾性研究,样本量较小,无法明确因果关系,未来需要更多纵向研究进一步确定AIS患者发生神经功能缺损与TyG指数的关系;第二,观察指标(如FPG、LDL-C等)在患者入院前受到各种干预措施(如药物)的影响,研究中未能对其进行控制;第三,发生AIS后产生的应激反应可干扰血糖及血脂代谢,可能并不能代表患者发病前的实际TyG稳态值。
【点睛】本研究提示TyG指数与AIS患者是否出现神经功能缺损及神经功能缺损的严重程度有关,是潜在且简单易获得的预测AIS神经功能缺损程度的临床指标。

