天然辣椒碱类物质对朱砂叶螨杀螨活性的影响
倪 婧,谢道燕,杨振国,柴建萍,江秀均
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661100)
【研究意义】朱砂叶螨(T.cinnabarinusBoisduval)属蛛形纲(Arachnida)叶螨科(Tetranychidae)、叶螨属(Tetranychus)。分布于世界各地,其世代周期短,繁殖力强,危害32科110 余种植物[1],是世界农林生产上危害较重的害螨之一,长期使用化学农药导致残留(Residue)、抗性(Resistance)及害虫再猖獗(Resurgence)3R问题日益突出,目前已知朱砂叶螨对90多种化学活性成分产生较高的抗药性[2],研究天然、高效、低毒、对人畜无害的环境友好型生物杀螨剂非常必要。天然辣椒碱(Capsaicin),又名辣椒素,从辣椒的成熟果实中分离提取出来,命名为N-香草基-8-甲基-6-壬烯酰胺,分子式为C18H27NO3,相对分子质量为305.41,是香草基胺的酰胺衍生物,由14种以上的辣椒碱同系物组成,称辣椒碱类物质(Capsaiciniods),作为一种新型绿色环保型生物农药,具有良好的触杀、胃毒、驱避作用[3]。美国环保局早在1991年就将辣椒碱及其制品确定为生化农药,并免除其在水果、蔬菜和谷物等残留量的限制,因此以辣椒碱为基础原料的绿色杀螨剂在农林生产上具有十分广泛的应用前景。【前人研究进展】辣椒碱类物质在医药领域及提取工艺改进方面有较多研究和应用,在有害生物防控领域辣椒碱作为驱避剂,添加到电线、电缆等防护材料及滴灌带制作材料中防止老鼠、白蚁等啃咬破坏[4-5];还替代有毒的有机锡、有机氯等添加到防污涂料中,涂布于船舶、海上建筑物及海水养殖器具表面,能有效驱避藤壶、藻类、贝类、软体动物等海洋附着生物[6]。在农业病虫害防控领域,辣椒碱对芒果炭疽菌(Colletotrichumgloeosporioides)、三七根腐菌(Cylindrocarpondestructans)、番茄早疫菌(Alternariasolani)、番茄灰霉菌(Botrytiscinerea)、白菜黑斑菌(Alternariabrassicae)、玉米赤霉菌(Fusariumgraminearum)、尖孢镰刀菌(Fusariumoxysporum)等病原菌有不同程度的抑制作用[7]。辣椒碱田间推荐剂量300倍稀释液对桑褐斑病的最高防效为44.58%,而甲基硫菌灵1000倍稀释液最高防效仅为0.04%,辣椒碱有较好的抑菌作用,且对家蚕的生长发育、茧层量、健蛹重量等没有显著影响[8]。辣椒碱浓度大于8.0 mg/mL时,对赤拟谷盗和谷蠹均有较好的驱避、拒食作用[9]。辣椒碱对防治蚜虫(Aphidoidea)、小菜蛾(Xylostella)、粉虱(Aleyrodidae)、东方黏虫(Mythimnaseparata)、小绿叶蝉(Empoascaflavescens)、豆叶甲(Ceratomatrifurcata)、六点黄蜘蛛(Eotetranychussexmaculatus)、二斑叶螨(Tetranychusurticae)等也有研究[10-13]。但由于天然辣椒碱类物质对农业病虫害的防治速效性没有化学农药好,且特有的辛辣呛鼻气味对田间喷雾操作要求较高,故近年对生物农药领域应用研究报道较少。【本研究切入点】研究表明在安全剂量范围内其对家蚕的生长发育没有显著影响,可适用于桑园防控褐斑病[8],但该类物质对桑园朱砂叶螨杀螨活性及对谷胱甘肽S-转移酶、羧酸酯酶等解毒代谢酶活性影响的相关研究报道较少见,在桑园防控应用方面缺乏参考资料。【拟解决的关键问题】明确辣椒碱类物质对朱砂叶螨各发育阶段的杀螨效率及谷胱甘肽S-转移酶对其解毒代谢响应,为更好的利用、开发以辣椒碱类物质为基础原料的生物农药奠定基础,为桑园病虫害绿色防控提供参考依据。
1 材料与方法
1.1 供试昆虫
朱砂叶螨2000年釆自重庆市北碚区野外桑树,在智能人工气候培养箱(25±1) ℃,RH 60%~80%,光周期L∶D=14 L∶10 D条件下,不喷施任何药剂,用盆栽豇豆苗继代饲养,长期培养箱饲养后检测其对多种农用杀螨剂抗性极低,视为敏感种群朱砂叶螨。试验按照各个螨态的具体发育历期确定所选试验对象。
1.2 供试药剂及仪器
含5%辣椒碱类物质的辣椒提取物(云南宏绿辣素有限公司)、Potter喷雾塔(BURKARD 公司)、酶标仪(Bio-Rad公司)、PCR仪(Bio-Rad公司)、荧光定量PCR检测仪(ABI公司)、Bradford蛋白浓度测定试剂盒(北京索莱宝科技有限公司)、谷胱甘肽S-转移酶活性检测试剂盒(北京索莱宝科技有限公司)、液氮、RNA提取试剂盒RNeasy Plus Micro Kit(QIAGEN公司)、反转录试剂盒PrimeScriptTM RT reagent Kit(Perfect Real Time,TAKARA公司)、荧光定量检测试剂盒SYBR®Premix Ex TaqTM II(Tli RNaseH Plus,TAKARA公司)。
1.3 室内毒力测定
采用叶碟喷雾法。在9 cm大小培养皿中放入吸水海绵保湿,海绵上平铺滤纸,将实验室栽培的无虫豇豆叶剪成直径5 cm大小的圆形叶蝶,叶背朝上平贴在滤纸上制成叶碟。Potter喷雾塔喷施药剂,喷雾压力为20 kPa,喷雾剂量为1 mL/叶碟[14],药后分别调查孵化率和死亡率,对照死亡率小于10%的实验有效。
卵:初次准备90个叶碟,每个叶碟上接入20~30头雌成螨,产卵24 h后移除成螨。待卵发育至3日龄时,取其中21个叶碟喷施辣椒碱类物质,浓度分别设置为6000、3000、1500、750、375、187.5 mg/L,每个浓度设3个叶碟作为重复。施药后120、144 h调查卵孵化率。
幼螨、若螨:其余卵留在叶蝶上分别继续孵化为黄白色3对足幼螨和4对足若螨(1日龄,含前期若螨和后期若螨),喷施辣椒碱类物质,浓度设置为500、250、125、62.5、31.25、15.625 mg/L,每个浓度设3个重复,药后24、48 h调查死亡率。
成螨:剩余若螨继续发育为成螨(3日龄),喷施辣椒碱类物质,浓度设置为2500、1250、625、312.5、156.25、78.125 mg/L,每个浓度设3个重复,药后24、48 h调查死亡率。
1.4 谷胱甘肽-S-转移酶(GSTs)的活性测定
1.4.1 朱砂叶螨各发育阶段酶液制备 各发育螨态获得方法同上。用LC30亚致死浓度的辣椒碱类物质分别喷雾处理各发育阶段螨,卵LC30浓度为1400 mg/L、幼螨和若螨LC30浓度为30 mg/L、雌成螨LC30浓度为400 mg/L,对照组用清水喷雾处理,对照组与处理组在喷雾处理后4、8、12、20、24 h时分别收集卵500粒、存活幼螨300头、存活若螨200头、存活雌成螨50头,迅速置于-80 ℃冰箱保存,测定时加入缓冲液研磨,制成酶液。各取样时间点分别设置3个重复样品。
1.4.2 蛋白质及谷胱甘肽-S-转移酶(GSTs)比活力测定 使用Bradford蛋白浓度测定试剂盒(北京索莱宝科技有限公司)及谷胱甘肽S-转移酶活性检测试剂盒(北京索莱宝科技有限公司),参照说明书测定并计算出朱砂叶螨各发育阶段在各取样时间点时的蛋白质含量及酶比活力。
1.5 谷胱甘肽-S-转移酶(GSTs)detal家族基因表达测定
将朱砂叶螨雌成螨用LC30亚致死浓度辣椒碱类物质喷雾处理,对照组用清水喷雾处理后分别于4、8、12、20、24 h收集存活雌成螨150头,迅速置于-80 ℃冰箱保存。每个取样点取3个重复样品。使用RNA提取试剂盒RNeasy Plus Micro Kit(QIAGEN公司)、反转录试剂盒PrimeScriptTM RT reagent Kit(Perfect Real Time,TAKARA公司)、荧光定量检测试剂盒SYBR®Premix Ex TaqTM II(Tli RNaseH Plus,TAKARA公司) 参照说明书提取RNA并反转录为CDNA保存于-20 ℃冰箱,用于检测谷胱甘肽-S-转移酶detal家族基因表达量情况,RPS18作为内参基因,引物序列见表1。
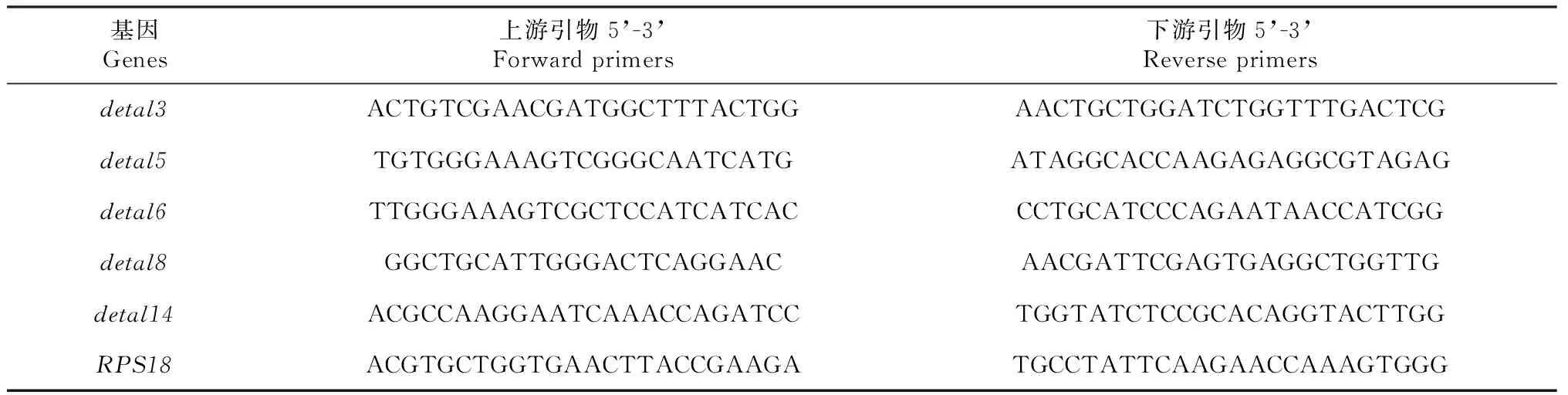
表1 朱砂叶螨谷胱甘肽-S-转移酶detal家族基因RT-qPCR引物
1.6 数据统计与分析
用SPSS 17.0软件的Probit模块、独立样本T检验和Excel做数据分析,得出毒力回归方程、LC30、LC50、LC90致死浓度值、谷胱甘肽S-转移酶比活力,计算酶活性抑制率等。
酶活性抑制率(%)=(对照组GSTs活性-处理组GSTs活性)/对照组GSTs活性×100
将基因相对表达量 Ct 值换算为相对表达量 2-△Ct值,其中,△Ct=目标基因Ct值-内参基因Ct值。再利用 SPSS 17.0软件进行独立样本T检验分析(P≤ 0.05)。
2 结果与分析
2.1 辣椒碱类物质对敏感朱砂叶螨各发育阶段的室内毒力
由表2可知,辣椒碱类物质对敏感朱砂叶螨卵、幼螨、若螨、成螨4个发育阶段都表现出不同程度的杀螨活性并影响生长发育,且杀螨活性随辣椒碱类物质浓度升高而增强,杀螨效率从高至低排列为幼螨>若螨>成螨>卵。试验中观察到处理组的卵120 h后未孵化的,在144 h后也仅有少数能够继续孵化,并且药剂处理后的卵即使是同时间孵化成幼螨,但后续生长发育明显比对照组缓慢,且高浓度处理的卵在孵化为幼螨后大部分陆续死亡,不能正常发育到成螨。辣椒碱类物质虽对各发育阶段的朱砂叶螨都有一定的杀螨活性,但在卵期和成螨期施用剂量远高于幼、若螨期,施药后 24 h幼螨LC50为51.50 mg/L;若螨为LC50为68.05 mg/L,由于辣椒碱类物质有一定的辛辣刺激性气味,使用高浓度进行田间防控不便于人工操作,且对植物叶片有一定伤害,故选用低浓度的辣椒碱类物质主要防控幼、若螨。
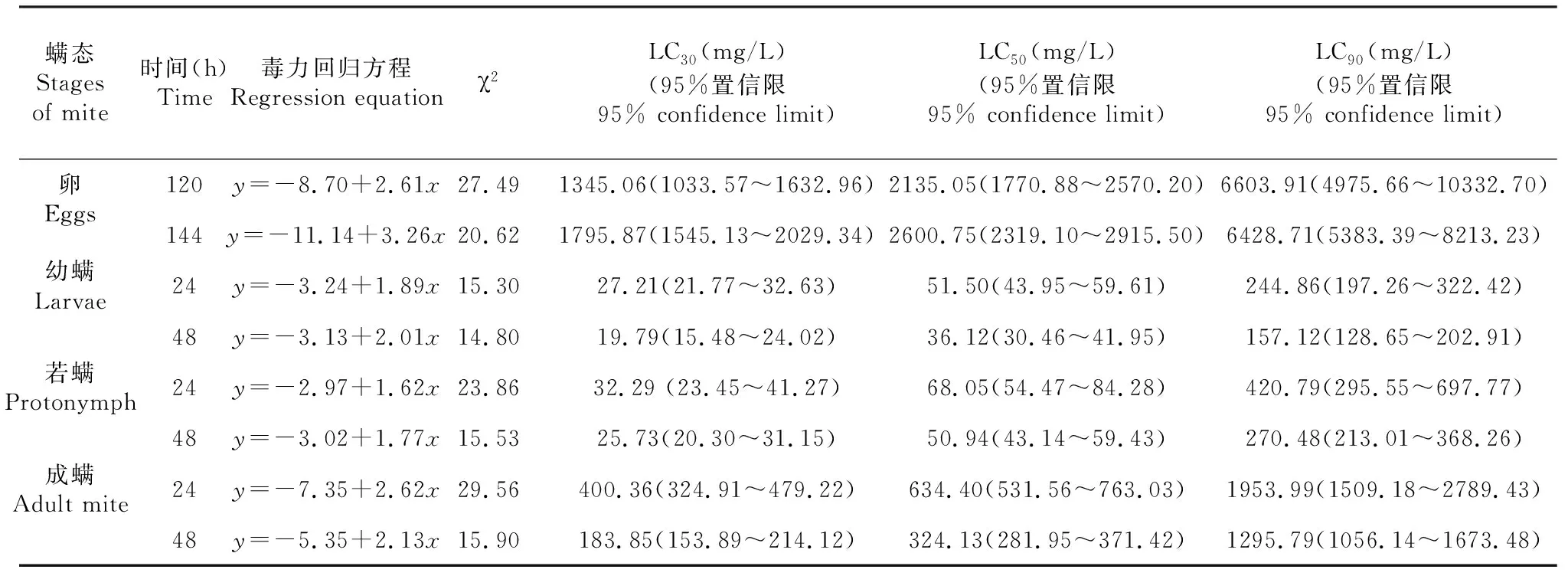
表2 辣椒碱类物质对朱砂叶螨各发育阶段的毒力
2.2 辣椒碱类物质对敏感朱砂叶螨各发育阶段谷胱甘肽S-转移酶(GSTs)活性的影响
朱砂叶螨各发育阶段GSTs活性变化如图1所示,朱砂叶螨体内GSTs活性由高到低排列为成螨>若螨>幼螨>卵。经过LC30亚致死浓度辣椒碱类物质处理,卵期(图1-A)GSTs活性处理组与对照组变化趋势相反,对照组 3、6、18、24 h GSTs比活力远高于处理组,分别为处理组的1.848、1.502、2.092、1.174倍,且3、6、18 h GSTs比活力与处理组存在极显著差异(P<0.01),说明LC30浓度辣椒碱类物质对GSTs酶活性有抑制作用,抑制率分别为45.892%、33.442%、52.193%、14.803%;3~12 h处理组GSTs酶活性逐渐升高,12 h时达到最高值,之后又逐渐降低,说明辣椒碱类物质虽然在一定程度上抑制了GSTs酶活性,但GSTs酶仍对外源物质发挥着解毒代谢作用,12 h后解毒作用又显著减弱。
如图1-B所示,幼螨期处理组与对照组GSTs活性变化趋势基本一致,4 h时处理组GSTs比活力远低于对照组,具有极显著差异(P<0.01),酶活性受到显著抑制,抑制率为17.593%;8、12、20 h 时GSTs比活力高于对照组,分别是对照组的1.355、1.257、1.085倍,说明此时间段GSTs受到外源药剂胁迫后酶活性被激活,且在8、20 h时处理组与对照组GSTs活性表现极显著差异(P<0.01)。
如图1-C所示,若螨期在观测时间段内处理组GSTs比活力未出现明显波动,趋于稳定,说明若螨期GSTs酶对LC30亚致死浓度辣椒碱类物质的敏感性较弱。
如图1-D所示,成螨期,4、8、20、24 h时对照组GSTs比活力高于处理组,具有极显著差异,分别是处理组的4.304、4.778、1.338、1.848倍,说明LC30亚致死浓度辣椒碱类物质对成螨期GSTs酶活性有较强的抑制作用,抑制率分别为76.768%、79.070%、25.235%、45.875%。从4 h到20 h期间处理组GSTs活性虽低于对照组但仍表现不断升高趋势,20 h达到最高值,随后降低,说明成螨在接触药剂的20 h内解毒作用不断增强,之后减弱。
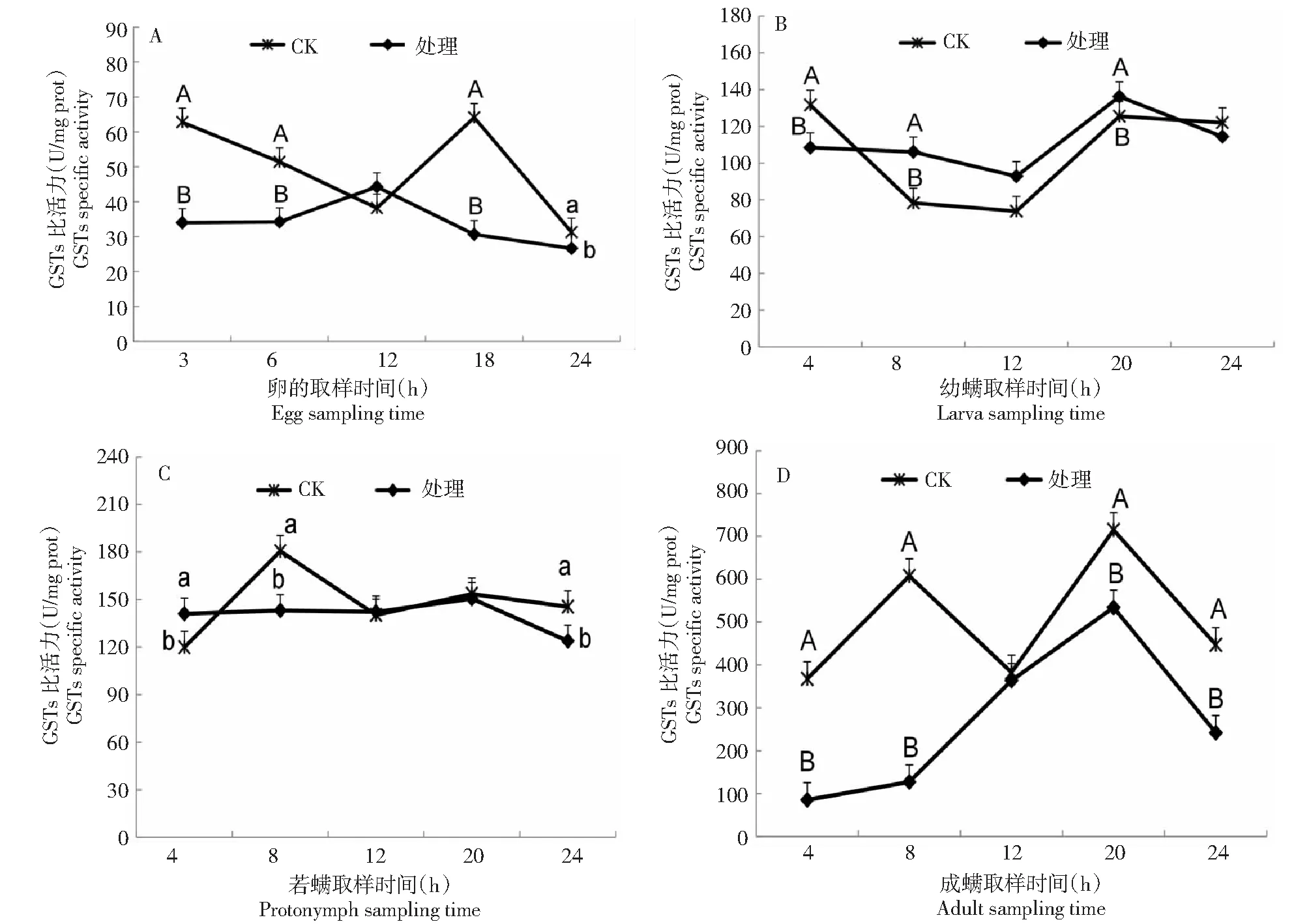
不同大写字母表示同一时间2个处理差异极显著(P<0.01),不同小写字母表示同一时间2个处理差异显著(P<0.05)。下同Different capital letters indicate that the difference between the control and the drug treatment at the same time is extremely significant (P<0.01). Different lowercase indicates the difference between the control and the drug treatment at the same time is very significant (P<0.05). The same as below图1 辣椒碱类物质对敏感品系朱砂叶螨各发育阶段谷胱甘肽S-转移酶活性的影响Fig.1 Effects of Capsaiciniods on the glutathione S-transferase activity for different developmental stages of sensitive Tetranychus cinnabarinus
2.3 辣椒碱类物质对朱砂叶螨雌成螨谷胱甘肽S-转移酶(GSTs)detal家族基因表达量的影响
由于雌成螨的谷胱甘肽S-转移酶酶活性远高于其余发育阶段,故进一步测定LC30亚致死浓度辣椒碱类物质处理后的雌成螨GSTs中detal家族基因表达情况(图2)。GSTs的detal家族包含16个基因,荧光定量检测后在雌成螨中只有detal3、detal5、detal6、detal8、detal14这5个基因表达量相对较高,其余基因表达量极低,故进一步分析这5个基因。
总体来看,LC30亚致死浓度辣椒碱类物质处理后24 h内,detal5基因平均表达量最高,约为detal3基因的26倍、detal6基因的13倍、detal8基因的5倍、detal14基因的2倍。药剂胁迫处理后detal5基因的表达趋势与对照组相反,4 ~12 h表达量持续下调,在12 h时达到最低,之后持续上调且极显著高于对照组。detal3基因表达量处理组表现4~24 h持续上调,除12 h时外都高于对照组,但只有20 h时与对照组存在极显著差异(P<0.01)。detal6、detal8基因在药剂胁迫后处理组都表现为先下调后上调,4 ~12 h表达量变化趋势与对照组一致,除12 h时外处理组表达量均高于对照组。detal14基因4~24 h表达量变化趋势处理组与对照组一致,除12 h外,其余时间点表达量均高于对照组,且存在显著性差异。由此推测,谷胱甘肽S-转移酶detal家族的这5个基因受辣椒碱类物质胁迫后,除12 h时表达量低于对照组,其余时间点都被激活而表现为表达量增加,说明这5个基因可能在一定程度上参与机体解毒代谢的抗逆性应激生理响应。
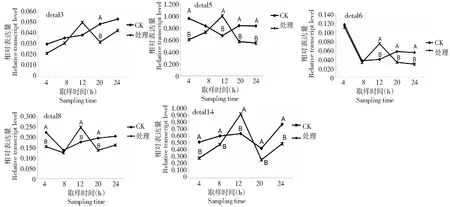
图2 辣椒碱类物质对敏感品系朱砂叶螨雌成螨谷胱甘肽S-转移酶detal基因的影响Fig.2 Effects of Capsaiciniods on the glutathione S-transferase detal gene activity for adult of sensitive Tetranychus cinnabarinus
3 讨 论
由于内禀性因素的影响,对照组各发育阶段GSTs活性在24 h有变化,并非一直保持不变,处理组在接受LC30浓度辣椒碱类物质胁迫后GSTs活性被激活或抑制,但变化趋势也基本遵循内禀性变化趋势。侯晓琳、吴咚咚等[15-16]研究也表明,低剂量辣椒碱能诱导西花蓟马雌成虫和烟粉虱体内 GSTs酶活性明显升高,高剂量辣椒碱抑制 GSTs酶活性。试验结果显示LC30浓度辣椒碱类物质对卵、成螨期GSTs有显著抑制作用,尤其在成螨期GSTs对该外源药剂的敏感性高于其余螨态,药剂作用后8 h内GSTs活性与对照组差异达4倍以上,酶活抑制率达75%以上;幼螨期活性显著高于对照组,对若螨期抑制和激活作用不显著,趋于稳定,可推断辣椒碱类物质能够抑制GSTs活性,从而抑制解毒作用,GSTs在受到外源物质胁迫时也发挥一定的解毒作用,但解毒作用低于受抑制的程度。因为GSTs是个超基因家族,在朱砂叶螨中GSTs主要包括16条detal家族基因、12条Mu家族基因及一些与kappa家族相似度极高的基因,不同家族基因具有不同的调控功能,而GSTs是总酶的活性,它对外源物质的响应变化受内禀性因素影响及各基因家族综合作用,故detal家族基因表达量上调和下调的趋势与GSTs总酶活性变化不完全对应,可进一步测定其余家族的基因表达情况,综合评定GSTs基因家族与酶活性变化的联动响应情况[17]。药剂对于朱砂叶螨的杀螨机理也是综合机制,外源药剂胁迫后螨体内羧酸酯酶(CarE)、乙酰胆碱酯酶(AChE)、多功能氧化酶(MFO)、细胞色素P450等解毒代谢酶系都会发挥作用,GSTs酶的应激响应变化仅是一方面的作用。由于辣椒碱类物质有一定的辛辣刺激性气味,使用高浓度田间防控不便于人工操作,但可选用低浓度的辣椒碱类物质防控幼、若螨,也可进一步研究辣椒碱类物质对其余解毒代谢酶的作用情况,确定其互作机理,筛选出能够发挥最佳抑制作用的浓度,将辣椒碱作为植物源增效剂与适宜的农药搭配使用,降低化学农药的使用剂量,降低害螨、害虫抗药性,提高田间防效,或以辣椒碱类物质为基础原料开发新的生物农药。
4 结 论
朱砂叶螨卵的孵化率随辣椒碱类物质浓度升高而降低,且能孵化的螨也不能正常发育至成螨,低浓度辣椒碱类物质对幼螨、若螨有较好的杀螨效果,成螨次之,杀螨机理主要是辣椒碱类物质抑制了谷胱甘肽S-转移酶(GSTs)活性,使其对外源有毒有害物质的解毒代谢作用减弱。在基因水平上,谷胱甘肽S-转移酶中detal3、detal5、detal6、detal8、detal14等基因在辣椒碱类物质胁迫后被激活表达量高于对照组,呈现在一定程度上参与机体解毒代谢的抗逆性应激生理响应。

