甲状腺癌Her2 靶向双模态分子探针的制备及表征
田洪达,李忠原,郝利国,高晓隆,刘强,李春香
1.齐齐哈尔医学院,黑龙江齐齐哈尔 161006;2.齐齐哈尔医学院附属第一医院,黑龙江齐齐哈尔 161041
国内,甲状腺癌处于内分泌恶性肿瘤发病率前列[1],女性甲状腺癌的发病率逐年升高。其中,年龄60 岁以上的人群中,甲状腺结节发病率高达50%~70%[2]。未分化甲状腺癌的恶性程度远高于其他种类的甲状腺癌,临床症状主要为瘤组织肿大压迫气管造成的呼吸困难,同时伴有远处转移等。目前影像学对甲状腺癌的早期定性诊断仍具有一定的局限性,随着技术的进步,分子影像学发展迅速,使多模态纳米探针对于明确未分化甲状腺癌的诊断和进展成为可能。分子探针是实现分子影像显像的核心技术,是一种功能性物质,能精确地体现特定对象的生物学问题[3]。目前磁共振成像中,常用钆剂做增强对比剂,其毒性低且改变了病变的信号,提高了与周围正常组织的对比度,但缺乏靶向性。人表皮生长因子受体2(human epidermal growth factor receptor,Her2),可 特 异 性 与 细 胞 结 构 域II 结合[4]。不仅可以在乳腺癌中表达,还在多种甲状腺癌中表达扩增[5-6]。结合目前的分子影像学发展,可以通过以Her2 为靶点,合成一种以磁共振造影剂Gd3+、荧光染料Cy5.5、靶向物质pertuzumab 偶联的双模态探针,并检测其表征。
1 材料与方法
1.1 材料来源
粒度分析仪(NICOMP-380ZLS,美国PSS);荧光分光分度计(RF-5301PC,日本岛津);准双光束紫外可见分光光度计(UV-3802,尤尼柯(上海)仪器有限公司);核磁共振造影剂驰豫率分析与成像系统(NM120,苏州纽迈公司);超声波清洗器(XM-3200UVF,昆山禾创超声仪器有限公司);集热式磁力搅拌器(DF-101S,上海力辰仪器科技有限公司);万分之一天平[QUINTIX65-1CN,赛多利斯(德国)集团];荧光染料Cy5.5、pertuzumab 购自上海前衍生物科技有限公司;EDC-HCl、NHS 购自北京索莱宝科技有限公司。
1.2 方法
双模态探针Gd-Cy5.5-pertuzumab 的制备包括DOTA-pertuzumab 的合成和Gd-Cy5.5-Pertuzumab的合成。
1.2.1 DOTA-pertuzumab 的合成 将2 mg pertuzumab稀释在400 μl 无菌的PBS 中,加入0.1 M 碳酸氢钠调节溶液pH 为8.4,加入40 mg p-SCN-Bn-DOTA,使pertuzumab 与p-SCN-Bn-DOTA 的摩尔比为1∶10[7-8]。溶液混合后在室温下振荡反应12 h。反应物用30kD 超滤管分离纯化,除去未反应的p-SCNBn-DOTA,得到产物DOTA-pertuzumab,备用复合物-20℃保存。
1.2.2 Gd-Cy5.5-Pertuzumab 的合成 ①称取GdCl3-6H2O 20 mg,溶于20 mL PBS 中,加入碳酸氢钠溶液调节pH 为8.4。将此溶液与上述溶液混合反应6 h。最后用10 kD 超滤管超滤,除去未反应的GdCl3-6H2O,得到产物Gd-DOTA-pertuzumab,然后备用的复合物4℃保存。②称取0.5 mgEDC 和0.5 mgNHS,加入上述产物中,在室温下放于恒温振荡器上活化1 h,将活化的溶液与200 μg Cy5.5 荧光染料混合,测得pH 为8.4。然后在室温下,摇床孵育2 h。反应结束后,用10kD 超滤管除去未反应的Cy5.5。得到产物Gd-Cy5.5-pertuzumab。用上述方法制作Gd-DOTA-Cy5.5 作为荧光成像对照组。
1.3 观察指标
Gd-Cy5.5-Pertuzumab 的表征检测包括透射电镜尺寸的检测、水动力尺寸及zeta 电位的测定、光学性质表征和弛豫率的测定。 ①透射电镜尺寸的检测:取适量Gd-Cy5.5-pertuzumab 溶液,用水作分散剂超声探头分散后,用滴管取一滴悬浮液滴于铜网上,干燥后,通过生物透射电镜下观察合成物的形态及粒径大小。 ②水动力尺寸及zeta 电位的测定:取100 μl Gd-Cy5.5-pertuzumab 溶液,加入去离子水稀释后,移入Eppendorf 管中,在超声波清洗机中振荡15 min,使得纳米颗粒均匀分散,然后移入到比色皿中,通过动态光散射测量纳米粒子的水动力尺寸和zeta 电位。 ③光学性质表征:各取Gd-Cy5.5-pertuzumab、Gd-DOTA-pertuzumab 溶液3 mL,移入石英比色皿中,用荧光检测仪分别两种样品进行荧光成像。 ④弛豫率的测定:取适量纳米探针溶液,用去离子水稀释探针,得到不同浓度梯度的Gd:0.1、0.2、0.3、0.4、0.5 mM。将稀释后的不同浓度的Gd 各取1 mL 放于Eppendorf 管,浓度由低到高标记为1、2、3、4、5 号。每次取一个置于纽迈小核磁分析仪中,磁体探头选择Meso60~60 mm,序列为IR。将1~5 号Eppendorf 置于试管架上,放于3.0MRI头部线圈中,进行磁共振T1序列扫描。
2 结果
2.1 纳米探针的表征
透射电镜结果显示,纳米探针Gd-Cy5.5-pertuzumab 的形态为圆形,内部黑色颗粒为多个钆原子,周围由pertuzumab 和Cy5.5 包裹呈现出球状,大小较均匀,见图1。Gd-Cy5.5-pertuzumab 水合粒径尺寸为(133.17±11.14)nm,探针分布尺寸窄,分散性较好,见图2。zeta 电位为(-34.58±7.91)mV,zeta 电位表明了合成物的稳定性,正值越大或负值越小说明越稳定。

图1 Gd-Cy5.5-pertuzumab TEM

图2 Gd-Cy5.5-pertuzumab 纳米探针水合粒径尺寸
2.2 Gd-DOTA-pertuzumab 和 Gd-Cy5.5-pertuzumab 荧光强度
探针在600 nm 处激发,685 nm 处有明显吸收峰,与荧光染料Cy5.5 的发射波长一致,表明Cy5.5偶联成功。而未偶联荧光染料的Gd-DOTApertuzumab,没有荧光信号,见图3。

图3 Gd-DOTA-pertuzumab 和Gd-Cy5.5-pertuzumab 荧光强度
2.3 Gd-Cy5.5-Pertuzumab 弛豫率
经3.0T 磁共振T1扫描显示随着Gd 浓度增加信号强度明显增强,见图4。运用纽迈小核磁检测不同浓度的Gd-Cy5.5-Pertuzumab:0.1、0.2、0.3、0.4、0.5mM 的T1时间。经OriginPro 2017 线性拟合得出,r1 的弛豫率为27.848 3 mM-1S-1,见图5。
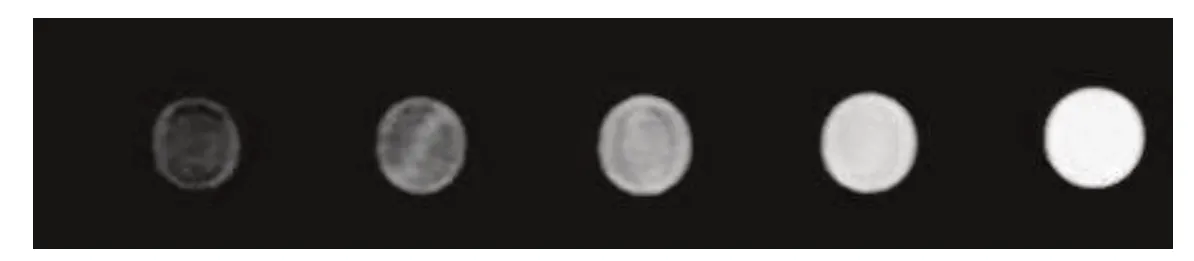
图4 Gd-Cy5.5-pertuzumab 磁共振成像
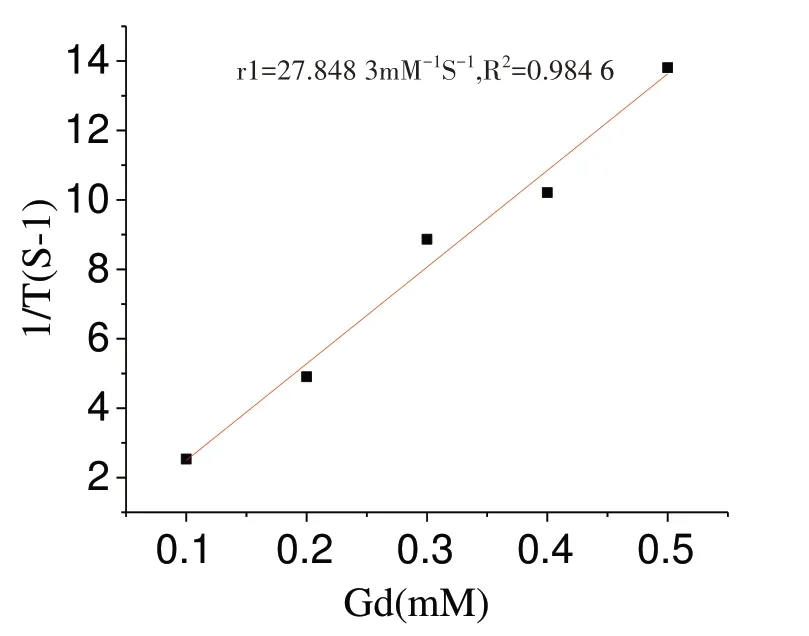
图5 Gd-Cy5.5-pertuzumab 弛豫率
3 讨论
甲状腺癌在我国发病率逐年升高、在内分泌系统肿瘤中越来越常见[9-10]。传统的检查方式(如X线、CT、超声)具有一定的辐射损伤和滞后性[11]。而运用分子影像学的手段,能更有效反映活体状态下组织、细胞水平的变化,并且可以对其生物学行为在影像方面进行定性、定量研究[12]。
目前,双模态探针的制备在分子影像中逐步成为主流[13-14]。磁共振成像是诊断肿瘤最有效的分子影像学工具之一,具有高分辨率,无电离辐射等优点,钆剂是目前临床上常用的、成熟的磁共振造影剂[15],通常通过注入钆剂来改变病变组织信号,以达到检测和诊断的目的。因此,实验中以钆剂为磁共振成像材料,通过T1成像,增加肿瘤组织与正常组织之间的对比度[16-17]。荧光染料Cy5.5 具有较高的生物安全性、稳定性、荧光强度高,毒性低等特点。在小动物活体实验时,利用小动物荧光成像有望代替有辐射性的核素成像。纳米级分子探针在肿瘤中具有较好的渗透性和弛豫时间,可与肿瘤表面的受体特异性结合。研究表明,Her2 在甲状腺未分化癌细胞8505C 中具有较高的表达,对甲状腺肿瘤的良恶性诊断有一定意义[18-19]。实验利用p-SCN-Bn-DOTA 双功能螯合物,连接Gd、Cy5.5、pertuzumab,合成一种以Her2 为潜在靶点、具有磁共振和荧光双模态特点的纳米探针。据报道,有40%的未分化甲状腺癌患者会发生颈部淋巴结转移,因此研究一种新的双模态探针检测甲状腺癌的早期病灶具有重要意义,利用带有pertuzumab 的探针与病灶中的Her2 特异性结合,实现肿瘤靶向成像,从而能在疾病早期诊断出病变。本实验中制备的Gd-Cy5.5-pertuzumab 双模态探针具有良好的稳定性,其形态均匀、分散性良好。测得探针的粒径大小为(133.17±11.14)nm,zeta 电位为(-34.58±7.91)mV,当zeta 电位小于-30 mV 时表明该纳米探针就有较好的稳定性。通过纽迈小核磁和MRI 检测出弛豫率为27.848 3 mM-1S-1,弛豫率高于传统的Gd-DTPA(5.83 mM-1S-1)[20],且探针随浓度的增大T1信号强度也逐渐增高。
综上所述,本实验合成的磁共振/荧光双模态探针Gd-Cy5.5-Pertuzumab,具有大小均匀、性质稳定的特点。该探针有望为甲状腺癌早期诊断提供预警,并且可以为患者的治疗方案提供指导。

