miR-18a靶向WNT2B对子宫肌瘤细胞增殖和凋亡的影响研究
周娟,杨宝艳,张政梅
子宫肌瘤是常见的发生于女性生殖系统的肿瘤,其发病原因尚不明确,可能与雌激素、孕激素等有关[1]。子宫肌瘤病人可能出现不孕、子宫出血、下腹疼痛等症状,研究子宫肌瘤分子发生机制是子宫肌瘤基因治疗的途径之一[2]。miRNA是生命体内的小分子非编码RNA,其表达具有保守性、时序性以及组织特异性,miRNA 在不同组织中的表达量不同,这与可能与miRNA 的功能有关[3]。研究显示,miRNA 在人体不同类型细胞生长、分化、凋亡等生物学特性中发挥作用,参与能量代谢、血糖维持等生理过程[4]。miRNA 在肿瘤中作用广泛,已知多种miRNA 在肿瘤中表达改变与肿瘤病人的临床病理特征有关,这些miRNA 还参与调控肿瘤细胞的生长、凋亡,miRNA 也逐渐成为基因靶向治疗的研究热点[5]。miR-18a 是一个肿瘤进展调控因子,miR-18a 在前列腺癌、结直肠癌等肿瘤中低表达,上调其表达可以抑制肿瘤细胞的生长[6-7]。研究报道显示,miR-18a 在子宮肌瘤中表达水平下降[8]。现阶段对于miR-18a 在子宫肌瘤细胞增殖和凋亡中作用还不明确。本研究探讨miR-18a 对子宫肌瘤细胞增殖、凋亡的影响和靶向调控机制,为子宫肌瘤治疗提供可能分子标志物。
1 资料与方法
1.1 一般资料收集2018 年3 月至2019 年10 月延安市人民医院子宫肌瘤病人手术切除的肌瘤组织和正常子宫肌组织(病人在手术切除以前均没有经过药物治疗),纳入标准为:经过临床以及相关检查确诊为子宫肌瘤。保存在4 ℃、含有青链霉素的PBS 溶液中,标本采集已经得到病人和近亲属的知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。miR-18a mimics、mimics control 购自百奥迈科生物技术有限公司;B 细胞淋巴瘤/白血病-2原癌基因(B-cell lymphoma/leukemia-2,Bcl-2)抗体购自北京百奥莱博科技有限公司;Bcl-2相关X 蛋白(Bcl-2 associated X protein,Bax)抗体购自上海泽叶生物科技有限公司;引物由南京金斯瑞生物科技有限公司;Lipofectamine 3000 购自美国Invitrogen;WNT 家族成员2B(WNT family member 2B,WNT2B)抗体购自上海博研生物科技有限公司;碘化丙啶(propidium iodide,PI)单染细胞周期检测试剂盒购自大连美仑生物技术有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自上海优宁维生物科技有限公司;miRVana miRNA Isolation Kit 购自上海索宝生物科技有限公司;细胞周期蛋白D1(cyclin D1)抗体、细胞周期数依赖性蛋白激酶4(cell cycle number dependent protein kinase4,CDK4)抗体购自上海信裕生物工程有限公司。
1.2 子宫肌瘤组织和正常子宫肌组织分离培养[9]取子宫肌瘤组织和正常子宫肌组织,用PBS 反复冲洗,剪碎成<1 mm3的组织块,添加800 U/mL 的Ⅰ型胶原酶,置于37 ℃孵育6 h,中间每1 小时用移液枪吹打1 次。1 000 g 离心10 min,收集的细胞接种到24孔板中,接种密度为5×105个/毫升,添加含有10%胎牛血清的细胞培养液,置于95%空气、5%二氧化碳培养箱中培养,培养温度为37 ℃,湿度为饱和湿度。
1.3 细胞转染及分组取子宫肌瘤细胞,细胞融合度为70%时进行细胞转染,采用Lipofectamine 3000转染试剂将miR-18a mimics、mimics control 转染到细胞中,转染步骤同转染试剂说明。将转染miR-18a mimics、mimics control 后 的 细 胞 命 名 为miR-18a、miR-NC 组,把没有转染的细胞命名为Control组。
1.4 细胞miR-18a 表达水平检测用qRT-PCR 方法检测miR-18a 表达,步骤:取培养48 h 以后的Control、miR-NC、miR-18a 组细胞,用miRVana miRNA Isolation Kit 提取细胞RNA,用紫外风光光度计检测浓度和纯度。取1 μg 的RNA,添加1 μL 的miScript Reverse Transcriptase Mix、5 μL的5×miScript RT Buffer,加无RNA 酶水至20 μL,按照37 ℃孵育60 min、95 ℃孵育5 min条件合成cDNA。取cDNA,进行qRTPCR,PCR体系为:5 μL的引物、5 μL的miScript Primer Assay、25 μL的Quanti Tect SYBR Green PCR Master mix、2 μL的cDNA,加无RNA酶水至50 μL。PCR 反应条件为:95 ℃、15 min;94 ℃、15 s;55 ℃、30 s;70 ℃、34 s。内参为U6,按照2-ΔΔCt法计算miR-18a 表达变化。miR-18a 引 物:正 向 引 物5’-AAGTGCAGGGCCTGCTGATGTTGA-3’,反向引物5’-GCTTGGCTTGAATTATTGGATG-3’。
1.5 细胞增殖检测用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)方法检测增殖变化,步骤为:取子宫肌瘤细胞按照Control、miR-NC、miR-18a组分组方法将细胞接种到96孔板内,细胞接种密度调整为1×105个/毫升,继续培养48 h以后,取出培养板,添加20 μL 的MTT 溶液,放在37 ℃孵育4 h,把上清吸掉,加200 μL 的DMSO 溶液,振荡反应10 min,在酶标仪上检测490 nm的A值。A值代表增殖能力。
1.6 细胞周期检测用PI 单染法检测细胞周期变化,步骤为:取培养48 h 以后的Control、miR-NC、miR-18a 组细胞,添加提前预冷的PBS 溶液洗涤2次,加入冰预冷的70%乙醇溶液,小心吹打混合,在4 ℃过夜。2 000 g 离心15 min,将上清弃掉,以PBS溶液重新悬浮细胞沉淀,2 000 g 离心10 min。在细胞中加RNaseA 溶液,在37 ℃孵育30 min,然后加入400 μL的PI染液,在4 ℃避光反应30 min,用流式细胞仪检测周期变化。
1.7 细胞凋亡检测用Annexin V-FITC/PI 双染法检测凋亡变化,步骤为:取培养48 h 以后的Control、miR-NC、miR-18a 组细胞,添加提前预冷的PBS 溶液洗涤2 次,最后将细胞悬浮在400 μL 的结合缓冲液中,添加5 μL 的Annexin V-FICT 溶液,置于室温避光条件反应15 min,然后再添加10 μL 的PI染色液,避光孵育10 min 后,立即用流式细胞仪检测细胞凋亡变化。
1.8 细胞中cyclin D1、CDK4、Bax、Bcl-2 蛋白表达检测用Western blotting 方法检测细胞中cyclin D1、CDK4、Bax、Bcl-2蛋白表达,步骤为:取培养48 h以后的Control、miR-NC、miR-18a 组细胞,将上层培养液弃掉以后,加PBS 洗涤细胞2 次,然后在细胞中添加PMSF∶RIPA 比例为100∶1 的裂解试剂,放在冰上裂解30 min。4 ℃,12 000g 离心10 min,取上清,以BCA 方法测定浓度。SDS-PAGE 凝胶蛋白上样量按照每孔30 μg 计算,将蛋白样品与1×Loading Buffer 混合煮沸5 min。把电压设置为60 V,溴酚蓝前端进入分离胶以后,电压调整到120 V,观察溴酚蓝迁移到凝胶的底部以后,取出凝胶。将凝胶浸泡在转膜缓冲液中10 min,PVDF 膜放在甲醇中平衡5 min,以200 mA 的恒流转膜1 h。电转结束后取出PVDF 膜,用TBST 洗涤3 次后,放在封闭液中,室温封闭2 h;取出PVDF 膜,TBST 洗涤3 次,再置于一抗溶液中,在4 ℃过夜反应;PVDF 膜再放在二抗孵育液中,室温结合2 h。ECL 显色。目的蛋白水平=目的条带灰度值÷内参GAPDH灰度值。
1.9 miR-18a与WNT2B 靶向关系预测和鉴定靶基因预测软件targetscan 预测miR-18a 与WNT2B 可能互为靶向关系。分别将含有WNT2B 的3,UTR 端结合位点(wt-WNT2)和突变后、不含WNT2B 的3,UTR 端结合位点(mut-WNT2)的荧光素酶报告载体与miR-18a mimics、mimics control 共转染到子宫肌瘤细胞中,48 h 后用荧光素酶活性检测试剂盒检测荧光素酶活性变化。荧光素酶报告载体由武汉金开瑞生物工程有限公司构建合成。收集培养48 h以后的Control、miR-NC、miR-18a 组细胞,用Western blotting检测WNT2B蛋白表达,步骤同“1.8”。
1.10 上调WNT2B 对miR-18a 调控作用影响检测分别将miR-18a mimics、pcDNA3.1 和miR-18a mimics、pcDNA3.1-WNT2B 共转染到子宫肌瘤细胞中,记为miR-18a+NC、miR-18a+WNT2B 组,利用上述方法测定细胞增殖(MTT)、周期(PI 单染)、凋亡(Annexin V-FITC/PI 双染法)和cyclin D1、CDK4、Bax、Bcl-2、WNT2B 蛋 白 表 达(Western blotting)。pcDNA3.1-WNT2B由和元生物技术(上海)股份有限公司构建。
1.11 统计学方法实验数据用SPSS 23.0 软件分析,满足正态分布的计量资料用表示,两组数据用独立样本t检验,多组差异比较用单因素方差,两两比较用turkey test,P<0.05为差异有统计学意义。
2 结果
2.1 miR-18a mimics 上调子宫肌瘤细胞中miR-18a 表达子宫肌瘤细胞中miR-18a 表达水平(0.52±0.06)低于正常子宫肌细胞(1.00±0.10)(t=7.13,P<0.05)。与miR-NC 组(0.97±0.13)比较,转染miR-18a mimics 后子宫肌瘤细胞中miR-18a 表达水平(3.21±0.25)升高,Control 组(1.00±0.12)与miRNC 组的miR-18a 表达水平差异无统计学意义(F=158.36,P<0.05)。miR-18a mimics 上调子宫肌瘤细胞中miR-18a表达水平。
2.2 miR-18a 抑制子宫肌瘤细胞增殖、阻滞细胞周期并诱导凋亡转染miR-18a mimics 后子宫肌瘤细胞增殖能力降低,G1 期细胞比例升高,细胞凋亡率升高,细胞中cyclin D1、CDK4、Bcl-2 蛋白表达水平下降,Bax 蛋白表达水平升高。miR-18a 抑制子宫肌瘤细胞增殖、阻滞细胞周期并诱导凋亡。见图1、表1。
表1 miR-18a mimics转染后的子宫肌瘤细胞增殖能力(A值)、周期分布比例、凋亡率和cyclin D1、CDK4、Bax、Bcl-2蛋白表达/
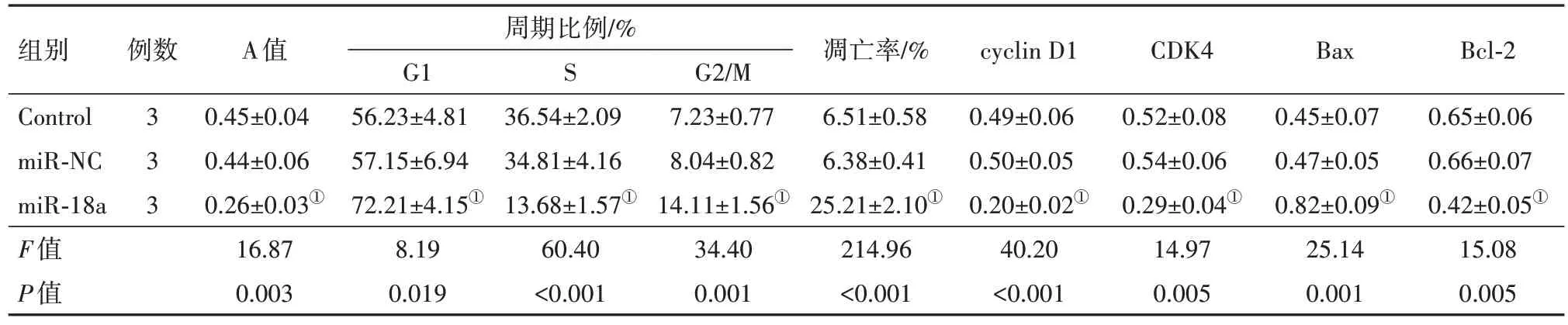
表1 miR-18a mimics转染后的子宫肌瘤细胞增殖能力(A值)、周期分布比例、凋亡率和cyclin D1、CDK4、Bax、Bcl-2蛋白表达/
注:cyclin D1为细胞周期蛋白D1,CDK4为细胞周期数依赖性蛋白激酶4,Bax为Bcl-2相关X蛋白,Bcl-2为B细胞淋巴瘤/白血病-2原癌基因。①与miR-NC组比较,P<0.05。
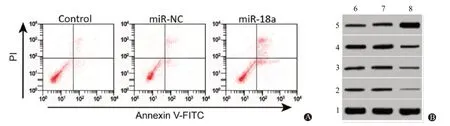
图1 miR-18a mimics转染后的子宫肌瘤细胞凋亡和cyclin D1、CDK4、Bax、Bcl-2蛋白表达变化:A为流式细胞术检测子宫肌瘤细胞凋亡;B为蛋白质印迹法检测子宫肌瘤细胞中cyclin D1、CDK4、Bax、Bcl-2蛋白表达
2.3 miR-18a 和WNT2B互为靶向关系miR-18a 与WNT2B 的3,UTR 端有互补结合位点,并且wt-WNT2B 荧光素酶报告载体和miR-18a mimics 共转染后的子宫肌瘤细胞荧光素酶活性下降。miR-18a和WNT2B互为靶向关系。见图2、表2。
表2 细胞荧光素酶活性变化/
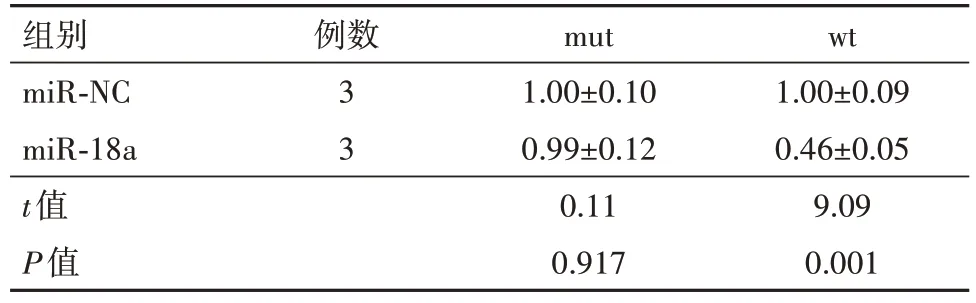
表2 细胞荧光素酶活性变化/
注:mut为mut-WNT2B 荧光素酶报告载体,wt为wt-WNT2B 荧光素酶报告载体

图2 miR-18a靶基因预测结果
2.4 miR-18a 抑制子宫肌瘤细胞中WNT2B 表达与miR-NC 组(0.43±0.06)比较,转染miR-18a mimics后子宫肌瘤细胞中WNT2B 蛋白表达水平(0.22±0.03)下降,Control 组(0.42±0.04)与miR-NC 组的WNT2B 蛋白表达水平差异无统计学意义(F=20.71,P<0.05)。miR-18a 抑制子宫肌瘤细胞WNT2B 蛋白表达。见图3。
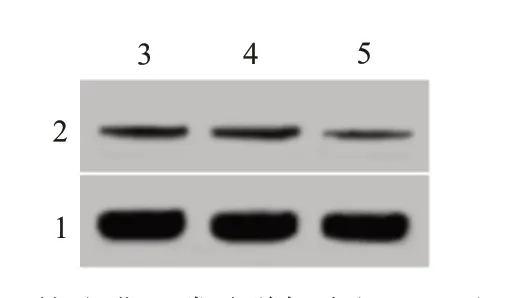
图3 蛋白质印迹法检测miR-18a mimics转染后的子宫肌瘤细胞中WNT2B蛋白表达
2.5 上调WNT2B 逆转miR-18a 对子宫肌瘤细胞增殖、周期和凋亡作用与共转染miR-18a mimics、pcDNA3.1 相比,共转染miR-18a mimics、pcDNA3.1-WNT2B 后的子宫肌瘤细胞增殖能力增加,G1 期细胞比例降低,细胞凋亡率下降,细胞中cyclin D1、CDK4、Bcl-2、WNT2B 蛋白表达水平升高,Bax 蛋白表达水平降低。上调WNT2B 逆转miR-18a 对子宫肌瘤细胞增殖、周期和凋亡作用。见图4、表3。
表3 miR-18a mimics、pcDNA3.1-WNT2B共转染后的子宫肌瘤细胞增殖能力(A值)、周期分布比例、凋亡率和cyclin D1、CDK4、Bax、Bcl-2、WNT2B蛋白表达水平/

表3 miR-18a mimics、pcDNA3.1-WNT2B共转染后的子宫肌瘤细胞增殖能力(A值)、周期分布比例、凋亡率和cyclin D1、CDK4、Bax、Bcl-2、WNT2B蛋白表达水平/
注:cyclin D1为细胞周期蛋白D1,CDK4为细胞周期数依赖性蛋白激酶4,Bax为Bcl-2相关X 蛋白,Bcl-2为B 细胞淋巴瘤/白血病-2原癌基因,WNT2B为WNT家族成员2B。①与miR-18a+NC组比较,P<0.05。
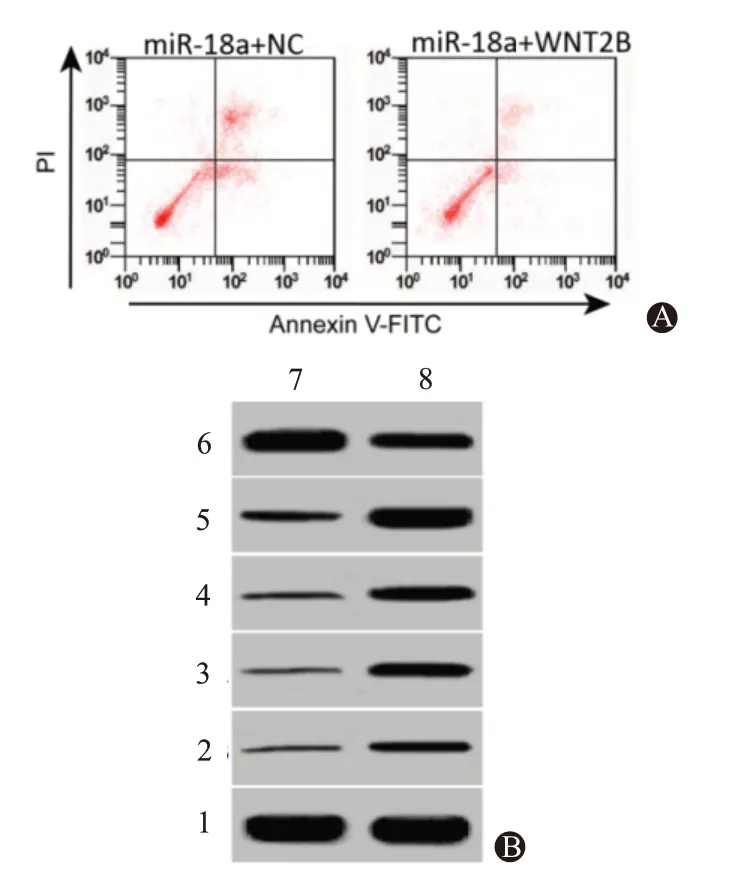
图4 miR-18a mimics、pcDNA3.1-WNT2B共转染后子宫肌瘤细胞凋亡和cyclin D1、CDK4、Bax、Bcl-2、WNT2B蛋白表达:A为流式细胞术检测细胞凋亡;B为蛋白质印迹法检测cyclin D1、CDK4、Bax、Bcl-2、WNT2B蛋白表达
3 讨论
miRNA 在真核生物体内广泛存在,是一类单链RNA,其被认为是基因调控领域中的巨大突破。miRNA 是在线虫中发现的,其在不同的物种之间具有高度保守性,人体内有约30%的基因受到miRNA的调控作用[10]。研究证实,免疫系统、神经系统、心血管系统等均受到miRNA的影响,miRNA通过影响细胞生长、凋亡等细胞生理过程而发挥重要作用[11]。子宫肌瘤进展与miRNA 表达有关,miRNA 调控子宫肌瘤细胞的生长和凋亡[12]。miR-18a 作为一个多功能调控因子,其不仅参与子痫前期、心梗等疾病发生,还与肿瘤进展有关[13-14]。miR-18a 在前列腺癌、结直肠癌等肿瘤中表达下调,上调miR-18a 降低肿瘤细胞增殖能力[6-7]。既往研究已经证实,miR-18a在子宫肌瘤组织中表达下调[8]。本研究显示,上调miR-18a 后的子宫肌瘤细胞增殖能力降低,这与上述研究结果一致,提示miR-18a 在子宫肌瘤中可能发挥抑制作用。
细胞增殖、周期以及细胞凋亡是细胞重要的生物学特性,细胞周期有序进展是细胞增殖的基础,细胞增殖和凋亡平衡是机体内环境维持的重要途径[15]。细胞周期分成分裂间期和分裂期,分裂间期是分裂期的准备阶段,也是细胞周期的关键。研究显示,细胞分裂间期有两个关键的转换点,其中G1期向S 期进展是关键转换点之一,这一过程受到细胞内多种调控因子的复杂作用[16]。cyclin D1、CDK4是细胞从G1期向S期进展的促进因子,二者在G1期表达上调,cyclin D1、CDK4 也是目前发现的肿瘤促进因子[17]。细胞凋亡是细胞受到外界刺激以后引起的多基因调控的结果,Bcl-2是与细胞凋亡有关的蛋白家族[18]。Bcl-2蛋白家族含有多个成员,根据其在细胞凋亡过程中的作用可以分成促凋亡蛋白和抗凋亡蛋白[19]。Bax、Bcl-2 分别为Bcl-2 蛋白家族中的促凋亡蛋白和抗凋亡蛋白[20]。本研究表明,miR-18a具有将细胞周期阻滞在G1期和诱导细胞凋亡的作用,miR-18a还可以减少细胞中cyclin D1、CDK4、Bcl-2蛋白并促进Bax蛋白表达,这充分证实miR-18a有阻滞子宫肌瘤细胞周期并诱导细胞凋亡作用。
miRNA 通过碱基互补的方式与靶基因的mRNA 的3’UTR 端结合,从而影响靶基因的翻译。miRNA 与靶基因是以不完全匹配的方式结合,因此miRNA 通过作用多个靶基因发挥作用[21]。本研究表明,miR-18a 可以靶向抑制子宫肌瘤细胞中WNT2B 表达。WNT2B 是WNT 信号通路的组成部分,其在肿瘤中表达上调,下调其表达具有抗肿瘤细胞生长和诱导细胞凋亡的作用[22-23]。本研究显示,WNT2B 能够逆转miR-18a 对子宫肌瘤细胞增殖抑制、周期阻滞和细胞凋亡作用,说明miR-18a 作用机制与靶向调控WNT2B 有关。目前对miR-18a 调控WNT2B 的下游机制还不明确,在以后实验中会进行详细探讨。
以上表明,miR-18a 靶向抑制子宫肌瘤细胞中WNT2B表达发挥增殖抑制、周期阻滞和凋亡促进作用,miR-18a 可能是子宫肌瘤进展中的抑制因子,靶向miR-18a可能是子宫肌瘤治疗的途径之一。

