氧化应激通过胰腺线粒体通透性转换孔损伤导致胰腺炎的机制
姚晶








【摘要】 目的:探討氧化应激对胰腺线粒体通透性转换孔(MPTP)的影响以及氧化应激引起的胰腺炎的主要机制。方法:选择2017年1月-2019年12月于葫芦岛市中心医院消化科住院的96例患者,探究氧化应激因子与胰腺炎相关指标及炎症因子的相关性;并利用雨蛙素对人胰腺细胞AR42J进行造模,研究氧化应激导致胰腺炎的机理。结果:不同严重程度胰腺炎患者血糖、血钙、血淀粉酶、白细胞计数、各项炎症因子与氧化应激因子比较,差异均有统计学意义(P<0.05)。血糖、血钙、血淀粉酶、白细胞计数、IL-8、IL-6、TNF-α、hs-CRP与MDA均呈正相关(P<0.05),与SOD、CAT、GSH-Px均呈负相关(P<0.05)。随着雨蛙素处理浓度升高,AR42J细胞内各项炎症因子与MDA均逐渐升高,SOD、CAT、GSH-Px逐渐降低(P<0.05)。不同浓度雨蛙素处理AR42J细胞内IL-8、IL-6、TNF-α、hs-CRP与MDA均呈正相关(P<0.05),与SOD、CAT、GSH-Px水平均呈负相关(P<0.05)。随着雨蛙素浓度逐渐升高,相对荧光单位(RFU值)、红/绿荧光比值和细胞线粒体内ATP含量逐渐降低(P<0.05)。结论:胰腺炎患者体内氧化应激因子对胰腺炎病情显著相关,氧化应激可以造成MPTP过度开放,破坏胰腺线粒体内ATP的合成,导致胰腺细胞炎症的发生。
【关键词】 胰腺炎 线粒体通透性转换孔 氧化应激
Mechanism of Pancreatitis Caused by Damage of Mitochondrial Permeability Transition Pore through Oxidative Stress/YAO Jing. //Medical Innovation of China, 2022, 19(07): 0-038
[Abstract] Objective: To investigate the effect of oxidative stress on the pancreatic mitochondrial permeability transition pore (MPTP) and the main mechanism of oxidative stress-induced pancreatitis. Method: A total of 96 patients hospitalized in department of Gastroenterology, Huludao City Central Hospital from January 2017 to December 2019 were selected to explore the correlation between oxidative stress factors and pancreatitis related indicators and inflammatory factors. The mechanism of pancreatitis induced by oxidative stress was studied by modeling human pancreatic cells AR42J with Caerulein. Result: There were statistically significant differences in blood glucose, blood calcium, blood amylase, white blood cell count, inflammatory factors and oxidative stress factors in patients with different severity of pancreatitis (P<0.05). Blood glucose, blood calcium, blood amylase, white blood cell count, IL-8, IL-6, TNF-α and hs-CRP were positively correlated with MDA (P<0.05), while negatively correlated with SOD, CAT and GSH-Px (P<0.05). With the increase of Caerulein concentration, all inflammatory factors and MDA in AR42J cells increased gradually, while SOD, CAT and GSH-Px decreased gradually (P<0.05). Il-8, IL-6, TNF-α and hs-CRP in AR42J cells were positively correlated with MDA (P<0.05), and negatively correlated with SOD, CAT and GSH-Px levels (P<0.05). With the increasing of Caerulein concentration, the relative fluorescence unit (RFU) and red-green fluorescence ratio and the content of ATP in mitochondria decreased gradually (P<0.05). Conclusion: Oxidative stress factors in patients with pancreatitis are significantly related to the condition of pancreatitis. Oxidative stress can cause excessive opening of MPTP, destroy the synthesis of ATP in pancreas mitochondria, and lead to inflammation of pancreatic cells.
[Key words] Pancreatitis Mitochondrial permeability transition pore Oxidative stress
First-author’s address: Huludao City Central Hospital, Liaoning Province, Huludao 125000, China
doi:10.3969/j.issn.1674-4985.2022.07.008
急性胰腺炎(AP)是外分泌胰腺常见的炎症性疾病,是最常见的胃肠道住院原因之一[1]。尽管大多数患者表现为轻度自我限制性障碍,但五分之一的AP患者会发展成严重的疾病,发病率、死亡率和经济负担都很高。酶原激活一直被认为是胰腺损伤主要的机制[2]。但近年来,由于线粒体功能障碍引发胰腺炎的发病率却越来越高[3-5]。线粒体是细胞活力和功能的核心,控制着许多生理代谢过程[6-7]。线粒体通透性转换孔(MPTP),一个非特异性通道,是线粒体膜中存在的一类蛋白质复合物,在控制线粒体内膜通透性中起重要作用[8]。MPTP与细胞凋亡的调控密切相关[9]。MPTP具有3种功能状态:(1)转换孔完全关闭,跨膜电位维持完整性;(2)过渡孔处于低水平开放可逆状态,只有小于300 D的物质才能通过,这可以降低线粒体的跨膜电位;(3)过渡孔处于高水平的开放不可逆状态,使小于1 500 D的物质能自由通过线粒体内膜,大大增加了线粒体基质的体积[10]。在许多炎癥性疾病中,氧自由基在炎症发展中起着重要作用,炎症性疾病与胰腺炎的炎症组织损伤相似,使得许多研究者开始研究AP的氧化应激(OS)[11]。在过去的20年里,人们越来越意识到OS在AP中的作用,当活性氧(ROS)的生成与足够的抗氧化剂防御系统之间存在不平衡时,就会发生OS。OS可以直接或通过改变信号传导途径引起细胞损伤[12]。相关研究已经证明,在急性实验性胰腺炎的体内模型中,氧衍生的自由基是介导AP发生的重要步骤[13]。但是关于氧化应激对胰腺MPTP的影响以及氧化应激引起的胰腺炎的主要机制尚未报道。因此,本文通过采集96例胰腺炎患者的临床资料,研究氧化应激因子与胰腺炎相关指标及炎症因子的相关性;并利用细胞模型,研究氧化应激因子对胰腺线粒体通透性转换孔的影响、探究其导致胰腺炎的机理,现报道如下。
1 资料与方法
1.1 一般资料 选择2017年1月-2019年12月于葫芦岛市中心医院消化科住院的96例患者。纳入标准:(1)根据亚特兰大的急性胰腺炎的诊断标准,凡能够满足以下的临床特征中的任何2项的患者,就确诊为急性胰腺炎:①腹痛表现为急性发作,且为持续性的,严重的患者其上腹部疼痛的症状还会放射至背部;②血清脂肪酶的活性(或淀粉酶的活性)至少大于正常上限的3倍;③通过增强CT扫描或者磁共振成像(MRI)以及腹部的超声检查发现存在急性胰腺炎的影像学特征。(2)年龄18~80岁。(3)在急性胰腺炎发病的3 d内入院。(4)临床资料完整。排除标准:(1)自身免疫性胰腺炎。(2)慢性胰腺炎急性发作。(3)胰腺肿瘤疾病史。(4)孕妇或哺乳期妇女。(5)要求自动出院。(6)依从性差。所有患者及家属均知情同意并签署知情同意书,本研究获得本院医学伦理委员会批准实施。
1.2 一般资料收集和生化指标检测 收集所有患者的临床资料,包括年龄、性别、体质量指数、是否合并其他疾病、烟酒史。入院初期对患者进行Ranson、急性胰腺炎严重程度床边指数(BISAP)、改良的CT严重指数(MCTSI)、急性生理学和慢性健康状况评分系统(APACEHⅡ)以及Marshall评分,判断患者的患病程度,(1)轻症胰腺炎(MAP):Ranson评分<3分,BISAP评分<3分,MCTSI评分<4分,APACEHⅡ评分<8分;(2)中度重症胰腺炎(MSAP):Ranson评分≥3分,BISAP评分≥3分,MCTSI评分≥4分,APACEHⅡ评分≥8分;(3)重症胰腺炎(SAP):Ranson评分≥3分,BISAP评分≥3分,MCTSI评分≥4分,APACEHⅡ评分≥8分,Marshall评分≥2分。患者入院后抽取空腹静脉血5 mL,血样采集后1 h内进行离心,4 000 r/min离心5 min,取上层血清于-80 ℃保存。在检测前,将保存的血清放入37 ℃恒温水浴箱水浴10 min。使用全自动生化分析仪(Roche,Mannheim,Germany)检测血液指标,包括血糖、血钙、血淀粉酶及白细胞计数。利用Elisa试剂盒(南京建成生物工程研究所,江苏,中国)测定患者血清中炎症因子[白细胞介素-8(IL-8)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、超敏C-反应蛋白(hs-CRP)]及氧化应激因子[丙二醛(MDA)、超氧化物气化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)]。
1.3 细胞实验 为探究氧化应激导致胰腺炎的机理,利用雨蛙素对AR42J细胞进行造模,研究AR42J细胞中氧化应激因子与炎症因子的相关性、MPTP的开放程度,线粒体膜电位、线粒体ATP水平。
1.3.1 试剂与仪器 共焦荧光显微镜(LSM510/LSM710, Carl Zeiss Jena GmbH),人胰腺细胞AR42J细胞(ATCC,USA),细胞/组织质量纯化分离试剂盒(GENMED,上海,中国),线粒体通透性转换孔荧光检测试剂盒(GENMED,上海,中国),ATP测定试剂盒(Beyotime Biotechnology,上海,中国),线粒体膜电位检测试剂盒测量(Molecular Probes,Eugene,USA),雨蛙素、RPMI-1640培养基均购于Sigma公司(Sigma,USA)。
1.3.2 细胞培养及造模 人胰腺细胞AR42J细胞在含有10%胎牛血清的RPMI-1640培养基中常规培养、传代。取传代2次且生长良好的对数生长期细胞,培养24 h后,利用雨蛙素对细胞进行造模,浓度分别为1、1.5、2、2.5、3 μmol/L,细胞培养48 h后,进行离心8 000 r/min, 10 min,分别收集细胞及上清液备用。每组设置10个培养皿。
1.3.3 AR42J細胞中炎症因子及氧化应激因子测定 对细胞进行匀浆处理,利用离心机12 000 r/min离心20 min,利用ELISA法对上清液中的炎症因子(IL-8、IL-6、TNF-α、hs-CRP)及氧化应激因子(MDA、SOD、CAT、GSH-Px)含量进行测定。
1.3.4 AR42J细胞中线粒体的提取 取2 mL的细胞悬液,置于50 mL离心管中,预冷。用10 mL GENMED清洁剂清洁组织,并移入15 mL离心管中预冷。然后在15 mL离心管中加入5 mL预冷裂解液,摇匀5 s。匀浆后,用10 000 r/min,4 ℃,离心10 min。上清液被收集到15 mL离心管中预冷,清除不溶的细胞和细胞核,然后10 000 r/min,4 ℃,离心10 min,得到沉淀物(即线粒体)之后,将50 μL GENMED加到沉淀物中,混匀之后置于冰上,2 mL GENMED高纯度液体加到6 mL超速离心机,并将500 μL线粒体加入GENMED高纯度液体中,并在10 000 r/min,4℃,离心10 min,最后,用无菌注射针吸收棕色或奶油样区,即纯化的线粒体样品。
1.3.5 MPTP的开放程度检测 用MPTP荧光检测试剂盒检测MPTP的开放性。将10 μL GENMED染色液加入100 μL线粒体样本中,放置37 ℃的培养箱,在暗室培养15 min。线粒体样本离心(12 000 r/min,4 ℃,离心10 min)得到沉淀物,将GENMED保存液预热到37 ℃,取200 μL加入沉淀物中,并12 000 r/min,4 ℃,离心10 min,将上清液除去,再重新加入100 μL预热的GENMED保存液,利用荧光微板分光光度计,在488 nm激发波长和505 nm发射波长下,进行检测。如果相对荧光单位(RFU)减少,则说明MPTP的开放度增加。
1.3.6 线粒体膜电位测定 用基于JC-1的线粒体膜电位检测试剂盒测量线粒体膜电位,在高膜电位下,JC-1形成红色荧光J-聚集体,而绿色荧光单体在低膜电位下存在,红色和绿色荧光的比值用于测量线粒体膜电位的变化。取雨蛙素浓度为0、2.0、3.0 μmol/L下造模的细胞,新鲜细胞在37 ℃避光下JC-1处理10 min,在PBS中洗涤两次,红色荧光(激发550 nm,发射600 nm)和绿色荧光(激发485 nm,发射535 nm)利用荧光显微镜(Imager Z2, Zeiss)测量。线粒体去极化表现为红/绿荧光比值降低。用ImageJ软件进行图像处理和分析(ImageJ,NIH)。
1.3.7 线粒体中ATP含量测定 根据说明书,使用ATP测定试剂盒测定线粒体中ATP含量。采用磷钼酸比色法测定心肌线粒体ATP浓度。将组织裂解,在12 000 g和4 ℃下离心5 min,收集得到的上清液,采用分光光度计进行检测。
1.4 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以率(%)表示,比较采用χ检验,相关性采用Pearson相关系数分析。以P<0.05为差异有统计学意义。
2 结果
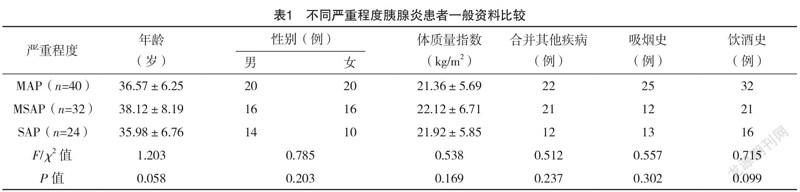
2.1 不同严重程度胰腺炎患者一般资料比较 96例患者中MAP 40例,MSAP 32例,SAP 24例。不同严重程度胰腺炎患者年龄、性别、体质量指数、合并其他疾病、吸烟史及饮酒史比较,差异均无统计学意义(P>0.05);不同严重程度胰腺炎患者血糖、血钙、血淀粉酶、白细胞计数比较,差异均有统计学意义(P<0.05),且SAP>MSAP>MAP(P<0.05)。见表1。
2.2 不同严重程度胰腺炎患者炎症因子比较 不同严重程度胰腺炎患者各项炎症因子比较,差异均有统计学意义(P<0.05),且SAP>MSAP>MAP(P<0.05),见表2。
2.3 不同严重程度胰腺炎患者氧化应激因子比较 不同严重程度胰腺炎患者各项氧化应激因子比较,差异均有统计学意义(P<0.05),MDA呈SAP>MSAP>MAP,SOD、CAT、GSH-Px呈SAP<MSAP<MAP(P<0.05),见表3。
2.4 胰腺炎患者氧化应激因子与血液指标、炎症因子的相关性分析 血糖、血钙、血淀粉酶、白细胞计数与MDA呈正相关(P<0.05),与SOD、CAT、GSH-Px呈负相关(P<0.05),见表4。IL-8、IL-6、TNF-α、hs-CRP与MDA呈正相关(P<0.05),与SOD、CAT、GSH-Px呈负相关(P<0.05),见表5。
2.5 AR42J细胞实验结果
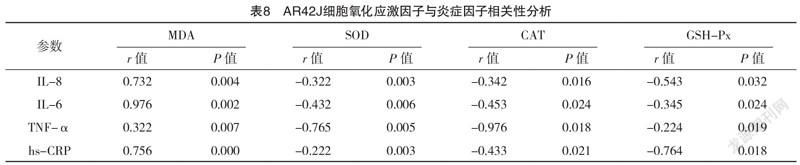
2.5.1 AR42J细胞中氧化应激因子与炎症因子的相关性分析 随着雨蛙素处理浓度升高,AR42J细胞内各项炎症因子与MDA均逐渐升高,SOD、CAT、GSH-Px逐渐降低(P<0.05),见表6、7。不同浓度雨蛙素处理AR42J细胞内IL-8、IL-6、TNF-α、hs-CRP与MDA均呈正相关(P<0.05),与SOD、CAT、GSH-Px水平均呈负相关(P<0.05)。见表8。
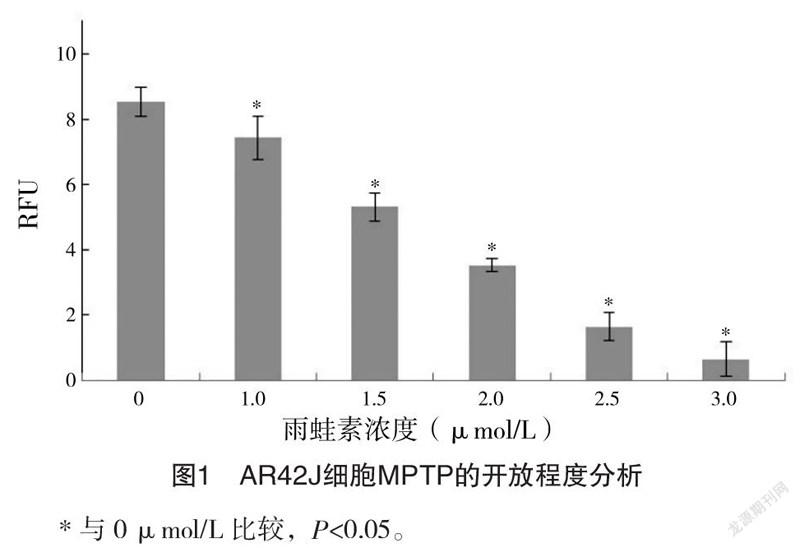
2.5.2 AR42J细胞MPTP的开放程度分析 1.0~
3.0 μmol/L雨蛙素干预下,细胞RFU值分别为(7.14±1.41)、(5.05±0.95)、(3.18±0.55)、(1.37±0.98)、(0.87±1.16),均低于0 μmol/L的(8.52±0.92)(P<0.05),且随着雨蛙素浓度逐渐升高,RFU值逐渐降低(P<0.05)。见图1。
2.5.3 AR42J细胞线粒体膜电位分析 在2.0、3.0 μmol/L雨蛙素干预下,细胞红/绿荧光比值分别为(1.74±1.03)、(0.79±1.36),均低于0 μmol/L的(2.85±1.13)(P<0.05),且随着雨蛙素浓度升高,红/绿荧光比值逐渐降低(P<0.05)。见图2。
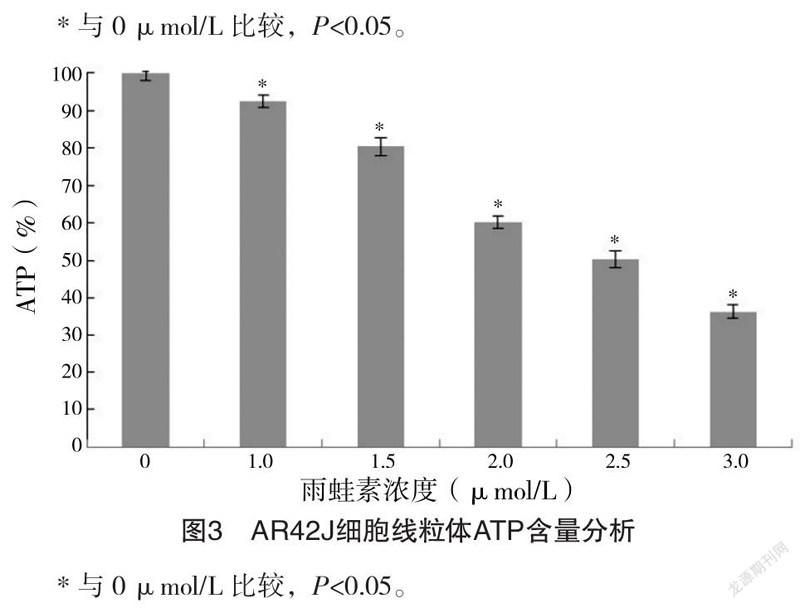
2.5.4 AR42J细胞线粒体ATP含量分析 在1.0~3.0 μmol/L雨蛙素干预下,细胞内ATP含量分别为(91.24±0.54)%、(80.36±0.62)%、(59.72±0.47)%、(48.62±0.61)%、(34.84±0.45)%,均低于0 μmol/L的(98.57±0.52)%(P<0.05),且随着雨蛙素浓度升高,细胞线粒体内ATP含量逐渐下降(P<0.05)。见图3。
3 讨论
在细胞中,ROS是在正常呼吸过程中产生的,很大一部分来自线粒体电子传递链的复合体Ⅰ和Ⅱ[14]。越来越多的证据表明,ROS可能在不同的生理过程中发挥信号作用,而不是简单地构成一种不需要的副产品[15];然而,过量的ROS的产生已经被证明通过破坏脂膜、蛋白质和DNA来促进多种细胞类型的损伤[16]。因此,ROS的产生与自由基的内源性清除之间存在着良好的平衡。氧化应激的结果可能反映胰腺受到损伤的程度和严重程度。
本研究结果显示,不同严重程度胰腺炎患者血糖、血钙、血淀粉酶、白细胞计数、各项炎症因子与氧化应激因子比较,差异均有统计学意义(P<0.05)。血糖、血钙、血淀粉酶、白细胞计数、IL-8、IL-6、TNF-α、hs-CRP与MDA均呈正相关(P<0.05),与SOD、CAT、GSH-Px均呈负相关(P<0.05);随着雨蛙素浓度逐渐升高,RFU值、红/绿荧光比值和细胞线粒体内ATP含量逐渐降低(P<0.05)。相关研究报道,氧化剂甲萘醌诱导ROS升高,可促进凋亡细胞死亡,通过抑制甲萘醌诱导的细胞ROS水平升高,或通过阻断解毒酶NAD(P)H︰醌氧化还原酶1(NQO1)来增强活性氧水平,从而抑制或增强凋亡细胞的死亡反应;此外,通过促进或抑制凋亡,胆汁酸TLCS诱导的ROS水平的类似操作改变了腺泡细胞的死亡[17]。线粒体衍生的ROS可以导致MPTP的开放进而导致细胞色素c的释放[18]。当急性胰腺炎发生时,超过1500 D的物质进入线粒体内膜,导致线粒体基质的高渗和水肿[19]。Bernardi[20]认为基质孔的发生取决于基质Ca,Pi和脂肪酸的刺激以及Mg和腺嘌呤核苷酸的抑制。由于线粒体外膜的可延展性小于内膜,所以线粒体膜受到伤害甚至破裂,从而导致细胞凋亡因子,细胞色素c等的释放[21]。同时,线粒体跨膜电位受损,MPTP广泛开放,ATP迅速耗尽,破坏细胞代谢的内部环境,提高降解酶的活性(例如蛋白酶、磷脂酶和核酸酶)[22-23]。因此,尽管MPTP的早期开放引起线粒体肿胀,不足以影响细胞内ATP的整体表达,但细胞功能也受到损伤。如果损伤因子持续存在,线粒体不断受到破坏,MPTP的持续不可逆开放将导致ATP的严重丢失、线粒体功能紊乱和胰腺细胞的不可逆损伤[24]。氧化应激因子的累积可以使胞内Ca累积,诱导MPTP开放,破坏细胞内ATP的合成,造成细胞炎症的发生,导致胰腺炎。
综上所述。胰腺炎患者体内氧化应激因子对胰腺炎病情显著相关,氧化应激可以造成MPTP过度开放,破坏胰腺线粒体内ATP的合成,导致胰腺细胞炎症的发生。通过基础研究寻找胰腺炎的机理,可为后期开发以MPTP为靶点治疗胰腺炎的药物提供理论依据。
參考文献
[1] PEERY A F,DELLON E S,LUND J,et al.Burden of gastrointestinal disease in the United States:2012 update[J].Gastroenterology,2012,143(5):1179-1187.
[2] PANDOL S J,SALUJA A K,IMRIE C W,et al.Acute Pancreatitis:Bench to the Bedside[J].Gastroenterology,2007,133:1127-1151.
[3] VORONINA S G,BARROW S L,SIMPSON A W,et al.
Dynamic Changes in Cytosolic and Mitochondrial ATP Levels in Pancreatic Acinar Cells[J].Gastroenterology,2010,138(5):1976-1987.
[4] HUANG W, BOOTH D M, CANE M C,et al.Fatty acid ethyl ester synthase inhibition ameliorates ethanol-induced Ca-dependent mitochondrial dysfunction and acute pancreatitis[J].Gut,2014,63(8):1313-1324.
[5] RAO S S C, HASLER W L.Can high-resolution anorectal manometry shed new light on defecatory disorders?[J].Gastroenterology,2013,144(2):263-265.
[6] ANAND S K,SINGH J,GABA A,et al.Effect of bovine adenovirus 3 on mitochondria[J].Veterinary Research,2014,45(1):45-52.
[7] CHAN D C.Mitochondria:dynamic organelles in disease,aging,and development[J].Cell,2006,125(7):1241-1252.
[8] BERNARDI P,RASOLA A,FORTE M,et al.The Mitochondrial Permeability Transition Pore:Channel Formation by F-ATP Synthase,Integration in Signal Transduction,and Role in Pathophysiology[J].Physiological Reviews,2015,95(4):1111-1155.
[9] SOHN E J,SHIN M J,KIM D W,et al.Tat-fused recombinant human SAG prevents dopaminergic neurodegeneration in a MPTP-induced Parkinson’s disease model[J].Molecules and cells,2014,37(3):226-233.
[10] BERNARDI P,DI LISA F.The mitochondrial permeability transition pore:molecular nature and role as a target in cardioprotection[J].J Mol Cell Cardiol,2015,78:100-106.
[11] SCHOENBERG M H,BIRK D,BEGER H G.Oxidative stress in acute and chronic-pancreatitis[J].The American Journal of Clinical Nutrition,1995,62(6 Suppl):1306S-1314S.
[12] DRYDEN G W JR,DEACIUC I,ARTEEL G,et al.Clinical implications of oxidative-stress and antioxidant therapy[J].Current Gastroenterology Reports,2005,7(4):308-316.
[13] BOOTH D M,MURPHY J A,MUKHERJEE R,et al.Reactive oxygen species induced by bile acid induce apoptosis and protect against necrosis in pancreatic acinar cells[J].Gastroenterology,2011,140(7):2116-2125.
[14] ADAM-VIZI V,CHINOPOULOS C.Bioenergetics and the formation of mitochondrial reactive oxygen species[J].Trends Pharmacol Sci,2006,27(12):639-645.
[15] HAMANAKA R B,CHANDEL N S.Mitochondrial reactive oxygen species regulate cellular signaling and dictate biological outcomes[J].Trends in Biochemical Sciences,2010,35(9):505-513.
[16] FORKINK M,SMEITINK J A,BROCK R,et al.Detection and manipulation of mitochondrial reactive oxygen species in mammalian cells[J].Biochim Biophys Acta,2010,1797(6-7):1034-1044.
[17] CRIDDLE D N,GILLIES S,BAUMGARTNER-WILSON H K,
et al.Menadione-induced reactive oxygen species generation via redox cycling promotes apoptosis of murine pancreatic acinar cells[J].Journal of Biological Chemistry,2006,281(52):40485-40492.
[18] NIKLISON-CHIROU M V,DUPUY F,PENA L B,et al.
Microcin J25 triggers cytochrome c release through irreversible damage of mitochondrial proteins and lipids[J].Int J Biochem Cell Biol,2010,42(2):273-281.
[19] HANDA O,MAJIMA A,ONOZAWA Y,et al.The role of mitochondria-derived reactive oxygen species in the pathogenesis of non-steroidal anti-inflammatory drug-induced small intestinal injury[J].Free Radic Res,2014,48(9):1095-1099.
[20] BERNARDI P.The mitochondrial permeability transition pore:a mystery solved?[J].Frontiers in Physiology,2013,4:95-102.
[21] ŠILEIKYTĖJ,BLACHLY-DYSON E,SEWELL R,et al.
Regulation of the mitochondrial permeability transition pore by the outer membrane does not involve the peripheral benzodiazepine receptor(Translocator Protein of 18 kDa(TSPO))[J].The Journal of Biological Chemistry,2014,289(20):13769-13781.
[22] ALAVIAN K N,BEUTNER G,LAZROVE E,et al.An uncoupling channel within the c-subunit ring of the F1FO ATP synthase is the mitochondrial permeability transition pore[J].Proceedings of the National Academy of Sciences,2014,111(29):10580-10585.
[23] PETRONILLI V,PENZO D,SCORRANO L,et al.The mitochondrial permeability transition,release of cytochrome c and cell death.Correlation with the duration of pore openings in situ[J].The Journal of Biological Chemistry,2001,276(15):12030-12034.
[24] BUDIHARDJO I,OLIVER H,LUTTER M,et al.Biochemical pathways of caspase activation during apoptosis[J].Annual Review of Cell and Developmental Biology,1999,15(1):269-290.
(收稿日期:2021-09-14) (本文編辑:田婧)

