我国医疗器械不良事件监测现状研究
王东京,吴维民
1. 广西医科大学 信息与管理学院,广西 南宁 530021;2. 广西壮族自治区医疗器械检测中心,广西 南宁 530031
引言
医疗器械不良事件监测是医疗器械上市后风险管理的重要手段[1]。我国医疗器械不良事件监测工作起步较晚,还存在各种各样的问题[2-3],需要加快解决、不断完善,深入分析和利用医疗器械监测数据对有效监控医疗器械风险具有重要意义[4]。本研究以国家药品监督管理局公布的2016—2020年度共计5份《国家医疗器械不良事件监测年度报告》数据为研究对象,分析近年来我国医疗器械不良事件的数量和质量,为医疗器械不良事件的监测和防范提供参考。
1 资料与方法
1.1 资料来源
国家药品监督管理局公布的2016—2020年度共计5份《国家医疗器械不良事件监测年度报告》。
1.2 分析方法
运用Excel 2019对报告中数据进行描述性分析。运用复合年均增长率反映相关指标的增幅大小和变动趋势,计算公式如下:

2 结果
2.1 全国医疗器械不良事件报告数情况
2016—2020年全国医疗器械不良事件报告数呈增长趋势,5年间复合年均增长率为10.99%;2016—2020年每百万人口平均报告数量呈增长趋势,其中2019—2020年增幅最大,5年间复合年均增长率为11.09%,见图1。

图1 全国医疗器械不良事件报告数和每百万人口平均报告数
2.2 全国医疗器械死亡和严重伤害不良事件报告情况
医疗器械死亡和严重伤害不良事件数包括死亡不良事件报告数和严重伤害不良事件报告数。从数量上看,2016—2020年全国医疗器械死亡和严重伤害不良事件总量呈下降趋势,5年间复合年均增长率为-10.90%;从占比上看,死亡和严重伤害不良事件在同年报告总数占比均呈下降趋势,5年间复合年均增长率为-19.74%,死亡和严重伤害不良事件占比由2016年的14.87%降至2020年的6.17%,见图2。

图2 2016—2020年全国医疗器械不良事件报告情况
2.3 全国医疗器械不良事件报告来源情况
2016—2020年系统注册基层数量持续增长,由2016年的231872家增至2020年的350973家,5年间复合年均增长率为10.92%,其中注册人增幅最大,5年间复合年均增长率为26.76%。从基层用户构成变化来看,注册人和经营企业占比不断增大,其中注册人占比增幅最大,但相对其他两个机构来说仍占较小比例,使用单位占比呈下降趋势,5年间复合年均增长率为-6.00%,见表1。

表1 2016—2020年“全国医疗器械不良事件监测系统”注册基层用户情况
2016—2020年全国医疗器械不良事件报告来源中注册人、经营企业和使用单位数量均持续增长,其中注册人增长幅度最大,5年间复合年均增长率为14.09%。从来源占比变化来看,使用单位一直保持主导地位,5年来维持在86%左右,占比呈增长趋势,注册人占比持续增长且增幅最大,经营企业呈下降趋势,见表2。
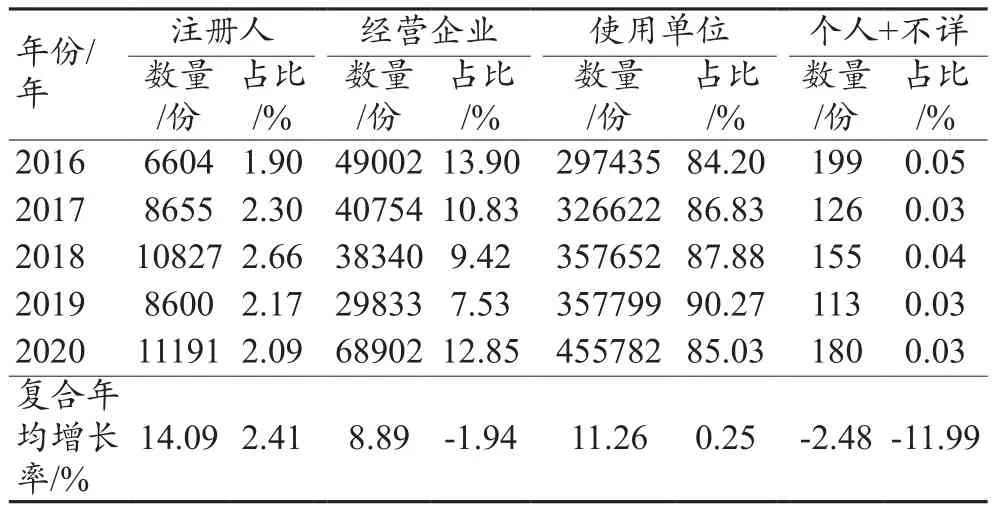
表2 2016—2020年全国医疗器械不良事件来源情况
2.4 引发医疗器械不良事件的管理类别
2016—2020年引发全国医疗器械不良事件的各个管理类别数量均持续增长,其中不详类别的医疗器械增幅最大,5年间复合年均增长率为37.92%。从引发类别占比变化来看,不详类别的医疗器械占比持续增长,且增幅最大,Ⅱ类医疗器械和Ⅲ类占比均较高,Ⅱ类医疗器械在2016—2020年数量持续增长,且占比居于首位,Ⅰ类和Ⅲ类医疗器械占比呈下降趋势,见表3。
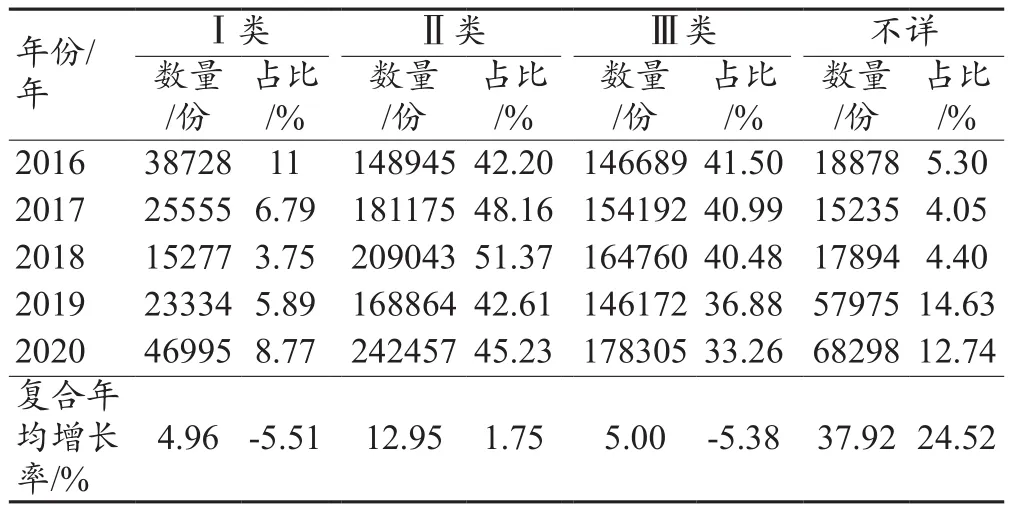
表3 2016—2020年全国医疗器械不良事件涉及医疗器械管理类别情况
2.5 医疗器械不良事件涉及的使用场所情况
从2016—2020年全国医疗器械不良事件涉及场所数量变化来看,医疗机构、家庭和其他地点均呈增长趋势,5年间复合年均增长率分别为13.33%、14.47%和13.16%。从涉及场所占比变化来看,医疗机构一直保持主导地位,且占比呈增长趋势,见表4。

表4 2016—2020年全国医疗器械不良事件涉及实际使用场所情况
3 讨论
3.1 全国医疗器械不良事件监测整体情况较好
研究结果表明,我国近年来全国医疗器械不良事件报告数与每百万人口平均报告数量稳定增长,且近年全国医疗器械死亡和严重伤害不良事件总量与死亡和严重伤害不良事件在同年报告总数占比均呈下降趋势。“全国医疗器械不良事件监测系统”注册人注册总量呈增长趋势,且在2019年后增幅变大,这与《医疗器械不良事件监测和再评价管理办法》(以下简称《办法》)的正式实施有关,《办法》要求医疗器械持有人、医疗器械经营企业和使用单位应当履行收集医疗器械不良事件的义务[5];国家相继出台一系列的文件,促进医疗器械管理科学化,《医疗器械使用质量监督管理办法》的实施,初步形成了以产品全生命周期为基础的医疗器械管理体系[6-7]。《医疗器械不良事件监测和再评价管理办法》的实施,使得监管体系覆盖各环节、多层次、全过程[8],全国医疗器械不良事件监测整体情况较好。
3.2 不同监测主体在不良事件上报中的积极性有差异
研究结果表明,注册人、经营企业和使用单位的全国医疗器械不良事件上报总量均呈上升趋势,说明各单位不良事件上报意识有所提升,也得益于相关法律法规的不断完善。但不同监测主体上报总量增长幅度和占比增长幅度有所差异,可以看出不同监测主体的不良事件上报积极性有差异,使用单位是医疗器械不良事件上报的主要来源,与黄晓玲等[9]、贾秀才等[10]和辛悦然等[11]的研究结果一致。“全国医疗器械不良事件监测系统”注册的基层用户中,经营企业占比最大,且占比呈增长趋势,但在实际上报来源中使用单位却是上报的主要来源,经营企业占比却呈萎缩趋势,这种相互矛盾现象的存在可能与对经营企业的监管取得较好的效果有关,也有可能是经营企业漏报,所以仍然有必要大力鼓励其积极切实上报不良事件。注册人的上报积极性还有待提高,“全国医疗器械不良事件监测系统”注册总量增幅(复合年均增长率26.76%)和医疗器械不良事件上报总量增幅(复合年均增长率14.09%)相差较大。近年部分学者研究结果中也显示在医疗器械不良事件上报中注册人不够积极[12-14],可能由注册人对医疗器械不良事件上报的认识不充分,未能充分考虑公众的医疗器械使用安全和医疗器械行业的良性发展,只担心影响企业声誉所致,面对医疗器械的不良事件,大部分使用者怀疑是产品质量不合格,而生产商往往不承认产品存在质量问题[15]。《办法》已强调注册人的主体责任[5],近5年注册人在“全国医疗器械不良事件监测系统”注册总量增幅和医疗器械不良事件上报总量增幅中增幅最大。
3.3 不详类别医疗器械引发不良事件数量及占比增长快
研究结果表明,我国近年不详类别医疗器械报告数量及占比呈增长趋势,且增长幅度大。不断增长的不详类别医疗器械上报数量确实是报告质量欠佳的体现[16],可能由以下3个原因所导致:① 主要由于监测信息系统中注册人未能及时维护产品信息,导致不详类别增长较快;② 《办法》对医疗器械不良事件的定义、报告范围、审核流程等进行了修订,对收到的医疗器械不良事件报告数量有一定影响[17],2019年《办法》实施后,不详医疗器械类别占比由2018年的4.40%增至2019年的14.63%;③ 上报人员对医疗器械分类知识不熟悉,未写明医疗器械类型。
3.4 医疗机构是不良事件主要涉及的实际使用场所
研究结果表明,近年来医疗机构一直是我国医疗器械不良事件上报涉及的主要场所,且同年占比也呈增长趋势,这与医疗机构对医疗器械不良事件的重视息息相关。我国颁布的《医疗器械使用质量监督管理办法》明确规定,医疗器械的使用单位应在每年开展涉及医疗器械质量管理的全面自查工作,并按照规定上报和处理相关不良事件[6]。《办法》要求使用单位应当履行收集医疗器械不良事件的义务,并将医疗器械不良事件监测纳入医疗机构质量安全管理重点工作[5]。但在医疗机构中仍存在未建立完善的不良事件监测机制、专业人才配备不足、医院监测制度流程不完善和人员专业知识欠缺等问题[18]。
4 对策
4.1 提升医疗器械不良事件监测认知,增强医疗器械监测能力
提升医疗器械不良事件监测认知、增强医疗器械监测能力是保障公众用械安全和医疗器械行业良性发展的重要保证。主要从以下几个方面着手改进:① 提升监管部门监管意识,提高自身的监管能力;精准开展医疗器械不良事件的培训,在培训前期对参与培训的监测单位开展培训需求调查,确保培训具有针对性和可操作性,切实提升各监测单位的医疗器械监测能力;② 提升注册人、经营企业和使用单位各环节的不良事件监测认知水平,特别是医疗器械直接使用者的使用主体,鼓励各环节全员全过程重视医疗器械不良事件的监测,加深对医疗器械相关知识、医疗器械不良事件监测相关政策和文件的了解,更好防范医疗器械不良事件的发生和开展科学的医疗器械不良事件监测;③ 加大对公众的医疗器械监测知识宣教力度。医疗器械不良事件监测起步比药品不良反应监测更晚,目前对大众的宣传力度依旧不足,家庭或个人对医疗器械不良事件的发现和报告并不完全了解,需加大对公众的医疗器械监测知识宣教力度,持续增强民众对安全使用医疗器械以及积极上报相关不良事件的意识和能力。
4.2 加大对不详类别医疗器械的关注,提升医疗器械不良事件报告质量
优质的医疗器械不良事件监测报告有利于对报告数据再分析和再研究,医疗器械不良事件的精确上报有利于更科学合理地开展医疗器械不良事件监测。医疗器械监管部门和医疗器械各监测主体应加大对不详类别医疗器械的分析,追究导致类别不详的原因,并提出针对性措施。可以从以下两个方面着手:① 各监测主体加强对医疗器械分类管理知识的学习和培训,弄清医疗器械的分类,精确上报医疗器械不良事件数据;② 对不详类别医疗器械进行及时分析和总结,找到导致不详类别的具体原因,采取相关措施及时改进。
4.3 强化医疗器械全生命周期科学管理,督促各监测主体积极如实上报
在医疗器械的管理实践中,我国长期以来一直处于以上市前管理为“重”,上市后管理为“轻”的管理模式[7],医疗器械不良事件的监测主体履职不到位[19]。《办法》的颁布,使医疗器械全生命周期的科学监管得以强化,明确了上市许可持有人是医疗器械不良事件监测及再评价的主体[5,8]。《办法》的颁布使不良事件的监测主体监测责任得以落实,为切实做好医疗器械上市后的监督管理工作提供了法律保障。同时新版“国家医疗器械不良事件监测信息系统”上线运行,随之变更的报告表格和上报流程将会给报告质量带来新挑战[20]。基于产品全生命周期管理,以《办法》为依据,有关部门针对医疗器械的管理重点应从上市前的审批转向上市后的监测,督促各监测主体积极如实上报。通过参考FDA经验完善检查机制,重视对医疗器械不良事件的现场检查,督促企业落实医疗器械不良事件报告的主体责任。
5 总结
做好医疗器械不良事件监测工作有利于保障医疗器械上市后的质量安全。随着相关法律法规和监管体系的不断完善,我国近年医疗器械不良事件监测整体情况较好,但仍存在一些问题,应从提升医疗器械不良事件监测认知、提高医疗器械不良事件报告质量、强化医疗器械全生命周期科学管理和督促各监测主体积极如实上报等方面来提升医疗器械不良事件监测能力。

